CARDIOMYOPATHIE URÉMIQUE
Transcription
CARDIOMYOPATHIE URÉMIQUE
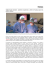
CARDIOMYOPATHIE URÉMIQUE par D.C. WHEELER* Malgré l’efficacité de la dialyse dans la prévention de la mort par urémie, les patients atteints d’insuffisance rénale chronique ont une espérance de vie très réduite, ce qui est en grande partie dû au développement d’une atteinte cardiovasculaire précoce. Dans l’ensemble, le risque ajusté à l’âge de mortalité cardiovasculaire ou d’infarctus myocardique non létal chez les patients en dialyse est de 17 fois supérieur à celui de la population générale [1]. La pathologie cardiovasculaire prédominante est une cardiomyopathie urémique, un terme utilisé pour décrire des modifications structurales et fonctionnelles du cœur qui surviennent en association avec l’insuffisance rénale chronique (fig. 1). De telles modifications incluent une augmentation de la masse ventriculaire gauche qui peut être détectée par l’échocardiographie chez 74 p. 100 des malades débutant un traitement par dialyse [2]. Cette augmentation s’accompagne fréquemment d’anomalies vasculaires comme par exemple, la rigidité [3], l’artériosclérose et les calcifications artérielles [4]. L’insuffisance cardiaque congestive qui est une manifestation clinique de la cardiomyopathie urémique, est présente chez environ un tiers des malades nouvellement dialysés bien que seulement un quart d’entre eux aient une angine de poitrine et moins de 10 p. 100 une histoire d’infarctus myocardique [5]. Alors que la diversité des atteintes cardiovasculaires compliquant l’insuffisance rénale chronique est bien établie à présent, le nombre d’essais cliniques ayant pour but d’évaluer l’impact de modifications de divers facteurs de risque sur le devenir cardiovasculaire chez de tels patients est remarquablement limité. Puisque les patients peuvent déjà avoir des anomalies bien établies des structures cardiaques au moment où ils débutent le traitement par dialyse, une intervention plus précoce semble s’imposer [6]. Notre revue a pour but de résumer l’état des connaissances actuelles de la cardiomyopathie urémique, en insistant tout particulièrement sur les stratégies thérapeutiques pouvant aider à en réduire la morbidité et la mortalité. * Center for Nephrology, Royal Free Campus, Royal Free and University College Medical School, University College London, United-Kingdom. FLAMMARION MÉDECINE-SCIENCES CARDIOMYOPATHIE URÉMIQUE — ACTUALITÉS NÉPHROLOGIQUES 2002 238 D.C. WHEELER FIG. 1. — Hypertrophie ventriculaire gauche concentrique chez un patient en insuffisance rénale chronique (étude post-mortem communiquée par le Dr Mary Sheppard). CARACTÉRISTIQUES ÉCHOCARDIOGRAPHIQUES ET CLINIQUES DE LA CARDIOMYOPATHIE URÉMIQUE Le diagnostic de la cardiomyopathie est généralement établi par la mesure des dimensions et de la fonction cardiaque à l’aide de l’échocardiographie. Cet examen est le plus souvent effectué chez les dialysés ayant atteint leur « poids sec ». De larges études épidémiologiques réalisées chez les patients sans atteinte rénale évidente ont établi les limites supérieures de la normale pour ces différentes mesures et les mêmes paramètres ont été adoptés pour définir l’hypertrophie et la dysfonction cardiaque dans la situation clinique de l’urémie [7]. En cas de cardiomyopathie urémique, l’épaisseur de la paroi ventriculaire gauche est généralement augmentée et cette anomalie peut être associée à une augmentation de la cavité ventriculaire. Une atteinte morphologique sévère peut se manifester aussi bien par une perturbation de la contractilité myocardique, conduisant à une réduction de la fraction d’éjection (dysfonction systolique), que par une diminution de la compliance ventriculaire gauche en diastole, pouvant être détectée par une analyse Doppler du débit sanguin à travers la valve mitrale (dysfonction diastolique) [8]. En plus de ces modifications des dimensions et fonctions ventriculaires, des investigateurs ont rapporté une échogénicité myocardique augmentée chez le malade urémique [9]. Cela pourrait refléter un degré de fibrose interstitielle et de calcification myocardique plus élevé dans la cardiomyopathie urémique par rapport à l’atteinte ventriculaire gauche observée chez les hypertendus non urémiques [9, 10]. La cardiomyopathie urémique peut être cliniquement silencieuse au stade précoce mais s’accompagner ensuite de dyspnée et de signes d’insuffisance cardiaque CARDIOMYOPATHIE URÉMIQUE 239 congestive. Alors que chez les dialysés, de tels symptômes et signes peuvent résulter d’une surcharge hydrosodée, une dysfonction cardiaque sous-jacente joue probablement un rôle majeur [11]. Une atteinte anatomique sévère associée à une dysfonction systolique compromet la réponse cardiaque aux modifications de la pression de remplissage et prédispose à une hypotension symptomatique au cours de la dialyse [12]. D’autres manifestations cliniques de la cardiomyopathie urémique incluent l’arythmie qui peut être exacerbée par l’hyperparathyroïdie et par l’ischémie ventriculaire et qui est souvent précipitée par des perturbations hydroélectrolytiques au cours de la dialyse [12, 13]. Puisque un ventricule gauche sévèrement atteint peut être incapable de maintenir une pression artérielle élevée, les patients atteints de cardiomyopathie urémique au stade terminal peuvent développer une hypotension artérielle. Cela peut expliquer pourquoi des pressions artérielles basses aussi bien qu’élevées peuvent être trouvées associées à un risque de mortalité accrue dans les études épidémiologiques effectuées dans des populations de dialysés [14]. L’hypotension au cours de la dialyse, bien que multifactorielle, est susceptible d’être le reflet d’une atteinte cardiaque sous-jacente. Sa présence a été trouvée associée à une réserve myocardique réduite en réponse à un stress pharmacologique [15]. PHYSIOPATHOLOGIE DE LA CARDIOMYOPATHIE URÉMIQUE Les modifications de la géométrie ventriculaire gauche qui caractérisent la cardiomyopathie urémique représentent des réponses d’adaptation à une augmentation du travail cardiaque résultant d’une surcharge de volume et de pression [16]. Chez les patients atteints d’insuffisance rénale chronique, la surcharge de volume peut résulter de la présence d’une fistule artérioveineuse, d’une rétention hydrosodée et d’une anémie alors que la surcharge pressive peut résulter d’une hypertension, d’une rigidité artérielle et d’une sténose aortique [17]. La surcharge de volume augmente la pression ventriculaire gauche au cours du remplissage et étire ainsi la paroi ventriculaire (augmentation du stress diastolique) [16]. Le cœur s’adapte en allongeant les myocytes existants et en augmentant ainsi les dimensions internes du ventricule gauche. Cela s’accompagne généralement d’un épaississement de la paroi, une adaptation qui réduit le stress s’exerçant sur la paroi. Ainsi la surcharge de volume peut finalement conduire à un ventricule caractérisé par une paroi épaisse et une cavité plus large, tout en ayant un rapport normal de l’épaisseur de paroi sur le diamètre interne (hypertrophie excentrique) (fig. 2). À l’inverse, la surcharge de pression augmente le stress sur la paroi au cours de la systole, conduisant à une prolifération myocytaire et un épaississement de paroi avec soit une préservation, soit une réduction du volume normal de la cavité (hypertrophie concentrique). Ces réponses d’adaptation à la surcharge de pression et de volume sont essentiellement bénéfiques. Ainsi la dilatation permet d’augmenter le débit cardiaque à niveau de dépense énergétique comparable, alors que l’épaississement de la paroi redistribue la tension accrue au niveau de la paroi sur une aire plus large et réduit ainsi la consommation d’énergie par myocytes [18]. 240 D.C. WHEELER Normal Surcharge de volume Surcharge de pression • Anémie • Hypertension • Surcharge hydrosodée • Rigidité artérielle • Fistule AV Hypertrophie concentrique Hypertrophie excentrique FIG. 2. — Mécanismes et types d’hypertrophie ventriculaire chez les patients en IRC. La surcharge de pression conduit à une augmentation de l’épaisseur de la paroi ventriculaire tout en préservant les volumes (hypertrophie concentrique). La surcharge de volume entraîne une dilatation du ventricule gauche. Celle-ci s’accompagne d’un épaississement secondaire (grisé) de la paroi qui entraîne une hypertrophie excentrique caractérisée par un rapport normal entre l’épaisseur de la paroi ventriculaire et le diamètre interne. À plus long terme, ces réponses d’adaptation, qui peuvent être initialement réversibles, peuvent conduire à un déficit énergétique chronique du myocyte et à la mort cellulaire [19]. Cela s’observe plus facilement en présence d’une atteinte coronarienne qui est un prédicteur indépendant de la dilatation ventriculaire gauche dans la population des urémiques [11]. De telles modifications, résultant d’une mauvaise adaptation à la surcharge de pression et de volume, peuvent également être aggravées par l’urémie qui peut agir par le biais des toxines urémiques, d’une activité sympathique excessive et d’anomalies endocriniennes [20]. Par exemple, un déficit en vitamine D peut contribuer à l’hyperplasie myocardique, alors qu’un excès d’hormone parathyroïdienne, d’angiotensine II et d’aldostérone a été incriminé dans la pathogénie de la fibrose myocardique interstitielle [20-22]. La calcification du myocarde et d’autres tissus mous peut résulter des perturbations du métabolisme phosphocalcique associées à l’urémie et peut, comme la fibrose, compromettre les réponses d’adaptation [23]. Finalement, l’urémie elle-même peut contribuer à la microangiopathie cardiaque et compromettre ainsi l’irrigation sanguine du muscle cardiaque hypertrophié et aggraver le déséquilibre entre l’approvisionnement et la demande énergétique du myocyte [24]. IMPACT DES ALTÉRATIONS ARTÉRIELLES SUR L’ATTEINTE MYOCARDIQUE La surcharge de volume et de pression entraîne des modifications similaires dans le système artériel ce qui peut aggraver l’atteinte cardiaque. La surcharge de volume conduit à une augmentation adaptative du diamètre luminal, et la surcharge de CARDIOMYOPATHIE URÉMIQUE 241 pression conduit à un épaississement de la paroi artérielle [25]. Des réponses inadaptées, éventuellement aggravées par l’urémie, comprennent la fibrose et la calcification de la média avec une diminution de la teneur en fibres élastiques pouvant conduire à une augmentation de la rigidité vasculaire [4, 26]. Ces altérations artérielles qui ressemblent à celles observées au cours de l’artériosclérose liée à l’âge, conduisent de façon caractéristique à une pression systolique élevée et une pression diastolique basse (c’est-à-dire une pression de pulsion augmentée) et s’accompagnent d’une augmentation de la vitesse de l’onde du pouls [27]. L’élévation de la pression systolique augmente le stress de la paroi ventriculaire gauche au cours de la systole et contribue ainsi à l’hypertrophie concentrique. La rigidité artérielle entraîne également un retour précoce de l’onde de pression artérielle après sa propagation à travers l’arbre artériel qui à son tour aggrave la surcharge pressive du ventricule gauche [28, 29]. De plus, une pression diastolique basse va compromettre le flux coronaire qui ne peut avoir lieu que lors de la relaxation cardiaque, et pourra ainsi potentiellement aggraver le déséquilibre entre l’apport et la demande en oxygène du myocyte et ainsi accélérer la mort myocytaire [29]. L’importance potentielle de ces altérations artérielles est soulignée par une étude récente montrant que la réflection précoce de l’onde artérielle est un facteur de prédiction indépendant de la mortalité cardiovasculaire et la mortalité globale chez les patients au stade de l’insuffisance rénale avancée [30]. PRÉVALENCE ET INCIDENCE DE LA CARDIOMYOPATHIE URÉMIQUE Plusieurs études d’observations ponctuelles ont étudié la prévalence de la cardiomyopathie chez des patients atteints à degrés divers d’insuffisance rénale. Elles ont révélé une hypertrophie ventriculaire gauche chez une plus grande proportion des malades ayant l’atteinte rénale la plus sévère ; par exemple 16 p. 100, 26 p. 100 et 50 p. 100 des malades ayant une clairance de la créatinine supérieure à 30 ml/min, de 10 à 30 ml/min et inférieure à 10 ml/min respectivement, avaient une hypertrophie ventriculaire gauche à l’examen échocardiographique [31]. Dans une cohorte personnelle de 369 malades, la proportion de ceux qui avaient une hypertrophie ventriculaire gauche à l’examen électrocardiographique allait de 12 p. 100 chez les patients du quintile avec l’atteinte rénale la plus modérée (clairance de la créatinine médiane de 44 ml/min) à 25 p. 100 dans le quintile avec l’atteinte la plus sévère (clairance de la créatinine médiane de 11 ml/min) [32]. Un suivi au long cours de tels patients nous permettra d’évaluer l’incidence de l’hypertrophie ventriculaire gauche. Ainsi, par exemple, parmi 191 malades en prédialyse avec une prévalence de base de 34 p. 100, 10,6 p. 100 d’entre eux ont développé une hypertrophie ventriculaire à l’échographie ultérieure après une période de 12 mois et une augmentation de l’indice de masse ventriculaire gauche (un paramètre dérivé) de 25 p. 100 [33]. Au moment de la mise en dialyse, la majorité d’entre eux aura une preuve échocardiographique d’hypertrophie ventriculaire gauche et environ un tiers d’entre eux aura des signes cliniques d’insuffisance cardiaque [2, 34]. À titre d’exemple, au cours d’une analyse ponctuelle effectuée chez 433 malades canadiens débutant leur dialyse, seulement 18 p. 100 d’entre eux présentaient un échocardiogramme normal [11]. Parmi les malades restants, 16 p. 100 présentaient une 242 D.C. WHEELER dysfonction systolique du ventricule gauche compatible avec une cardiomyopathie avancée, 41 p. 100 une hypertrophie ventriculaire concentrique et 28 p. 100 une dilatation ventriculaire gauche. Un suivi prospectif des patients mis en dialyse indique que la cardiomyopathie urémique peut évoluer progressivement vers une dilatation et un épaississement de la paroi du ventricule gauche [35], ainsi qu’une incidence de 25 p. 100 d’insuffisance cardiaque de novo sur une période de suivi de 41 mois [34]. Après transplantation rénale, les anomalies ventriculaires gauches tendent à régresser. Un sous-groupe de 102 malades parmi les 433 malades canadiens dialysés (voir plus haut) ayant bénéficié d’une greffe rénale au cours du suivi, présentait une distribution des anomalies échocardiographiques similaire à celles observées dans l’ensemble du groupe [36]. Un an après la transplantation, le nombre des malades avec une scintigraphie normale avait doublé, la masse et le volume ventriculaires gauches avaient diminué et la fonction systolique s’était normalisée chez quelques malades. SIGNIFICATION PRONOSTIQUE DE LA CARDIOMYOPATHIE URÉMIQUE Comme dans la population générale, les mesures échocardiographiques indiquant une cardiomyopathie peuvent prédire le devenir des malades atteints d’insuffisance rénale chronique. À titre d’exemple, une étude effectuée chez 91 malades dialysés montre que, par comparaison à des malades se trouvant dans le quartile inférieur de l’indice de masse ventriculaire gauche, ceux du quartile supérieur avaient un risque de 3,7 fois supérieur de mortalité cardiaque et globale [37]. Des études plus récentes ayant inclus un nombre de malades plus importants ont montré des résultats similaires. Dans la cohorte des 433 dialysés canadiens mentionnés plus haut, la survie médiane était de 38, 48, 56 et plus de 66 mois parmi ceux qui avaient une dysfonction systolique, une hypertrophie concentrique, une dilatation ventriculaire gauche ou une échographie normale respectivement (fig. 3) [11]. La durée médiane jusqu’au développement d’une insuffisance cardiaque avérée était de 19 mois chez les malades atteints d’une dysfonction systolique, par rapport à 38 mois, chez ceux qui avaient une hypertrophie concentrique, une dilatation combinée du ventricule gauche [11]. L’existence clinique d’une insuffisance cardiaque au début de la dialyse est également fortement prédictive d’un risque accru de mortalité. Dans une étude effectuée chez des malades dialysés, la survie médiane n’était que de 36 mois chez ceux qui étaient atteints d’une insuffisance cardiaque au début du temps d’observation, par rapport à 62 mois chez les malades sans insuffisance cardiaque [34]. Il est important de souligner que la régression échocardiographique de l’hypertrophie ventriculaire gauche réduit la probabilité de l’insuffisance cardiaque chez l’urémique, ce qui renforce la valeur de l’évaluation échocardiographique pouvant servir de marqueur de la sévérité de la cardiomyopathie urémique [38]. Malgré la régression de l’atteinte ventriculaire gauche après transplantation rénale, les mesures des dimensions ventriculaires gauches par échocardiographie en pré-transplantation gardent leur valeur prédictive quant au devenir des malades après la transplantation [39]. La mise en évidence électrocardiographique d’une 243 CARDIOMYOPATHIE URÉMIQUE 1,0 Probabilité de survie 0,8 0,6 Normal 0,4 HGV concentrique Dilatation VG 0,2 Dysfonction systolique 0 0 12 24 36 42 Temps (mois) 60 72 FIG. 3. — Survie à partir du début de la dialyse chez des patients ayant un échocardiogramme normal, une hypertrophie ventriculaire gauche concentrique, une dilatation ventriculaire gauche ou une dysfonction systolique (d’après [11], Parfrey et al, avec autorisation de l’éditeur). atteinte ventriculaire gauche, à l’exception de l’hypertrophie ventriculaire gauche pure, peut avoir la même valeur prédictive [40]. FACTEURS DE RISQUE DE LA CARDIOMYOPATHIE URÉMIQUE Les facteurs de risque potentiels pour le développement d’une insuffisance cardiaque congestive dans la population générale ont été établis sur la base d’études fondées sur une observation au long cours. À titre d’exemple, parmi les résidents de Framingham, l’âge avancé, une atteinte cardiaque sous-jacente, une hypertension systolique, un diabète, une protéinurie, une obésité et la cigarette étaient des facteurs prédisant une insuffisance cardiaque de novo [41]. Parmi 432 patients prévalents atteints d’insuffisance rénale chronique, l’âge avancé, le diabète, la dysfonction systolique à l’échocardiogramme et la présence d’une ischémie myocardique étaient associés à une insuffisance cardiaque au début de la dialyse [34]. Une étude plus large de 4 024 malades incidents a conduit à l’identification de l’âge, de l’hypertension artérielle, du diabète, de la présence d’une artériosclérose, d’anomalies cardiaques anatomiques, d’une hypercalcémie, d’une hyperphosphatémie et d’une hypoalbuminémie comme facteurs déterminants indépendants de l’insuffisance cardiaque congestive au cours d’une analyse ponctuelle [42]. Le sexe masculin, la pression artérielle systolique, l’indice de masse corporelle et la concentration d’hémoglobine ont été identifiés comme facteurs de corrélation indépendants de l’hypertrophie ventriculaire gauche mesurée par écho/ou électrocardiographie dans 244 D.C. WHEELER TABLEAU I. — FACTEURS VENTRICULAIRE DE RISQUE ASSOCIÉS DE FAÇON INDÉPENDANTE À L’HYPERTROPHIE GAUCHE ET À L’INSUFFISANCE CARDIAQUE CHEZ LES PATIENTS EN INSUFFISANCE RÉNALE CHRONIQUE (LES RÉFÉRENCES SONT INDIQUÉES). HYPERTROPHIE VENTRICULAIRE GAUCHE INSUFFISANCE CARDIAQUE CONGESTIVE Hémoglobine [11, 31, 33, 35] Anémie [34] Hypertension [11, 33, 31] Hypertension [34, 42] Hypoalbuminémie [11] Hypoalbuminémie [34, 42] Atteinte cardiaque ischémique [11] Paramètres d’athérosclérose [34, 42] Epaississement de l’intima-média-carotidien [28] Âge élevé [34, 42] Index de masse corporelle [31] Diabète sucré [34, 42] Hyperphosphorémie [42] Hypercholestérolémie [42] des populations de malades en prédialyse [31-33]. Dans une étude de malades en prédialyse, une progression de l’hypertrophie ventriculaire gauche sur 12 mois était plus probable chez ceux d’entre eux qui avaient une baisse plus grande de l’hémoglobine et une élévation plus grande de la pression artérielle systolique [33]. L’anémie était également associée à l’hypertrophie ventriculaire gauche dans une étude effectuée chez les dialysés suivis au cours de leur première année de traitement [35]. Dans leur ensemble (Tableau I), ces observations indiquent que des stratégies thérapeutiques visant à ralentir la progression de la cardiomyopathie chez des malades atteints d’insuffisance rénale chronique comportent le contrôle de la pression artérielle et du diabète ainsi qu’une correction précoce de l’anémie et des anomalies du métabolisme phosphocalcique. Malheureusement, alors que plusieurs interventions ont montré de façon indiscutable une amélioration du devenir des insuffisants cardiaques dans la population générale [43], nous ne disposons pas de données directes, à partir d’essais cliniques randomisés et contrôlés, de l’efficacité de telles stratégies thérapeutiques chez les malades atteints d’insuffisance rénale chronique. TRAITEMENT DE LA CARDIOMYOPATHIE URÉMIQUE Correction de l’hypertension et utilisation de médications antihypertensives spécifiques La correction de l’hypertension a fait ses preuves, dans la population générale, quant à la prévention non seulement de l’insuffisance cardiaque mais encore de l’infarctus du myocarde et de l’accident vasculaire cérébral [44]. De plus, certains agents antihypertenseurs peuvent exercer des effets plus spécifiquement bénéfiques, de par leur mécanisme d’action, chez les patients atteints d’insuffisance cardiaque, au-delà de leur capacité de contrôler la pression artérielle. Plusieurs essais cliniques ont démontré que, par rapport aux placebos, les inhibiteurs de l’enzyme de conversion (IEC) atténuent les symptômes, préservent la fonction cardiaque et prolongent la vie quel que soit le degré d’insuffisance cardiaque [45]. Les antagonistes des CARDIOMYOPATHIE URÉMIQUE 245 récepteurs de l’angiotensine II peuvent avoir les mêmes effets bénéfiques. De plus, puisque des voies indépendantes des IEC peuvent être impliquées dans la production du puissant vasoconstricteur qu’est l’angiotensine II, ces agents peuvent exercer des effets additifs [46]. Les bêtabloqueurs (bisoprolol et métoprolol) peuvent améliorer la survie dans l’insuffisance cardiaque débutante à modérée alors que le carvédilol est bénéfique pour les patients atteints d’insuffisance cardiaque sévère et a une tolérance remarquable [47-49]. La spironolactone, un antagoniste de l’aldostérone, a également fait ses preuves quant à la réduction de la mortalité des patients souffrant d’une insuffisance cardiaque sévère et recevant un traitement inhibiteur par IEC [50]. Dans une étude récente, l’administration de digoxine a conduit à une réduction des hospitalisations motivées par une aggravation de l’insuffisance cardiaque chez les patients sans fibrillation auriculaire [51]. On ne peut cependant pas facilement extrapoler les résultats de ces études aux malades insuffisants rénaux chroniques. Premièrement, la pathologie cardiaque de l’urémie est différente de celle de l’insuffisance cardiaque de la population générale. Deuxièmement, un certain nombre des médicaments mentionnés, en particulier la spironolactone, ne peuvent être utilisés chez des patients ayant eu une détérioration sévère de la fonction rénale, en raison des effets secondaires métaboliques. Ainsi, les ratios risques/bénéfices peuvent être différents dans l’insuffisance rénale chronique et la réduction de la mortalité cardiovasculaire peut être annihilée par des issues létales dues à des effets secondaires sérieux comme l’hyperkaliémie. Cependant, en l’absence de données à partir d’essais cliniques, les recommandations actuelles des experts vont dans le sens d’un contrôle plus étroit de la pression artérielle et en faveur de l’utilisation des IEC qui, dans une étude à effectifs limités, chez des malades atteints d’insuffisance rénale terminale, a conduit à la régression de l’hypertrophie ventriculaire gauche, par rapport à l’effet d’un inhibiteur des canaux calciques [52]. Correction de l’anémie Le traitement de l’anémie chez les insuffisants rénaux chroniques (par l’érythropoïétine, la supplémentation en fer ou les transfusions) rend réversible les modifications hémodynamiques associées comme par exemple l’augmentation de la résistance vasculaire périphérique, le volume d’éjection et le débit cardiaque [53, 54]. Des études de petite taille chez des malades en prédialyse et en dialyse ont montré que de telles interventions sont associées avec une réduction de la masse ventriculaire gauche [54-56]. Il n’est cependant pas clair dans quelle mesure la correction de l’anémie pourra prévenir les événements cardiovasculaires et prolonger la vie des patients atteints d’insuffisance rénale chronique. Puisque les cliniciens refusent généralement de ne pas administrer de l’érythropoïétine à cause de ses effets bénéfiques en terme de bien-être des patients, des essais cliniques récemment débutés ont pour but d’évaluer l’impact de différentes concentrations d’hémoglobine cibles à atteindre ou la valeur d’un traitement préemptif par rapport à un traitement tardif. Dans un de ces essais, chez des hémodialysés chroniques avec une augmentation de la masse ventriculaire gauche asymptomatique, les patients ont été randomisés soit à une correction partielle, soit à une correction totale de leur anémie. Chez les malades ayant un cœur normal à l’entrée, la normalisation de l’hémoglobine a prévenu la survenue d’une dilatation ventriculaire gauche alors qu’elle était incapable d’induire une régression chez ceux qui avaient déjà une 246 D.C. WHEELER atteinte ventriculaire gauche établie [57]. Un autre essai similaire, mais entrepris cette fois-ci chez les dialysés avec une atteinte cardiaque établie, a été interrompu prématurément en raison d’un taux plus élevé de perte des accès vasculaires et une diminution de l’efficacité du traitement dialytique chez les patients randomisés dans le groupe visant à une normalisation de l’hémoglobine [58]. Une analyse intérimaire avait conclu à l’impossibilité de cet essai clinique d’obtenir une différence significative des taux de mortalité cardiaque entre les deux cibles d’hémoglobine. L’état actuel des connaissances nous encourage par conséquent à procéder à une correction précoce de l’anémie chez les urémiques chroniques mais pas une normalisation de l’hémoglobine chez ceux qui ont déjà une atteinte cardiaque établie. Alors qu’une hémoglobine normale peut ne pas être bénéfique pour les sujets atteints de cardiomyopathie urémique, une correction partielle de l’anémie peut être désirable dans la situation clinique d’une insuffisance cardiaque sévère chez des malades ayant une fonction rénale normale ou quasi normale. Une récente étude randomisée et contrôlée, de taille réduite, effectuée chez 32 malades porteurs d’une insuffisance cardiaque de type III ou IV a montré que par rapport à l’absence de tout traitement, la correction partielle de l’anémie avec de l’érythropoïétine et du fer intraveineux était associée à une amélioration des symptômes, une réduction des besoins en diurétiques et un raccourcissement des séjours en hospitalisation [59]. Contrôle du diabète Il est bien connu que des hypertendus diabétiques ont une masse cardiaque plus élevée et une fibrose myocardique plus prononcée que les sujets non diabétiques ayant un degré comparable d’hypertension artérielle, ce qui suggère que le diabète comme l’urémie, contribuent à la cardiomyopathie, peut-être comme une conséquence de l’atteinte microvasculaire [60]. À l’heure actuelle, des études visant à contrôler la glycémie de façon intense n’ont pas permis de montrer un bénéfice quelconque en terme de devenir cardiovasculaire si on les compare au traitement conventionnel, bien que la réduction prouvée des complications microvasculaires rende le contrôle métabolique strict du diabète hautement désirable [61]. Autres interventions Plusieurs facteurs de risque associés à la cardiomyopathie urémique tels l’âge et le sexe ne sont pas modifiables. D’autres facteurs comprenant l’hypoalbuminémie peuvent ne pas être directement impliqués, mais représenter des marqueurs d’autres pathologies (comme par exemple l’inflammation ou la malnutrition) qui peuvent contribuer à la mort myocytaire. Encore d’autres facteurs de risque potentiellement modifiables incluent l’hyperparathyroïdie, l’hypercalcémie et l’hyperphosphatémie dont la correction peut prévenir la fibrose et la calcification myocardique. Un produit phosphocalcique élevé peut également contribuer à la calcification de la valve aortique qui, bien qu’étant fréquemment observée chez les urémiques chroniques [62], ne conduit à un rétrécissement fonctionnellement significatif que dans un petit nombre de cas [62, 63]. Alors que la présence d’une fistule artérioveineuse conduit à une augmentation du retour veineux et contribue ainsi à une surcharge de volume, la valeur de la ligature de fistule persistant après une transplantation rénale réussie reste incertaine. CARDIOMYOPATHIE URÉMIQUE 247 CONCLUSION La cardiomyopathie urémique représente la pathologie cardiovasculaire dominante chez les malades atteintes d’insuffisance rénale chronique. Elle est une cause importante de mort précoce chez les dialysés et les transplantés rénaux. L’insuffisance rénale chronique s’accompagne de plusieurs modifications bien caractérisées de la structure cardiaque, notamment d’un épaississement de la paroi du ventricule gauche et d’une augmentation du volume ventriculaire gauche. Ces modifications représentent des adaptations à une augmentation du travail cardiaque, résultant avant tout de l’anémie et de l’hypertension artérielle. Alors que de telles modifications d’adaptation améliorent l’efficacité du travail cardiaque, elles ne peuvent pas être maintenues au long cours et finissent par entraîner des altérations cardiaques irréversibles et par compromettre la fonction cardiaque. Les modifications résultant de cette adaptation inadéquate sont caractérisées par une fibrose myocardique qui peut être aggravée par les anomalies métaboliques et endocriniennes associées à l’urémie et par une ischémie résultant de lésions coronaires et d’une atteinte microvasculaire. Les modifications de structure et de fonction qui caractérisent la « cardiomyopathie urémique » peuvent être facilement détectées par l’ultrasonographie cardiaque et conduire à des symptômes et des signes cliniques de l’insuffisance cardiaque, caractérisés par une sensibilité accrue à la surcharge volumique et une instabilité hémodynamique pendant les séances d’hémodialyse. Il est important de souligner que l’hypertrophie ventriculaire gauche et l’insuffisance cardiaque sont des facteurs de prédiction indépendants de la survie des malades traités par épuration extrarénale. Plusieurs facteurs de risque potentiellement réversibles de cette cardiomyopathie urémique, comme par exemple l’anémie et l’hypertension, ont été identifiés chez les malades atteints d’insuffisance rénale chronique. Alors qu’un certain nombre d’interventions ont fait leur preuve, quant à leur impact bénéfique sur la morbidité et mortalité chez les insuffisants cardiaques sans atteinte rénale, il n’est pas encore clair dans quelle mesure ces données peuvent être extrapolées au traitement de la cardiomyopathie urémique. Il faut souligner la nécessité d’une détection précoce des anomalies cardiovasculaires associées à l’urémie et aussi notre besoin d’études cliniques bien conçues et suffisamment puissantes pour répondre à cette question. En attendant, il nous semble raisonnable pour des malades ne participant pas à de telles études, de pouvoir bénéficier de stratégies thérapeutiques ayant fait leurs preuves dans d’autres populations de patients, à condition toutefois qu’il n’y ait pas de contre-indication évidente. Remerciements Nous remercions très vivement le Professeur Tilman Drüeke qui a bien voulu se charger de la traduction de ce texte. 248 D.C. WHEELER BILBLIOGRAPHIE 1. FOLEY RN, PARFREY PS, SARNAK MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am J Kidney Dis, 1998, 32, S112-S119. 2. FOLEY RN, PARFREY PS, HARNETT JD et al. Clinical and echocardiographic disease in patients starting end-stage renal disease therapy. Kidney Int, 1995, 47, 186-192. 3. LONDON GM, MARCHAIS SJ, GUERIN AP et al. Cardiac and arterial interations in end-stage renal disease. Kidney Int, 1996, 50, 600-608. 4. SCHWARZ U, BUZELLO M, RITZ E et al. Morphology of coronary atherosclerotic lesions in patients with end-stage renal failure. Nephrol Dial Transplant, 2000, 15, 218-223. 5. Anonymous. Excerpts from the USRDS 1999 Annual Report. Am J Kidney Disease, 1999, 34, S1-S176. 6. BAIGENT C, BURBURY K, WHEELER D. Premature cardiovascular disease in chronic renal failure. Lancet, 2000, 356, 147-152. 7. LEVY D, SAVAGE DD, GARRISON RJ et al. Echocardiographic criteria for left ventricular hypertrophy : the Framingham Heart Study. Am J Cardiol, 1987, 59, 956-960. 8. RIGATTO C, PARFREY PS, LONDON GM. Cardiac hypertrophy in end-stage renal failure. In : Loscalzo J and London GM (eds) : Cardiovascular disease in end-stage renal failure, Oxford, Oxford University Press, 2000, 157-173. 9. MORALES MA, FERDEGHINI EM, PIZZARELLI F et al. Characterization of myocardial tissue in patients undergoing maintenance hemodialyis by quantitative echocardiography. J Am Soc Echocardiogr, 1996, 9, 480-487. 10. MALL G, HUTHER W, SCHNEIDER J, et al. Diffuse intermyocardial fibrosis in uraemic patients. Nephrol Dial Transplant, 1990, 5, 39-44. 11. PARFREY PS, FOLEY RN, HARNETT JD et al. Outcomes and risk factors for left ventricular disorders in chronic uraemia. Nephrol Dial Transplant, 1996, 11, 1277-1285. 12. LEUNISSEN KML, KOOMAN JP, VAN DER SANDE FM. Hemodynamic instability, arrhythmias, and dialysis reactions. In : Loscalzo J and London GM (eds) : Cardiovascular disease in end-stage renal failure, Oxford, Oxford University Press, 2000, 335-363. 13. SOLDATI L, ADAMO D, MANUNTA P et al. Erythrocyte calcium influx is related to severity of ventricular arrhythmias in uraemic patients. Nephrol Dial Transplant, 2001, 16, 85-90. 14. ZAGER PG, NIKOLIC J, BROWN RHET et al. « U » curve association of blood pressure and mortality in haemodialysis patients. Kidney Int, 1998, 54, 561-569. [erratum Kidney Int, 1998, 54, 1417]. 15. POLDERMANS D, MAN IN’T VELD AJ, RAMBALDI R et al. Cardiac evaluation in hypotension-prone and hypotension-resistant hemodialysis patients. Kidney Int, 1999, 56, 1905-1911. 16. LONDON G, Pathophysiology of cardiovascular damage in the early renal population. Nephrol Dial Transplant 2001, 16, 3-6. 17. PARFREY PS, FOLEY RN. The clinical epidemiology of cardiac disease in chronic renal failure. J Am Soc Nephrol, 1999, 10, 1606-1615. 18. MEEUS F, KOURILSKY O, GUERIN AP et al. Pathophysiology of cardiovascular disease in hemodialysis patients. Kidney Int, 2000, 58 (suppl 76), S140-S147. 19. KATZ AM. Cardiomyopathy of overload. A major determinant of prognosis in congestive heart failure. N Engl J Med, 1990, 322, 100-110. 20. AMANN K, RITZ E. Cardiac disease in chronic uremia : pathophysiology. Adv Ren Replace Ther, 1997, 4, 212-224. 21. ROSTAND SG, DRUEKE TB. Parathyroid hormone, vitamin D, and cardiovascular disease in chronic renal failure. Kidney Int, 1999, 56, 383-392. 22. SUZUKI H, SCHAEFER L, LING H et al. Prevention of cardiac hypertrophy in experimental chronic renal failure by long-term ACE inhibitor administration : potential role for lysosomal proteinases. Am J Nephrol, 1995, 15, 129-136. 23. HSU CH. Are we mismanaging calcium and phosphate metabolism in renal failure ? Am J Kidney Dis, 1997, 29, 641-649. 24. AMANN K, RITZ E. Microvascular disease – the Cinderella of uraemic heart disease. Nephrol Dial Transplant, 2000, 15, 1493-1503. CARDIOMYOPATHIE URÉMIQUE 249 25. GIBBONS GH, DZAU VJ. The emerging concept of vascular remodelling. N Engl J Med, 1994, 330, 1431-1438. 26. LONDON GM. Increased arterial stiffness in endstage renal failure : why is it of interest to the clinical nephrologist ? Nephrol Dial Transplant, 1994, 9, 1709-1713. 27. SAFAR ME, LEVY BI, LAURENT S et al. Hypertension and the arterial system : clinical and therapeutic aspects. J Hypertens, 1990, 8, S113-S119 28. LONDON GM, GUERIN AP, MARCHAIS SJ et al. Cardiac and arterial interactions in end-stage renal disease. Kidney Int, 1996, 50, 600-608. 29. O’ROURKE MF, KELLY RP. Wave reflection in the systemic circulation and its implications in ventricular function. J Hypertens, 1993, 11, 327-337. 30. LONDON GM, BLACHER J, PANNIER B et al. Arterial wave reflections and survival in end-stage renal failure. Hypertension, 2001, 38, 434-438. 31. TUCKER B, FABBIAN F, GILES M et al. Left ventricular hypertrophy and ambulatory blood pressure monitoring in chronic renal failure. Nephrol Dial Transplant, 1997, 12, 724-728. 32. LANDRAY MJ, THAMBYRAJAH J, MCGLYNN FJ et al. Epidemiological evaluation of known and suspected cardiovascular risk factors in chronic renal impairment. Am J Kidney Dis, 2001, 38, 537546. 33. LEVIN A, THOMPSON CR, ETHIER J et al. Left ventricular mass index increases in early renal disease. Impact of decline in haemoglobin. Am J Kidney Dis, 1999, 34, 125-134. 34. HARNETT JD, FOLEY RN, KENT GM et al. Congestive heart failure in dialysis patients : Prevalence, incidence, prognosis and risk factors. Kidney Int, 1995, 47, 884-890. 35. FOLEY RN, PARFREY PS, KENT GM et al. Long-term evolution of cardiomyopathy in dialysis patients. Kidney Int, 1998, 54, 1720-1725. 36. PARFREY PS, HARNETT JD, FOLEY RN et al. Impact of renal transplantation on uremic cardiomyopathy. Transplant, 1995, 60, 908-914. 37. SILBERBERG JS, BARRE PE, PRICHARD SS et al. Impact of left ventricular hypertrophy on survival in end stage renal disease. Kidney Int, 1989, 36, 286-290. 38. FOLEY RN, PARFREY PS, KENT GM et al. Serial change in echocardiographic parameters and cardiac failure in end-stage renal disease. J Am Soc Nephrol, 2000, 11, 912-916. 39. MCGREGOR E, STEWART G, RODGER RS et al. Early echocardiographic changes and survival following renal transplantation. Nephrol Dial Transplant, 2000, 15, 93-98. 40. WOO YM, MCLEAN D, KAVANAGH D et al. The influence of pre-operative electrocardiographic abnormalities, cardiovascular risk factors on patients and graft survival following renal transplantation (in press). 41. HO KK, PINSKY JL, KANNEL WB et al. The epidemiology of heart failure : the Framingham Study. J Am Coll Cardiol, 1993, 22, 6A-13A. 42. STACK AG, BLOEMBERGEN WE. A cross-sectional study of the prevalence and clinical correlates of congestive heart failure among incident US dialysis patients. Am J Kidney Dis, 2001, 38, 9921000. 43. LONN E, MCKELVIE R. Drug treatment in heart failure. BMJ, 2000, 320, 1188-1192. 44. BLACK HR. Blood pressure control. Am J Med, 1996, 101 (4A), 50S-55S. 45. KHALIL ME, BASHER AW, BROWN EJ et al. A remarkable medical story : benefits of angiotensinconverting enzyme inhibitors in cardiac patients. J Am Coll Cardiol, 2001, 37, 1757-1764. 46. MIURA S, IDEISHI M, SAKAI T et al. Angiotensin II formation by an alternative pathway during exercise in humans. J Hypertens, 1994, 12, 1177-1181. 47. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II) : a randomised trial. Lancet, 1999, 353, 9-13. 48. Effect of metoprolol CR/XL in chronic heart failure : Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet, 1999, 353, 2001-2007. 49. PACKER M, COATS AJ, FOWLER MB et al. Cavedilol Prospective Randomized Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med, 2001, 344, 1651-1658. 250 D.C. WHEELER 50. PITT B, ZANNAD F, REMME WJ et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med, 1999, 341, 709-717. 51. The effect of digoxin on mortality and morbidity in patients with heart failure. The Digitalis Investigation Group. N Engl J Med, 1997, 336, 525-533. 52. LONDON GM, PANNIER B, GUERIN AP et al. Cardiac hypertrophy, aortic compliance, peripheral resistance, and wave reflection in end-stage renal disease. Comparative effects of ACE inhibition and calcium channel blockade. Circulation, 1994, 90, 2786-2796. 53. FELLNER SK, LANG RM, NEUMANN A et al. Cardiovascular consequences of correction of the anemia of renal failure with erythropoietin. Kidney Int, 1993, 44, 1309-1315. 54. PORTOLES J, TORRALBO A, MARTIN P et al. Cardiovascular effects of recombinant human erythropoietin in predialysis patients. Am J Kidney Dis, 1997, 29, 541-548. 55. SIKOLE A, POLENAKOVIC M, SPIROVSKA V et al. Analysis of heart morphology and function following erythropoietin treatment of anemic dialysis patients. Artif Organs, 1993, 17, 977-984. 56. MASSIMETTI C, PONTILLO D, FERIOZZI S et al. Impact of recombinant human erythropoietin treatment on left ventricular hypertrophy and cardiac function in dialysis patients. Blood Purif, 1998, 16, 317-324. 57. FOLEY RN, PARFREY PS, MORGAN J et al. Effect of hemoglobin levels in hemodialysis patients with asymptomatic cardiomyopathy. Kidney Int 2000, 58, 1325-1335. 58. BESARAB A, BOLTON WK, BROWNE JK et al. The effects of normal as compared to low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Eng J Med, 1998, 339, 584-590. 59. SILVERBERG D, WEXLER D, SHEPS D et al. The effect of correction of mild anemia in severe, resistant congestive heart failure using subcutaneous erythropoietin and intravenous iron : a randomized controlled study. J Am Coll Cardiol, 2001, 37, 1775-1780. 60. GROSSMAN E, MESSERLI FH. Diabetic and hypertensive heart disease. Ann Intern Med, 1996, 125, 304-310. 61. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet, 1998, 352, 837-853. 62. RIBEIRO S, RAMOS A, BRANDAO A et al. Cardiac valve calification in haemodialysis patients : role of calcium-phosphate metabolism. Nephrol Dial Transplant, 1998, 13, 2037-2040. 63. RAINE AE, Acquired aortic stenosis in dialysis patients. Nephron, 1994, 68, 159-168.