CARDIOPATHIES CONGENITALES
Transcription
CARDIOPATHIES CONGENITALES
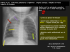
CARDIOPATHIES CONGENITALES Les 10 points fondamentaux 1. 2. 3. La CIA est une cardiopathie congénitale fréquente longtemps bien tolérée La CIA se complique de troubles du rythme auriculaire et d’une insuffisance cardiaque droite La CIA réalise un shunt gauche droit comme la CIV. Dans la CIA l’importance du shunt est déterminée par la compliance des 2 ventricules, dans la CIV par les résistances à l’éjection des 2 ventricules. 4. La CIV est d’autant mieux tolérée que la communication est plus petite et que le souffle est important 5. Le traitement de la CIA et de la CIV reposent sur la fermeture de la communication 6. La tétralogie de Fallot associe une CIV large avec une sténose pulmonaire serrée ; c’est une cardiopathie cyanogène, dont la sévérité clinique dépend du degré de sténose pulmonaire. 7. Dans la tétralogie de Fallot le pronostic actuel dépend du développement de la voie pulmonaire, difficile à reconstituer chirurgicalement 8. Le canal artériel est maintenu ouvert pendant la grossesse par les kinines (les anti-inflammatoires risquent de le fermer, la perfusion de prostacycline le maintient ouvert) 9. Le canal artériel réalise un shunt gauche droit dont la fermeture chirurgicale est simple. 10. La sténose pulmonaire se révèle d’autant plus tôt qu’elle est plus serrée : c’est au maximum une cardiopathie cyanogène de la naissance, mais elle ne se manifeste parfois que pendant la vie adulte par des malaises d’effort (absence d’augmentation du débit cardiaque). Communication inter auriculaire (G Jondeau) 10% des cardiopathies congénitales chez les enfants, 40% des cardiopathies congénitales chez les adultes de plus de 40 ans Anatomopathologie 3 types de communication inter-auriculaire peuvent être reconnues selon le siège de l'orifice: Sinus venosus haut situé, proche de l'abouchement des veines pulmonaires (souvent associé à un retour veineux pulmonaire anormal) Ostium primum bas , peut s'intégrer dans un canal atrio-ventriculaire plus complet (Anomalies des valves auriculo-ventriculaires et communication inter-ventriculaire type admission) Ostium secondum foramen ovale (à différentier d'un foramen ovale persistant, présent dans 20% de la population adulte normale), souvent associés à un prolapsus valvulaire mitral qui disparaît avec la cure de la communication inter-auriculaire Lutembacher rétrécissement mitral + communication inter-auriculaire tricuspide VCS sinus veinosus ostium secondum VD OD ostium primum VCI Hémodynamique réalise un shunt des cavités gauches vers les cavités droites L'importance de ce shunt dépend de 1) la taille de la communication inter-auriculaire qui transforme ± les 2 oreillettes en une cavité unique, et 2) la compliance relative du ventricule droit et du ventricule gauche. En effet, c'est en diastole que survient le shunt, alors que les valves mitrale et tricuspide sont ouvertes. Le ventricule qui est capable d'augmenter le plus son volume sans élever sa pression (le plus compliant), est celui vers lequel va aller le + de sang. Le ventricule droit étant celui qui est le plus compliant est celui qui se remplit le plus et le shunt est donc des cavités gauches vers les cavités droites. A la naissance: les résistances pulmonaires vont baisser progressivement et le ventricule droit va devenir moins épais (plus compliant). A l'inverse, la résistance à l'éjection du ventricule gauche augmente et le ventricule gauche se muscle (et devient moins compliant). Le shunt des cavités gauches vers les cavités droites augmente donc. Chapitre X, page 1 tableau Clinique Signes fonctionnels Les enfants sont le plus souvent asymptomatiques, mais présentent parfois de nombreuses infection pulmonaire, reflet du grand débit pulmonaire. C'est souvent chez les adultes que les signes fonctionnels apparaissent: troubles du rythme auriculaire (reflet de la dilatation de l'oreillette droite), hypertension artérielle pulmonaire exceptionnelle (altérations artériolaires pulmonaires, mais le complexe d'Eisenmenger est exceptionnel.) ou même une insuffisance cardiaque (surcharge ventriculaire droite chronique, développement insuffisance mitrale). Enfin, existe un risque d'embolie paradoxale (veine -> oreillette droite -> oreillette gauche -> systémique). Signes physiques Il existe un souffle systolique (de débit, réalisant un rétrécissement pulmonaire fonctionnel) et un dédoublement du B2 non modifié par la respiration (l'augmentation du retour veineux par l'inspiration est distribué dans les 2 oreillettes du fait de la communication large) Electrocardiogramme L'hypertrophie ventriculaire droite (rSR' ou rsR' dans les précordiales droites) traduit la surcharge de volume ventriculaire droite. Radiologiquement Sont dilatées les cavités par où chemine le shunt (oreillette droite, ventricule droit, artère pulmonaire) et on retrouve une hypervascularisation pulmonaire Échographie La visualisation directe de la communication inter-auriculaire par voie sous costale est possible (septum inter-auriculaire perpendiculaire aux ultrasons). On recherche une anomalie associée, et étudie l'importance du shunt des cavités gauches vers les cavités droites par l'étude du rapport des débits pulmonaire et aortique. Cathétérisme La sonde passe par la communication inter-auriculaire et permet de réaliser un cathétérisme gauche sans ponction artérielle. On étudie le contenu en oxygéne veineux, artériel pulmonaire et artériel systémique pour calculer le rapport du débit pulmonaire sur débit systémique (Qp/Qs). On recherche des anomalies associées (notamment RVPA) traitement Correction chirurgicale entre 2 et 4 ans si Qp/Qs>1,5 suture simple ou patch de correction. La pose des ombrelles est en cours d'étude. Le traitement médical comprend La prévention Osler Les antiarythmiques si apparaissent des tachycardies supra-ventriculaires qui peuvent compliquer la chirurgie comme l'évolution spontanée. Communications inter-ventriculaires (CIV) (G Jondeau) Anatomopathologie (figure) On distingue suivant la localisation de la communication inter-ventriculaire: 1) les CIV d'admission (par où le sang arrive, qui s'intègrent souvent dans un canal atrio-ventriculaire), 2) les CIV musculaires qui sont souvent multiples, 3) les CIV d'éjection ou infandibulaire, et 4) CIV peri-menbraneuses les + fréquentes Les CIV selon leur localisastion AP Ao 1 CIV d'amission 2 CIV musculaire 3 CIV infandibulaire 4 CIV perimenbraneuse 3 4 OD 1 2 Hémodynamique L'importance de la fuite dépend de la taille de la communication: si elle est large, tout se passe comme si existait une seule cavité ventriculaire, et la pression dans les 2 ventricules est identique: le souffle est faible, mais le sang est éjecté vers le vaisseaux qui offre le moins de résistance à l'éjection (en pratique l'artère pulmonaire, et le shunt est initialement des cavités gauches vers les Chapitre X, page 2 cavités droites en l'absence de sténose pulmonaire). Par ailleurs, la pression pulmonaire est identique à la pression aortique, et les artères pulmonaires vont se dilater et comprimer les bronches (infections pulmonaires, troubles de la ventilation). Si la communication inter-ventriculaire est petite, les pressions ventriculaires droites systoliques restent plus basses que les pressions ventriculaires gauches, et du sang va passer à grande vitesse (d'où souffle) du ventricule gauche au ventricule droit. Évolution Les infections pulmonaires avec troubles de la ventilation sont fréquentes dans les communications inter-ventriculaires larges, qui peuvent également se compliquer d'Eisenmenger, c'est à dire d'une hypertension artérielle pulmonaire, conséquence de l'augmentation des résistances vasculaires pulmonaires (altération des artérioles par le haut débit et l'hyperpression) avec inversion du shunt. Ceci est un phénomène irréversible, qui contre indique donc la fermeture de la communication interventriculaire. Parfois, se développe une hypertrophie du ventricule droit produisant une obstruction. Un tableau clinique proche de la tétralogie de Fallot apparaît ainsi dans 5 à 10% des cas. Enfin, en cas de communication inter-ventriculaire située au contact des valves aortiques, peut se développer une insuffisance aortique (5% des CIV). Clinique Petites CIV maladie de Roger: gros souffle petit shunt (40%) Le souffle réalise classiquement "beaucoup de bruit pour rien". Il est systolique (quand la différence de pression entre ventricule gauche et ventricule droit est importante), mediothoracique, irradie en rayon de roue sur tout le thorax, intense avec souvent un frémissement. Aucune autre anomalie n'est présente (notamment pas de retard de croissance). L' évolution se fait spontanément vers la fermeture dans 50 à 75% des cas, parfois avec constitution transitoire d'un petit anévrisme qui va couvrir la communication. Les risques sont surtout 1) l'endocardite d'Osler, surtout après 18 mois, ce qui impose une prophylaxie antibiotique en cas d'infection, et 2) la constitution d'une insuffisance aortique si la CIV est sous aortique. Traitement: prévention Osler, surveillance bisannuelle entre 3 et 6 ans, on évalue la pression artérielle pulmonaire et le rapport des shunts (Qp/Qs). Si la pression artérielle pulmonaire est normale et le Qp/Qs inférieur à 1,5 on préfère suivre médicalement l'enfant du fait du risque opératoire (notamment bloc auriculo-ventriculaire) Grosses CIV ventricule fonctionnellement unique, le shunt est fonction des résistances pulmonaire et systémique A la naissance, la média des artères pulmonaires est épaisse, si bien que la résistance à l'éjection du ventricule droit est élevée. Lors de la maturation des artères pulmonaires (premières semaines), le shunt va s'installer et entraîner 1) des troubles de la croissance, 2) des effets cardiaques (souffle systolique si les pressions ventriculaires droite et gauche ne sont pas parfaitement identiques, surcharge de débit de l'oreillette gauche, du ventricule gauche (avec roulement mitral de débit), surcharge ventriculaire droite entraînant une hypertrophie qui peut conduire à une sténose pulmonaire infundibulaire, insuffisance cardiaque, 3) des effets pulmonaires, témoins de la compression des bronches par les artères pulmonaires distendues par la pression. Ces artères peuvent s'altérer et se fibroser pour aboutir à la constitution d'une hypertension artérielle pulmonaire irréversible du fait de l'augmentation des résistances pulmonaires, inversant le shunt (Eisenmenger) Traitement insuffisance cardiaque grave malgré traitement médical: la chirurgie s'impose La fermeture de la CIV corrige complètement et définitivement la cardiopathie. Elle est donc préférée si le geste est simple (communication inter-ventriculaire unique…). Sinon on réalise un cerclage de l'artère pulmonaire pour diminuer l'hyperdébit et l'hyperpression pulmonaires puis on ferme la ou les CIV 1 an plus tard. Si l'enfant est bien sous traitement médical On attend 2 ans pour réaliser une cure complète si la CIV ne s'est pas spontanément fermée. Cette attitude est à pondérer en fonction des données de chaque cas Si existe une insuffisance aortique (CIV sous aortique), l'attitude est plus chirurgicale du fait du risque d'aggravation de la fuite aortique. Si les CIV sont multiples, le geste chirurgical est plus complexe et souvent incomplet, et on tente de le retarder autant que possible dans l'espoir qu'une partie des CIV se ferment et que le coeur soit plus grand (croissance). La CIV peut s'associer à d'autres anomalies, qui vont modifier l'attitude. Enfin en cas de syndrome d'Eisenmenger, il ne faut pas opérer et la seule alternative au traitement médical est la transplantation coeur-poumons. Chapitre X, page 3 Tétralogie de Fallot (T4) (G Jondeau) anatomie pathologique 10% des cardiopathies congénitales Elle s'appelle tétralogie car elle réunit 4 éléments: 1) une communication inter-ventriculaire large réalisant l'égalité de pression entre ventricule droit et ventricule gauche, qui résulte du malalignement du septum, 2) Le chevauchement de l'aorte qui résulte également du malalignement du SIV, 3) une obstruction de la voie pulmonaire, qui est l'élément fondamental du pronostic et comprend souvent a) une sténose infundibulaire, musculaire, donc susceptible de varier dans le temps. b) une sténose valvulaire avec au maximum occlusion complète; l'arbre pulmonaire est alors vascularisé par le canal artériel. c) une sténose des branches des artères pulmonaires, et 4) une hypertrophie ventriculaire droite du fait de la pression élevée qui règne dans cette cavité. Peuvent s'y associer une anomalies des artères coronaires (important pour le chirurgien), et d'autres anomalies cardiaques. Hémodynamique Comme la communication inter-ventriculaire est large, l'importance relative des débits est liée au rapport des résistances à l'éjection des ventricules: plus la sténose pulmonaire est serrée, moins le débit pulmonaire sera élevé, et donc plus le shunt des cavités droites vers les cavités gauches sera important et la cyanose sévère. A l'inverse, si l'on augmente les résistances systémiques, la part qui va vers les poumons va augmenter. Chez les enfants qui ont une sténose pulmonaire importante, surviennent des malaises, avec accès de cyanose et désaturation très sévère, parfois avec acidose, surtout après les efforts, c'est à dire lorsque les vaisseaux périphériques sont dilatés (diminution de la résistance à l'éjection du ventricule gauche). L'hypoxie et l'acidose peuvent aggraver la sténose pulmonaire en entraînant une contraction de la sténose musculaire pulmonaire. Ces malaises peuvent être mortels, et les enfants les limitent en augmentant les résistances systémiques par une position accroupie, avec les bras également pliés, ce qui tend à équilibrer la résistance à l'éjection des 2 ventricules. L'hypoxie entraîne la sécrétion d'érythropoiétine qui produit une polyglobulie, jusqu'à un niveau permettant une oxygénation tissulaire suffisante. Si la polyglobulie est insuffisante pour corriger l'hypoxie chronique, la concentration de l'hémoglobine continue d'augmenter jusqu'à entraîner hyperviscosité, avec ses risques de thrombose et de saignement… Parallèlement à la polyglobulie, se développe un hippocratisme digital (déformation des doigts en baguette de tambour). Enfin, la polyglobulie résulte du passage du sang veineux systèmique dans l'aorte, et l'on imagine aisément qu'un embol septique peut suivre le même chemin et entrainer un abcès cérébral du fait de l'absence de "filtre" pulmonaire. clinique Ces enfants sont très "miséreux", du fait de l'hypotrophie et de la cyanose. Existe à l'auscultation un souffle systolique de sténose pulmonaire, d'autant plus intense que la sténose pulmonaire est moins serrée (c'est à dire d'autant plus intense que plus de sang passe à travers la sténose pulmonaire). Lors des accès d'hypoxie, liés à la diminution du débit pulmonaire, le souffle diminue ou peut même disparaître. Le B2 est unique car seule la composante aortique est audible. l'ECG retrouve une hypertrophie ventriculaire droite et auriculaire droite. L'aspect radiographique est typique et réalise le coeur en sabot: l'arc pulmonaire manque et le ventricule droit saille particulièrement. La vascularisation pulmonaire est pauvre. L'echocardiographie permet le diagnostic de certitude. Le cathétérisme permet de faire le bilan exact des lésions, et l'angiographie apprécié la voie pulmonaire. Le traitement idéal est la correction complète de l'anomalie On la réalise de plus en plus tôt, même si l'âge idéal est de 2 ans, elle est actuellement possible à partir de 6 mois. Si l'enfant ne peut attendre cet âge ou présente une forme peu favorable à la chirurgie (essentiellement atrophie de la voie pulmonaire), on peut réaliser une anastomose de Blalock, entre la sous clavière gauche et l'artère pulmonaire éventuellement avec un patch de Goretex. Chapitre X, page 4 Persistance du canal artériel (G Jondeau) Anatomie pathologique 10-15% des cardiopathies congénitales, plus fréquente chez les filles (2-3 filles / garçon). Le canal artériel réalise une communication entre l'aorte après le départ de la sous clavière gauche et le tronc de l'artère pulmonaire (Permet, pendant la vie foetale, le passage du sang de l'artère pulmonaire vers l'aorte descendante, c'est à dire diminue la vascularisation du poumon non encore fonctionnel). Il réalise un shunt dont le sens et l'intensité dépendent de 1) la différence de pression entre l'aorte et l'artère pulmonaire, 2) la taille du canal, et 3) la longueur du canal. Sa structure est musculaire et le canal est maintenu ouvert par la sécrétion de prostaglandines en réponse à la faible PO2 pendant la vie foetale (risque Aspirine pendant grossesse). Lors de la naissance: l'oxygénation des poumons entraîne une augmentation de la PO2 et ainsi une diminution de la synthèse de prostaglandines, si bien que le canal artériel se vasoconstricte intensément (en altitude le canal se ferme plus lentement). Dans un 2° temps, il se fibrose et s'oblitère complètement (quelques semaines). Ceci ne peut survenir que si le poumon est assez mature (le canal persiste chez les prématurés, et peut avoir un rôle dans les insuffisances cardiaques et respiratoires du prématuré). Sa persistance peut être bénéfique lors de certaines cardiopathies congénitales, car il peut permettre une vascularisation pulmonaire (atrésie pulmonaire), ou une vascularisation de l'aorte ascendante (coarctation très serrée) ou de toute l'aorte (hypoplasie du VG): on le maintient ouvert alors après la naissance par perfusion de prostaglandine E1. Hémodynamique Le flux sanguin à travers le canal dépend de la différence de pression entre l'aorte et l'artère pulmonaire. Au début de la vie les résistances pulmonaires baissent, (+ lentement chez le prématuré), et le shunt s'installe progressivement après la naissance. Lorsque le débit à travers le canal est élevé, il entraîne une augmentation du débit à travers oreillette et ventricule gauches (surcharge volumétrique) et une diminution de la pression artérielle diastolique du fait du reflux de sang de l'aorte dans l'artère pulmonaire. Clinique Chez le prématuré Les signes périphériques sont proches de ceux observés dans l'insuffisance aortique, avec élargissement de la différentielle aux membres inférieurs. A l'auscultation on entend un souffle systolique ou systolo-diastolique sous claviculaire gauche. Enfin on peut observer des signes de décompensation cardiaque ou/et pulmonaire. Le traitement repose en règle sur l'indometacine (inhibiteur des prostaglandines), et en cas d'échec (10%) sur la ligature chirurgicale du canal. Chez les nouveau-nés à terme et les enfants Les signes pulmonaires à type de pneumopathies à répétition ou de dyspnée d'effort sont parfois la circonstance de découverte. A l'auscultation on retrouve un souffle continu à renforcement systolique sous claviculaire gauche, mimant "une locomotive dans un tunnel", frémissant. Peuvent s'y associer des souffles de débit mitral et aortique. En périphérie, on retrouve un élargissement de la différentielle (reflux de l'aorte dans l'AP). A l'ECG: hypertrophie ventriculaire gauche diastolique puis systolique Radiologiquement, on retrouve la dilatation de l'oreillette gauche et du ventricule gauche, ainsi que de l'aorte ascendante et du tronc de l'artère pulmonaire, avec une hypervascularisation pulmonaire L'echocardiographie permet le diagnostic et de quantifier le shunt. Le traitement est chirurgical et simple (pas de circulation extra-corporelle). La pose d'ombrelles, endocavitaire, est en cours d'étude. Le risque de l'évolution spontanée est l'endocardite et le développement d'une hypertension artérielle pulmonaire (avec au maximum Eisenmenger) qui ne devraient plus se voir. Rétrécissement pulmonaire (RP) (G Jondeau) Anatomopathologie 7% des cardiopathies congénitales La sténose pulmonaire peut être très modérée, intermédiaire ou très sévère avec subostruction pulmonaire. La simplicité du traitement correcteur dépend du type de sténose. Les sténoses valvulaires se corrigent simplement, mais les anomalies de l'infandibulum pulmonaire sont plus difficile à corriger (chirurgie). RP très serré révélé en période néo natale La sténose pulmonaire gène l'éjection du ventricule droit, dont le développement peut également être anormal. L'oreillette droite ne peut donc se vider dans le ventricule droit et "force" le foramen ovale qui ne va pas se fermer. Il s'agit alors d'une cardiopathie cyanogène. Si le canal artériel reste perméable, il va permettre une amélioration du flux pulmonaire. Cliniquement Il existe une cyanose dès la naissance, avec radiologiquement cardiomégalie (à la différence de la tétralogie de Fallot) et hypoperfusion pulmonaire. A l'ECG, on observe une hypertrophie ventriculaire gauche et non une hypertrophie ventriculaire droite (à la différence de la tétralogie de Fallot). traitement dilatation par voie endocavitaire, si le ventricule droit est assez développé Chez l'enfant Le plus souvent aucun signe fonctionnel, mais parfois une dyspnée d'effort modérée, une cyanose modérée, des syncopes d'effort (le débit cardiaque ne peut augmenter au cours de l'effort). A l'auscultation, on retrouve un souffle systolique de sténose pulmonaire (foyer pulmonaire), le plus souvent frémissant, avec claquement lors de l'ouverture de la valve pulmonaire (click d'éjection). Chapitre X, page 5 A l'ECG, on retrouve une hypertrophie ventriculaire droite Radiologiquement le signe le plus constant est la saillie du tronc de l'artère pulmonaire. L'échographie fait le diagnostic et quantifie le degré de sténose Le traitement est en règle la dilatation percutanée, mais on peut être amené à intervenir chirurgicalement, si la valve est trop élastique et ne se laisse pas dilater de façon durable. En cas de sténose infundibulaire, le traitement est chirurgical. Chapitre X, page 6 Figure 1: hémodynamique des cardiopathies congénitales Coeur normal CIA: le retour veineux VP va vers le ventricule le plus compliant VCS OD OG VD VG AP Ao OD OG VD VG VCI AP CIV large: le débit ventriculaire va dans le vaisseau qui offre le moins de résistance à l'éjection OD VD AP Ao T4 de Fallot: la sténose pulmonaire détermine le flux pulmonaire et l'importance de la cyanose. OG OD OG VD VG VG Ao AP Ao Sténose pulmonaire sévère: l'éjection du VD est limitée, la pression dans l'OD devient supérieure à la pression dans l'OG et le foramen ovale reste ouvert Canal artériel: le sang va de l'aorte vers l'AP où la pression est + basse OD OG OD OG VD VG VD VG AP Ao AP Ao Chapitre X, page 7 Cardiopathies congénitales traitements (G Dreyfus) Généralité: Elles sont multiples et ont pour origine les diverses anomalies de l'organogenèse cardiaque. Certaines sont simples et fréquentes (CIV: ou communication interventriculaires), d'autres sont rares et complexes (Truncus arteriosus). Les symptômes sont variables suivant le type d'anomalie observée ; les symptômes majeurs sont l'insuffisance cardiaque et la cyanose. Ce qu'il faut comprendre à propos de la cyanose c'est qu'elle survient lorsqu'existe un shunt intracardiaque droit→gauche avec défaut de perfusion du lit pulmonaire. Leur diagnostic repose sur l'examen clinique et surtout l'échocardiographie éventuellement prénatale et le cathétérisme cardiaque. Principes des traitements: Réparation anatomique ou cure complète: chaque fois que c'est possible la correction chirurgicale d'une cardiopathie congénitale sera anatomique c'est à dire qu'elle restituera une anatomie et donc un physiologie cardiaque normale. Cette anatomie comporte deux ventricules [droit et gauche] qui assurent deux circulations [pulmonaire et systémique] en série dont les débits sont presque identiques et dont les régimes de pression sont respectivement bas et élevé. Ex1: fermeture d'une communication inter-auriculaire (CIA) par mise en place d'un patch. Ex2: cure d'une coarctation aortique par résection anastomose Ex3: section-suture d'un canal artériel Chirurgie palliative: parfois la cure complète de la cardiopathie n'est pas possible et on se contente d'un traitement palliatif dont le but est d'assurer la vie du patient par la perfusion "équilibrée" du lit pulmonaire et du réseau systémique. Il faut comprendre que la vie est possible avec un seul ventricule qui assure soit deux circulations en série (réparation univentriculaire de type "Fontan"), ou avec un ou deux ventricules qui assure(nt) deux circulations en parallèle comme chez le fœtus grâce à des shunts intracardiaques (CIA, CIV) ou extracardiaques (Canal artériel ou son équivalent artificiel: anastomose de Blalock). Ex1: Transposition des gros vaisseaux et Rashkind. Dans cette anomalie l'aorte naît du ventricule droit et l'artère pulmonaire naît du ventricule gauche. Pendant la vie intrautérine le fœtus se porte bien grâce aux shunts de la vascularisation fœtale (canal artériel et trou de Botal). A la naissance ces shunts se ferment et deux circulations séparées apparaissent, la détresse vitale est rapide. Afin d'assurer la survie du nouveau-né il faut mélanger les deux circulations grâce à la prostacycline qui maintient le canal artériel ouvert et à la manœuvre de Rashkind qui recrée une CIA. Ces techniques palliatives seront ensuite suivie d'une cure complète selon la technique du switch. Ex2: Tétralogie de Fallot et Blalock. Dans la tétralogie de Fallot qui associe [CIV, Sténose pulmonaire, Dextroposition aortique et Hypertrophie ventriculaire droite] le nouveau-né est cyanosé car il existe un shunt intracardiaque droit→gauche avec défaut de perfusion du lit pulmonaire du fait de la CIV et de la sténose pulmonaire. Lorsqu'un cure complète n'est pas possible ou en attendant la croissance de l'enfant on peut améliorer le patient en pratiquant une anastomose de Blalock qui consiste à anastomoser l'aorte ou une de ses branches avec l'artère pulmonaire et donc à apporter du sang au poumons équilibrant mieux les débits pulmonaires et systémiques. Ex3: CIV multiples et Cerclage de l'artère pulmonaire. Dans cette anomalie le patient souffre d'insuffisance cardiaque à haut débit avec hypervascularisation pulmonaire par shunt intracardiaque gauche→droit massif et risque à moyen terme de développement d'une hypertension artériel pulmonaire irréversible et mortelle. Le cerclage de l'artère pulmonaire qui cré un obstacle pulmmonaire permet de diminuer le shunt gauche→droit et de protéger le lit vasculaire pulmonaire. Ex4: Atrésie tricuspide et Fontan. Dans cette anomalie il n'y a pas de valve tricuspide et aux maximum pas de ventricule droit. Le nouveau-né ne peut vivre qu'en maintenant les shunts fœtaux ouverts: trou de Botal (éventuel Rashkind) et canal artériel (prostacycline puis anastomose de Blalock). Dans cette situation le ventricule gauche assure en parallèle les circulations systémiques et pulmonaires qui se mélangent dans l'oreillette gauche grâce à la CIA persistante. Dans un second temps on peut chercher à transformer cette circulation en parallèle par une circulation en série en anastomosant les veines caves à l'artère pulmonaire, e, supprimant les shunts (CIA et Blalock): c'est la réparation univentriculaire de type Fontan. Stratégie thérapeutique Suivant la cardiopathie les stratégies thérapeutiques sont multiples et il faut toujours avoir à l'esprit le problème de la croissance de l'enfant qui incite à éviter au maximum les prothèses surtout les prothèses tubulaires ou valvulaires. Certaines cardiopathies complexes imposent un traitement par plusieurs étapes chirurgicales. Les progrès actuels permettent de prendre en charge très précocément (nouveau-né et même prématurés) des cardiopathies très complexes. Avec le développement du diagnostic anténatal se pose le problème de l'interruption thérapeutique de grossesse. Chapitre X, page 8