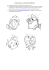Sciaenops ocellatus (Linnaeus, 1766)
Transcription
Sciaenops ocellatus (Linnaeus, 1766)
Organisation des Nations Unies pour l'alimentation et l'agriculture pour un monde libéré de la faim Département des pêches et de l'aquaculture Cultured aquatic species fact sheets Sciaenops ocellatus (Linnaeus, 1766) I. Identification a. Caractéristiques Biologiques b. Galerie D'images II. Profil a. Contexte Historique b. Principaux Pays Producteurs c. Habitat Et Biologie V. Situation Et Tendances VI. Problèmes Et Contraintes Majeurs a. Pratiques Pour Une Aquaculture Responsable VII. Références a. Liens Utiles III. Production a. Cycle De Production b. Systèmes De Production c. Maladies Et Mesures De Contrôle IV. Statistiques a. Statistiques De Production b. Marché Et Commercialisation Identification Sciaenops ocellatus Linnaeus, 1766 [Sciaenidae] FAO Names: En - Red drum, Fr - Tambour rouge, Es - Corvinón ocelado Caractéristiques biologiques Le corps est allongé et légèrement arqué en arrière et la tête est inclinée. Il est essentiellement de couleur marron cuivreux ou rougeâtre, alors que le ventre est blanchâtre. Le museau est émoussé avec une bouche plutôt grande et inférieure contenant des bandes des dents villiformes. Absence de barbillons, c’est ce qui différencie cette espèce de celle qui lui est étroitement liée: le tambour noir (Pogonias cromis). Il a deux ailerons dorsaux, le premier avec dix épines dures et le second avec une épine dure et plusieurs rayons mous (24). L’aileron caudal est légèrement concave avec un ou plusieurs grands chromatophores noirs au-dessus de la ligne latérale. Pendant la ponte, les mâles produisent un son de tambour caractéristique en frottant des muscles spécialisés contre la vessie. Galerie d'images FAO Fisheries and Aquaculture Department Sciaenops ocellatus – géniteurs Sciaenops ocellatus -juvénile Profil Contexte historique L'intérêt pour l’élevage du tambour rouge en captivité a commencé vers la fin des années 70 avec le déclin des populations naturelles dû aux activités de pêche commerciale et récréative. Depuis lors, plusieurs mesures règulatoires ont été mises en application (par exemple des limites de taille et de sac) et on a entièrement arrêté la pêche professionnelle dans plusieurs zones. Les premières méthodes d'aquaculture ont été développées aux Etats-Unis d'Amérique, en particulier au Texas et en Floride, afin de fournir des alternatives à la pêche des poissons sauvages et pour le repeuplement des stocks. Avec le développement des techniques de culture fiables, la production commerciale de cette espèce s’est répandue dans d'autres pays parce que le tambour rouge est un poisson de consommation populaire qui est relativement robuste et s'adapte bien aux conditions d'aquaculture. Principaux pays producteurs Principaux pays producteurs de Sciaenops ocellatus (Statistiques des Pêches, 2006) Habitat et biologie Le tambour rouge est un poisson euryhalin qui se trouve le long de l'Océan atlantique et des côtes du Golfe de Mexique à partir du cap Cod au Massachusetts jusqu’à Tuxpan, au Mexique. Les adultes pondent entre août et octobre dans les eaux côtières près des passes régies par les marées. Le tambour rouge pond des oeufs pélagiques (d’un diamètre approximatif de 1,0 mm), les grandes femelles produisent 1 million d'oeufs. Les larves (approximativement de 6-8 mm LS) sont transportées aux estuaires par les courants vers les champs d’algues où elles s’installent. Les juvéniles et les sub-adultes restent dans les baies et les estuaires et ne se FAO Fisheries and Aquaculture Department déplacent vers le large qu’une fois âgés de 3,5-5 ans, et ce pour rejoindre les géniteurs. Production Cycle de production Cycle de production de Sciaenops ocellatus Systèmes de production Approvisionnement en juvéniles Géniteur Dans certains cas, les oeufs et/ou les alevins sont achetés aux écloseries qui représentent une alternative pour maintenir et faire reproduire les géniteurs. Le tambour rouge s'adapte bien à la captivité et beaucoup de producteurs maintiennent les géniteurs pour assurer un approvisionnement constant en larves pour le grossissement. Des adultes peuvent être maintenus dans des bassins de fibre de verre circulaires (10 à 17 m3 , 1,5 m de haut) reliés dans une boîte externe de filtre. Quatre à six poissons peuvent pondre avec succès dans de tels systèmes en utilisant un sex ratio égal. Les géniteurs sont alimentés 3-5 fois par semaine suivant un régime à base de poissons, de calmar, de crevette et/ou de granulé. Dans la majorité des pays produisant le tambour rouge, les géniteurs doivent être importés du fait qu’ils ne sont pas des espèces endémiques. La dérive génétique est, en conséquence, susceptible de se produire sur plusieurs années d’élevage avec un nombre limité de géniteurs, qui peut affecter la production de manière négative. Afin de préserver la diversité génétique des individus et des familles du tambour rouge en élevage, un nombre adéquat d'individus et de familles devrait être maintenu afin de réduire au minimum la consanguinité. Ponte FAO Fisheries and Aquaculture Department Les techniques pour faire pondre cette espèce durant toute l'année sont bien mises au point. Un régime de 120 jours de photopériode et de température peut être employé pour induire la ponte du tambour rouge en captivité. Les géniteurs sont au début acclimatés à une température de 17 °C et à une photopériode de 9 heures de lumière (HL) qui simule les conditions de l'hiver pour les adultes obtenus naturellement. Après l'acclimatation des adultes, la température et la photopériode sont graduellement augmentées et plus tard diminuées pendant 120 jours. Après le traitement initial des géniteurs, la ponte contrôlée peut être réalisée tout au long de l'année par des manipulations de la température. Par exemple, la ponte peut être temporairement suspendue quand la température de l'eau descend en dessous du 23 °C et peut reprendre une fois la température est augmentée au delà de 23 °C. Le tambour rouge pond habituellement le soir, juste après que les lumières soient éteintes. Les oeufs flottent dans des salinités supérieures à 25 pour mille. Durant la nuit, les oeufs sont transportés vers un filtre externe où ils sont rassemblés dans un sac de nitex de 500 microns. Après le déplacement du collecteur d'oeufs, les oeufs sont placés directement dans les bassins d’élevage ou d’abord dans des incubateurs (500-2 000 litres; 200-500 oeufs/l) pour les faire éclore et plus tard ils sont transférés dans des bassins d'élevage. La désinfection des oeufs avec du formol à 50-100 ppm pendant ~1 heure permet la diminution de la charge bactérienne et de la croissance fongique. Les oeufs sont approximativement de 1 mm de diamètre et éclosent dans un délai de 18-25 heures dans des températures de 24-28 °C. Production d'écloserie Les systèmes d’élevage sont en général des bassins circulaires en fibre de verre installés dans des salles avec des conditions contrôlées de volumes moyens de 5 000-15 000 litres, bien que les premières larves qui peuvent s’alimenter puissent être également transférées aux étangs d’élevage. La densité de l'élevage va de 10 à 30 larve/l et le taux de survie larvaire peut être de 50 pour cent. Au début, la température et la salinité optimales pour l’éclosion et l’élevage larvaire sont de 25-30 °C et 25-30 pour mille, bien que des intervalles plus large peuvent être employés pour des larves plus grandes. Des taux de survie élevés de 10 pour cent, 5 pour cent et 1 pour cent ont été rapportés pour les larves respectivement de 3 mm, de 6 mm et de 15 mm. Des larves peuvent être élevées jusqu’à la taille de grossissement en écloserie ou en étang. Elevage larvaire intensif Les larves du tambour rouge sont approximativement de 2,2 mm LS à l’éclosion et sont généralement prêtes à s’alimenter après 3 jours après la ponte (jap). Les larves sont au début nourries avec des rotifères à des concentrations de 5-10/ml 3-10 jap et sont nourries plus tard de nauplii d'artémia à 11-15 jap. À partir de ce moment là, les larves acceptent facilement un régime de microparticule, bien que le meilleur régime est à la fois à base de proies vivantes et de proies inertes pendant la période de sevrage. Le tambour rouge peut être alternativement, alimenté par une combinaison de rotifères et d’aliments inertes (~0,25 millimètre) 3-7 jap, suivie d’une alimentation à base d‘inerte seulement (la dimension des particules est graduellement augmentée) sans pour autant sacrifier la croissance et la survie. La proie vivante est fréquemment enrichie avec des acides gras hautement insaturés tels que l'acide arachidonique (ARA), l'acide eicosapentanoique (EPA) et l'acide docosahexaenoïque (DHA), qui améliore la croissance et la survie. Des enrichissements tels que les microalgues vivantes, la pâte de micro-algues, les préparations commerciales et les huiles de poissons de mer, sont fréquemment utilisés pour améliorer la composition en acides gras des proies. L'addition des micro-algues dans les bassins d'élevage (Nannochloris occulata, Isochrysis galbana) à des concentrations de 40 000 – 100 000 cellules/ml augmentent également la croissance et la survie larvaires. Une fois que les poissons atteignent l'étape juvénile (moins de 1 mois), ils peuvent être replacés dans des étangs ou des cages en filet pour leur grossissement. Nurserie Des étangs de 0,2-1,0 ha sont généralement remplis pendant 5-10 jours avant le stockage. Des engrais inorganiques et organiques sont ajoutés aux étangs afin de démarrer un bloom phytoplanctonique qui, à son FAO Fisheries and Aquaculture Department tour, fait stimuler la production de la communauté zooplanctonique, se composant principalement de copépodes. Les larves (2 jap ; 740 000/ha) sont déplacées de l'écloserie vers les étangs une fois que les niveaux de zooplancton aient atteint une densité d'approximativement 250 organismes/l. Les poissons sont maintenus dans ces systèmes à 30 jap (~30 mm LS) et plus tard ils sont déplacés dans de plus grands étangs ou des cages en filet. Techniques de grossissement Les tambours rouges sont élevés en cages ou en étangs. Elevage en étang Versla fin des années 80 et le début des années 90, l’élevage en étang du tambour rouge aux Etats-Unis d'Amérique a été sévèrement affecté par les basses températures qui ont eu lieu pendant les mois d'hiver et qui ont eu comme conséquence des mortalités importantes. On croit que la température létale la plus faible pour les juvéniles du tambour rouge est 8-10 °C. Cette valeur dépend de la salinité et du taux de diminution de la température. Afin de palier aux pertes dues aux faibles températures, les éleveurs ont modifié les pratiques en matière de production. Par exemple, les poissons sont transportés dans les bassins situés à l'intérieur à un poids d'approximativement 1 g, et ils sont tenus dans des systèmes semi fermés, et ne retournent aux étangs en plein air (150-225 g) qu’une fois les températures de l'eau sont plus hautes. Les jeunes poissons sont assez cannibalistes et le triage des poissons est assez fréquent du fait que le séjour dans les bassins intérieurs diminue les taux de mortalité, augmentant de ce fait la production globale. Les poissons issus de tels systèmes (~1 kg) peuvent atteindre la taille commerciale en 11 mois. Elevage en cage Des cages de dimension et de types variables sont utilisées dans l’élevage des poissons marins. En Chine, les cages sont construites avec des sacs de maille flexible attachés à des armatures solides et sont d’une taille de 1,5-2,5 m3 . Les juvéniles du tambour rouge (0,2 g) sont stockés à 1 000 alevins/m3 . Durant leur croissance, les poissons peuvent être mis dans de plus grandes cages et la densité diminue de ~400 alevin/m3 . Le cannibalisme est un problème fréquent et les poissons sont donc régulièrement triés pour diminuer la mortalité. La taille commerciale (~1 kg) est normalement atteinte après un an. Apport de nourriture Les jeunes poissons se développent très bien avec une variété d'aliments disponibles dans le commerce et préparés spécialement pour le tambour rouge ou pour d'autres espèces marines d’eau chaude. Les exigences alimentaires sont assez bien maîtrisées. Les juvéniles du tambour rouge ont besoin d'un régime contenant 35-45 pour cent de protéine pour une croissance optimale. La protéine diététique est principalement fournie par la farine de poisson, bien que de la farine de soja puisse être utilisée en s’assurant qu’au moins 10 pour cent de la protéine brute est fourni par la farine de poisson. Comme il a été remarqué plus haut chez les larves, les juvéniles ont besoin d’acides gras hautement insaturés les HUFAs et une introduction de n-3 HUFAs à un pourcentage de10 pour cent des apports en lipide est recommandée. Il y a peu d'information disponible concernant les exigences de cette espèce en vitamines et en minéraux; ces composantes sont généralement ajoutées au régime sous forme de pré-mélanges disponibles dans le commerce qui ont été développés pour la culture d'autres espèces de poissons. Les aliments pour le tambour rouge contiennent habituellement 40 pour cent de protéine brute, de 5-7 pourcent d’huile de poissons, moins de 7 pourcent de fibre brute, avec des prémélanges vitaminiques et minéraux. Techniques de récolte Le tambour rouge peut être récolté des étangs avec une seine. Les multiples récoltes d’un étang à l'aide d'une seine de triage qui capture les poissons de certaines tailles ont comme conséquence une production globale plus élevée. Alternativement, les étangs peuvent être vidangés et les poissons rassemblés dans un bassin dans lequel ils seront plus facilement capturés. Le tambour rouge peut être récolté des cages avec des filets immergés, selon le nombre de poissons, en soulevant légèrement un côté du filet ou autrement en soulevant le filet hors de l'eau. FAO Fisheries and Aquaculture Department Manipulation et traitement Le tambour rouge doit être manipulé soigneusement pendant toutes les étapes d’élevage ainsi que pendant la récolte et le traitement afin de maintenir la valeur alimentaire et esthétique du poisson, et pour éviter la contamination. Tout l'équipement utilisé pour manipuler ou traiter les poissons doit être bien maintenu et complètement nettoyé avant, pendant et après le traitement. Des autorités locales responsables de la surveillance de la manipulation et du traitement des fruits de mer devraient être contactées pour des informations détaillées concernant le traitement sanitaire des poissons. Coûts de production L'analyse suivante des coûts de production des exploitations d’élevage du tambour rouge aux Etats-Unis d'Amérique, utilisant les étangs pour le grossissement des jeunes poissons de 0,4 g à 1 kg durant approximativement un an, ont été rapportées en 1994. Bien que les évaluations des coûts rapportées ne soient plus valides à cause de l'inflation, etc., les facteurs employés pour déterminer les évaluations et leur importance relative sont toujours valables. Frais d’exploitation Alimentation Coût des fingerlings pour grossissement Main d’oeuvre Les produits chimiques (par exemple les fertilisants, traitement de maladie) Stockage et commercialisation Entretien et réparation des équipements Part du coût annuel (%) 55,5 19,3 14,3 4,8 3,4 2,7 Maladies et mesures de contrôle Le tableau suivant contient l'information concernant les maladies affectant le tambour rouge en élevage. L’éleveur devrait se familiariser avec les réglementations locales concernant l'utilisation des produits chimiques/médicaments spéciaux approuvés dans l’alimentation des poissons ainsi que les réglementations en place pour les pays d’importation du produit. Dans certains cas, des antibiotiques et d'autres produits pharmaceutiques ont été utilisés pour les traitements mais leur inclusion dans ce tableau n'implique pas une recommandation de la FAO. MALADIE AGENT TYPE SYNDROME Nage erratique (en spirales, tourbillons); nécrose neuronale; Nécrose nerveuse Nodavirus Virus hyper-inflation de virale la vessie; couleur obscurcie; alimentation réduite. Spores dans la muqueuse du tractus digestif; inflammation du Enteromyxose Endoparasite Myxidium leei tractus digestif; (myxidiose) myxosporidien décoloration; perte des écailles; ulcération de la peau. La peau, les FAO Fisheries and Aquaculture Department MESURES Aucun traitement connu; désinfection des systèmes d’élevage entre les lots de poissons (l'eau de culture - UV, ozone ; matériaux - chlore); isolement des poissons malades aucun traitement connu; désinfection des systèmes d’élevage; retrait des poissons malades ailerons et occasionnellement les branchies ont de grands Lymphocyste Iridovirus Virus fibroblastes blanchâtres ou de couleur rouge pale (des croissances sous forme de choux) De petits crustacés attachés aux Crustacés Copépodes, Parasites branchies,à la ectoparasites (pou isopodes, externes bouche, la peau; marin) branchyurans des ulcérations de peau Abdomen gonflé, peau ulcérée; hémorragies sur le Vibriose(infection corps; globe bactérienne Vibrio sp. Bactérie oculaire systémique) proéminent; léthargie; ulcères internes Ulcération de la peau; septicémie; infection globe oculaire Streptococcus bactérienne Bactérie proéminent; iniaei systémique hémorragies sur le corps; coloration obscurcie Le trophont (apparaît comme de petites taches Amyloodiniose blanchâtres) sur la Amyloodinium (maladie du Dinoflagellés peau, branchies ocellatum velours) &/ou les ailerons; faiblesse; anorexie; étincellement; éraflure. Cryptocaryonosis Un saupoudrage (maladie des blanc de la peau ; points blancs) Parasite détresse Cryptocaryonose Cryptocaryon protozoaire respiratoire ; (marine white irritans externe éraflure; mue de la spot peau; alimentation disease/marine réduite ich) aucun traitement connu; désinfection des systèmes d’élevage; poissons en quarantaine - occasionnellement les poissons récupéreront tout seuls; réduire au minimum les densités de charge. Immersion en eau douce (5-15 min) , immersion dans le formol (30 min, 2-4 ml de formol dans 10 litres) - non approuvés dans l’alimentation des poissons Les antibactériens sont administrés dans l'eau ou dans l’aliment; l’élimination et le traitement des poissons malades; désinfection des systèmes de culture; réduire le stress Les antibactériens sont administrés dans l'eau ou dans l’aliment; l’élimination et le traitement des poissons malades; désinfection des systèmes de culture ; réduire le stress Immersion en eau douce (5-15 min); rinçage en bassin (au moins des volumes de 6 bassins par jour); filtration (micro écran, tambour/ filtres de perle) ; sulfate de cuivre - non approuvé pour la nourriture de poissons; immersions en formol (30 min, 2-4 ml de formol de 10 litres) - non approuvés pour la nourriture de poissons; Réduire la salinité (≤ 16‰ pendant ~14 jours (≤ 10‰ pendant 3 heures); basse température <19 °C sulfate de cuivre non approuvé pour la nourriture des poissons;immersions en formol (30 minutes, 2-4 ml de formol, 2-4ml de formol dans 10 litres) - non approuvé pour la nourriture de poissons Fournisseurs d'expertise en pathologie Généralement, les agences gouvernementales, les entreprises privées et les instituts pédagogiques offrent des FAO Fisheries and Aquaculture Department services concernant le diagnostic et le traitement des maladies affectant les organismes aquatiques. L'aide pour localiser les moyens de diagnostic peut être obtenue auprès des autorités locales responsables de surveiller la production des poissons en captivité. Statistiques Statistiques de production Production mondiale de l'aquaculture (tonnes) Source: FAO FishStat 100k 75k 50k 25k 0k 1950 1960 1970 1980 1990 2000 2010 Sciaenops ocellatus Plus de 94 pour cent de la production globale de l'aquaculture en 2004 a été réalisé en Chine, Israël, îles Maurice,île Mayotte et les Etats-Unis d'Amérique (3 pour cent) sont également des producteurs importants. La valeur totale de la production globale en 2004 était de 55 791 000 USD. Marché et commercialisation Les produits de base de l'industrie du tambour rouge sont les filets et les steaks frais ou surgelés (170-340 g), bien que les poissons entiers, étripés sont aussi bien vendus par occasions. Comme avec d'autres espèces, les prix du marché sont régis par l'offre et la demande. Actuellement aux Etats-Unis, le prix du tambour rouge entier acheté au niveau des fermes commerciales est de 4,19-4,63 USD/kg. Aucune information n’est actuellement disponible sur le commerce de cette espèce en Chine. Situation et tendances Le tambour rouge est une espèce robuste à croissance, relativement rapide et pour lequel plusieurs difficultés associées à la culture des poissons de mer ont été surmontées, (par exemple la ponte, l’alimentation, les tolérances environnementales). Cependant, les mortalités élevées dues aux basses températures de l'eau suscitent le besoin de prendre en considération et de manière soigneuse les emplacements et/ou les systèmes de production employés par les éleveurs. Néanmoins, puisque les technologies de l'aquaculture deviennent de plus en plus avancées, il est probable que la production du tambour rouge continue à augmenter dans le monde entier par la plus grande efficacité des fermes existantes et l'expansion vers d’autres pays. Plus de recherche dans les domaines de l'efficacité de l'alimentation, du traitement des maladies, de la tolérance de la température et les systèmes d'aquaculture de recyclage aidera à assurer une production écologiquement et économiquement saine de cette espèce durant les prochaines années. Problèmes et contraintes majeurs Dans les régions où le tambour rouge est considéré comme une espèce exotique, l'évasion des poissons maintenus en captivité dans des cages ou d'autres systèmes de production peuvent affecter négativement la flore et la faune endémiques de la région par la compétition pour l’accès aux ressources, telles que la nourriture FAO Fisheries and Aquaculture Department et l'habitat. Un autre problème potentiel de la culture des espèces exotiques dans un milieu naturel (c.-à-d. filet de cages/enclos) est le transfert des maladies aux populations endémiques. On pense, par exemple, que la souche particulière du Streptococcus iniae isolée chez les poissons sauvages (Pomadasys stridens et Synodus variegatus) au niveau du Golfe d'Eilat (Israël) peut être une souche exotique provenant du tambour rouge élevé dans les cages voisines. Les décharges issues des exploitations basées à terre et les produits non consommés/des déchets des systèmes aquacoles ouverts peuvent négativement influencer le milieu environnant. Les mesures fréquemment prises pour diminuer la quantité de décharge et/ou de déchets entrant dans l’environnement incluent le traitement des eaux usées avant leur décharge (filtration, bassins de sédimentation), l'efficacité de l'alimentation et la digestibilité croissantes, limitant la quantité de production dans les régions sensibles et utilisant des systèmes d'aquaculture de recyclage pour l'entretien des géniteurs, la culture larvaire et/ou des opérations de grossissement. Pratiques pour une aquaculture responsable L'aquaculture du tambour rouge devrait suivre les principes décrits dans le code de conduite de la FAO pour une pêche responsable. Ces pratiques incluent le maintien de la diversité génétique, la surveillance de la santé des poissons, empêchant la diffusion de maladie, assurant une valeur nutritive élevée du produit et limitant les impacts sur l'environnement. Références Bibliographie Arnold, C.R. 1988. Controlled year-round spawning of red drum Sciaenops ocellatus in captivity. Contributions in Marine Science, 30:65-70. Arnold, C.R., Bailey, W.H., Williams, T.D., Johnson, A. & Lasswell, J.L. 1976. Laboratory spawning and larval rearing of red drum and southern flounder. Proceedings of the Annual Conference of the Southeastern Association of Fish and Wildlife Agencies, 31:437-440. Colorni, A., Diamant, A., Eldar, A., Kvitt, H. & Zlotkin, A. 2002. Streptococcus iniae infections in Red Sea cage-culture and wild fishes. Diseases of Aquatic Organisms, 49: 165-170. Colura, R.L. 1990. Saltwater pond fertilization. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 78-79. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. Craig, S.R., Arnold, C.R. & Holt, G.J. 1994. The effects of enriching live foods with highly unsaturated fatty acids on the growth and fatty acid composition of larval red drum Sciaenops ocellatus. Journal of the World Aquaculture Society, 25:424-431. Crocker, P.A., Arnold, C.R., DeBoer, J.A. & Holt, G.J. 1981. Preliminary evaluation of survival and growth of juvenile red drum (Sciaenops ocellata) in fresh and salt water. Journal of the World Mariculture Society, 12:122-134. Gatlin, D.M, III. 2002. Red drum, Sciaenops ocellatus. In: C.D. Webster & C.E. Lim (eds.), Nutrient Requirements and Feeding of Finfish for Aquaculture, pp. 147-158. CABI Publishing, New York, N.Y., United States of America. Gaylord, T.G. & Gatlin, D.M. III. 1996. Determination of digestibility coefficients of various feedstuffs for red drum (Sciaenops ocellatus). Aquaculture, 139:303-314. Hoese, D.H. & Moore, R.H. 1977. Fishes of the Gulf of Mexico Texas, Louisiana, and adjacent waters. Texas A&M University Press, College Station, Texas, United States of America. 327 pp. Holt, G.J. 1993. Feeding larval red drum on microparticulate diets in a closed recirculating water system. Journal of the World Aquaculture Society, 24: 225-230. Holt, G.J. 1990. Growth and development of red drum eggs and larvae. In: G.W. Chamberlain, R.J. Midget, & FAO Fisheries and Aquaculture Department M.G. Haby (eds.), Red Drum Aquaculture, pp. 46-50. Texas A&M Sea Grant College Program No. TAMUSG-90-603. College Station, Texas, United States of America. Holt, J., Arnold, C.R. & Riley, C.M. 1990. Intensive culture of larval and post larval red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 53-56. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. Holt, J., Godbout, R. & Arnold, C.R. 1981a. Effects of temperature and salinity on egg hatching and larval survival of red drum, Sciaenops ocellata. Fishery Bulletin,79: 569-573. Holt, J., Johnson, A.G., Arnold, C.R., Fable, W.A. & Williams, T.D. 1981b. Description of eggs and larvae of laboratory reared red drum Sciaenops ocellata. Copeia, 4:751-756. Holt, S.A., Kitting, C.L. & Arnold, C.R.1983. Distribution of young red drums among different sea-grass meadows. Transactions of the American Fisheries Society, 112:267-271. Hong, W. & Zhang, Q. 2003. Review of captive bred species and fry production of marine fish in China. Aquaculture, 227:305-318. Lazo, J.P., Dinis, M.T., Holt, G.J., Faulk, C. & Arnold, C.R. 2000. Co-feeding microparticulate diets with algae: toward eliminating the need of zooplankton at first feeding in larval red drum (Sciaenops ocellatus). Aquaculture, 188:339-351. Lutz, G. 1999. Red Drum: a re-emerging aquaculture species. Aquaculture Magazine, 25(4):38-41. Matlock, G.C. 1990. The life history of red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 1-21. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. McBryde, G. 1994. Financial characteristics of a red drum aquaculture firm with winter nursery production. Aquaculture, 122:107-118. McCarty, C.E., Geiger, J.G., Strumer, L., Gregg, B.A. & Rutledge, W.P. 1986. Marine fish culture in Texas: a model for the future. In: R.H. Stroud (ed.), Fish Culture in Fisheries Management, pp. 249-262. American Fisheries Society, Fish Culture and Fisheries Management Sections, Bethesda, Maryland, United States of America. Neill, W.H. 1990. Environmental requirements of red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 105-108. Texas A&M Sea Grant College Program No. TAMU-SG90-603. College Station, Texas, United States of America. O'Bryen, P.J. & Lee, C.-S. 2003. Management of aquaculture effluents workshop discussion summary. Aquaculture, 226:227-242. Peters, K.M. & McMichael Jr., R.H. 1987. Early life history of the red drum, Sciaenops ocellatus (Pisces: Sciaenidae). Estuaries, 10:92-107. Piedrahita, R.H. 2003. Reducing the potential environmental impact of tank aquaculture effluents through intensification and recirculation. Aquaculture, 226:35-44. Roberts, D.E. Jr. 1990. Photoperiod/temperature control in the commercial production of red drum (Sciaenops ocellatus) eggs. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 35-43. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. Simmons, E.G. & Breuer, J.P. 1962. A study of redfish Sciaenops ocellata Linnaeus, and black drum Pogonias cromis Linnaeus. Publications Institute Marine Science, University of Texas at Austin, 8:184-211. Tacon, A.G.J. & Forster, I.P. 2003. Aquafeeds and the environment: policy implications. Aquaculture, 226:181-189. Liens utiles FAO Fisheries and Aquaculture Department Aquafind Aquatic Animal Pathogen and Quarantine Information System - AAPQIS Aquatic Network Database on Introductions of Aquatic Species - DIAS European Aquaculture Society - EAS FishBase FAO FishStatJ – Universal software for fishery statistical time series GLOBEFISH Network of Aquaculture Centres in Asia-Pacific - NACA World Aquaculture Society - WAS FAO Fisheries and Aquaculture Department