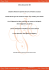Influence du jus de pamplemousse sur la toxicité des statines en
Transcription
Influence du jus de pamplemousse sur la toxicité des statines en
Mini-revue Sang Thrombose Vaisseaux 2004 ; 16, n° 5 : 249–52 Influence du jus de pamplemousse sur la toxicité des statines en pratique clinique Stéphane Mouly, Isabelle Mahé, Irène Jarrin, Jean-François Bergmann Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 08/02/2017. Clinique thérapeutique, Service de Médecine Interne A, Hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France La simvastatine, la lovastatine et l’atorvastatine, utilisées dans la prise en charge au long cours des patients coronariens, ont une biodisponibilité faible et variable (5 à 40 %) en raison d’un métabolisme intestinal extensif par le cytochrome P450 3A4 et présentent de fait un risque majeur d’interaction avec d’autres médicaments ou substances inhibitrices de leur métabolisme, telles les furanocoumarines contenues dans le jus de pamplemousse. L’inhibition du métabolisme intestinal de simvastatine, lovastatine ou atorvastatine par ce dernier expose au risque majeur de rhabdomyolyse parfois mortelle par augmentation de leurs concentrations sériques de 300 à 1 600 %. De plus un seul verre de jus de pamplemousse peut inhiber pendant près de 3 j l’activité CYP3A4 intestinale. En conséquence, l’utilisation de ces trois statines chez les consommateurs de jus de pamplemousse doit être proscrite et la pravastatine, la fluvastatine ou bientôt la rosuvastatine (peu ou pas métabolisées par le CYP3A4 intestinal) doivent être recommandées chez ces patients. Mots clés : simvastatine, jus de pamplemousse, furanocoumarine, cytochrome P450 3A4 intestinal Généralités – Le concept de métabolisme intestinal Correspondance et tirés à part : Stéphane Mouly E-mail : [email protected] Pour les médicaments ingérés par voie orale, l’intestin grêle humain constitue la première barrière contre la pénétration des xénobiotiques dans l’organisme. Les principales enzymes de détoxification de l’organisme sont les cytochromes P450 (CYP), localisés dans le réticulum endoplasmique des cellules [1, 2]. Les CYP sont responsables du métabolisme et de l’élimination de la grande majorité des médicaments commercialisés. Leur expression variable d’un individu à l’autre rend compte des différences observées dans la biodisponibilité de certains médicaments, et par conséquent leur efficacité et toxicité. Jusqu’en 1992, le foie était considéré comme le site principal de détoxification des xénobiotiques de par sa richesse en CYP, et notamment en CYP3A4 qui constitue la voie métabolique principale de plus de 60 % des médicaments actuellement commercialisés [1, 2]. L’identification récente de grandes quantiSTV, n° 5, vol. 16, mai 2004 249 Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 08/02/2017. tés de CYP, notamment de CYP3A4 au niveau des cellules intestinales humaines, a permis de confirmer le rôle de barrière de détoxification joué par l’intestin grêle chez l’homme (figure 1). L’importance de l’intestin grêle au cours du métabolisme et de l’élimination des médicaments a été précisé lors des premières interactions médicamenteuses observées avec certains aliments ou boissons non métabolisées par le foie, en particuliers avec le jus de pamplemousse. L’effet du jus de pamplemousse sur les concentrations plasmatiques des médicaments fut identifié pour la première fois par hasard en 1989, lors d’une étude de l’effet de l’alcool sur la pharmacocinétique d’un antagoniste calcique, la félodipine [3]. Les auteurs avaient en effet ajouté du jus de pamplemousse à l’alcool afin d’en masquer le goût. Les concentrations plasmatiques de félodipine furent multipliées par cinq ou plus en association avec le jus de pamplemousse avec pour conséquence une fréquence accrue de survenue d’hypotension orthostatique. Depuis 1989, de très nombreuses interactions impliquant différentes classes médicamenteuses, dont les statines, ont été observées avec le jus de pamplemousse, avec pour conséquence, une augmentation de l’efficacité mais aussi de la toxicité médicamenteuse, sans augmentation de la demi-vie d’élimination (tableau 1). Mécanisme physiopathologique Toutes ces interactions ont en commun de survenir avec des molécules qui subissent un important métabolisme au niveau intestinal par le CYP3A4 (figure 1) limitant ainsi leur absorption et à l’origine une biodisponibilité faible et varia- Sang portal Pgp 3A4 3A4 Pgp 3A4 Pgp Pgp 3A4 Jus de pamplemousse Médicament Médicament Médicament Médicament Intestin grêle Figure 1. Expression et localisation du CYP3A4 (3A4) au niveau de la bordure en brosse de cellules intestinales humaines (entérocytes) et inhibition du métabolisme intestinal des médicaments par le jus de pamplemousse. P-gp = Pglycoprotéine. 250 ble [4]. Parmi les nombreuses substances identifiées dans le jus de pamplemousse, deux furanocoumarines, la 6’7’dihydroxybergamottine et la bergamottine, présentes en grande quantité, ont un pouvoir inhibiteur spécifique et puissant de l’activité CYP3A4 intestinale [5]. Cette inhibition survient moins de 4 h après l’ingestion de jus de pamplemousse et se caractérise par une chute du contenu intestinal en CYP3A4 pouvant survenir après l’ingestion d’un simple verre de 150 à 200 mL de pamplemousse fraîchement pressé ou concentré [5, 6]. La majorité des jus de pamplemousse commercialisés peuvent donc être à l’origine des interactions médicamenteuses décrites avec une ampleur variable qui dépend de la concentration en 6’7’dihydroxybergamottine et bergamottine de chaque préparation qui ne figure évidemment pas sur l’étiquette commerciale [3, 5, 6]. De plus, cet effet inhibiteur est prolongé au moins 3 j après une prise unique d’environ 200 mL, temps nécessaire à la néosynthèse intestinale de CYP3A4 actif, détruit par les furanocoumarines (inhibition dite « suicide ») [7, 8]. Statines et jus de pamplemousse Parmi les nombreuses statines actuellement commercialisées, la simvastatine, la lovastatine et l’atorvastatine sont caractérisées par une faible biodisponibilité, de l’ordre de 5 à 20 %, du fait d’un métabolisme intestinal extensif et variable qui dépend du CYP3A4, et présentent donc un risque majeur d’interaction médicamenteuse [9]. Inversement, la pravastatine, non métabolisée par les CYP et la fluvastatine, métabolisée par le CYP2C9 (isoforme insensible à l’effet du jus de pamplemousse) ne semblent pas interagir avec le jus de pamplemousse [9]. La prise de jus de pamplemousse augmente les concentrations de simvastatine d’un facteur de 9 à 16 et celles de simvastatine acide (métabolite actif hydrosoluble) d’un facteur 7 [10]. De plus, l’activité inhibitrice de l’HMG-CoA réductase de la simvastatine est multipliée par trois en présence de jus de pamplemousse. Cette interaction a par ailleurs été confirmée in vitro sur microsomes hépatiques, en utilisant les deux principales furanocoumarines contenues dans le jus de pamplemousse et impliquées dans l’inhibition enzymatique du CYP3A4 [11]. De la même façon, la prise de jus de pamplemousse augmente les concentrations de lovastatine d’un facteur 12 à 15, et celles de la lovastatine acide (métabolite actif) d’un facteur 4 à 5 [12]. Pour ces deux statines, la variabilité inter-individuelle de cette interaction médicamenteuse est très importante (certains sujets ayant une augmentation d’un facteur de 25 à 30 des concentrations de statine [10, 102], principalement liée à la variabilité STV, n° 5, vol. 16, mai 2004 Tableau 1. Liste non-exhaustive des médicaments impliqués dans les interactions avec le jus de pamplemousse [1, 8, 10]. Biodisponibilité (%) ↑ de l’aire sous la courbe (%) ↑ du pic (Cmax) (%) Conséquences Felodipine Nifédipine Nitrendipine Nimodipine Nicardipine Nisoldipine Verapamil – – – 5-40 – – – – – – 150-300 – – – – – – 150-400 – – – – – – Hypotension Orthostatique Malaises – Terfenadine 5 250 350 Torsade de pointe Saquinavir 1-4 200 Triazolam Midazolam 30-40 – 150 – 140 – Somnolence – Ciclosporine 20 150 150 Effet bénéfique* Simvastatine Lovastatine Atorvastatine – 5-20 – 900-1 600 900-1 600 250 400-900 600-1 200 200 – Rhabdomyolyse – Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 08/02/2017. Médicament Effet bénéfique* * Le jus de pamplemousse est utilisé pour augmenter la biodisponibilité de Saquinavir et de Ciclosporine et réduire la variabilité inter- et intra- individuelle de leur absorption intestinale. inter-individuelle d’expression et d’activité du CYP3A4 intestinal [3, 4, 13]. Summary Effects of grapefruit juice on the toxicity of statins in clinical practice Conséquences pratiques pour le clinicien prescripteur Les conséquences cliniques de n’importe quelle interaction médicamenteuse sont multifactorielles et dépendent essentiellement de la nature du médicament considéré (index thérapeutique), du terrain du patient (comorbidité, polymédication) et des horaires de prise des différents protagonistes impliqués dans l’interaction [3, 7, 8, 14]. En règle générale, un doublement des concentrations sériques est au minimum nécessaire pour alerter le clinicien sur les risques potentiels de toxicité accrue au décours de l’interaction médicamenteuse considérée [3, 14]. Compte tenu de l’interaction majeure observée entre statines et jus de pamplemousse [10-12] (tableau 1) et les millions de patients potentiellement concernés par cette association, la consommation de ce dernier devrait être théoriquement contre-indiquée chez tout patient qui suit un traitement au long cours par simvastatine, lovastatine ou atorvastatine [9]. L’augmentation d’un facteur 3 de l’activité thérapeutique et potentiellement de la toxicité musculaire observée avec simvastatine [10] pourrait aussi inciter le clinicien à réduire la posologie de statine d’un facteur 3 en cas de consommation régulière de jus de pamplemousse, mais ceci n’a jamais été validé. Enfin, une dernière possibilité HMG-CoA reductase inhibitors such as simvastatin, lovastatin and atorvastatin have been extensively prescribed in patients with coronary heart disease, with a substantial decrease in cardiovascular mortality. They have low and highly variable oral bioavailability (5 to 40%) mainly due to an extensive, cytochrome P450 3A4-mediated intestinal metabolism. Because intestinal CYP3A4 activity can be modulated by numerous drugs and food products, these medications are subject to clinically relevant drug-drug or drug-food interaction, especially with grapefruit juice which contains high amount of furanocoumarins known as potent inhibitors of intestinal CYP3A4. Coadministration of one of these three statins with grapefruit juice increases their serum concentrations by 3- to 16-fold, leading to an increased risk of severe rhabdomyolysis. Moreover, a single glass of 200 mL grapefruit juice can inhibit intestinal CYP3A4 activity for three days. Consequently, the use of simvastatin, lovastatin or atorvastatin should be avoided in association with grapefruit juice. Pravastatin, fluvastatin and soon rosuvastatin should be prefered, as they are not CYP3A4 substrates and to date, no interaction have been described with grapefruit juice. Key words: simvastatin, grapefruit juice, furanocoumarin, intestinal cytochrome P450 3A4 STV, n° 5, vol. 16, mai 2004 251 Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 08/02/2017. pourrait être le respect d’un délai d’au moins 24 heures entre la prise de statine et celle de jus de pamplemousse. En effet, comparativement à une prise simultanée, un délai de 24 h entre la prise de simvastatine et celle de jus de pamplemousse réduit de près de 90 % l’effet de ce dernier sur la pharmacocinétique de simvastatine [8, 15]. Lorsque ce délai est porté à 3 jours ou plus, il n’existe plus d’interaction pharmacocinétique, ni dynamique entre statine et jus de pamplemousse [15]. Cependant, la fréquence de prise des statines est quotidienne en pratique. Par conséquent, en l’absence de test prédictif individuel du métabolisme intestinal, reflet indirect probable de l’amplitude potentielle de cette interaction, la consommation de jus de pamplemousse doit être déconseillée en cas de prescription de statine. Alternativement, la pravastatine, la fluvastatine ou très prochainement la rosuvastatine [16] doivent être préférées en cas de consommation régulière de jus de pamplemousse. ■ tuents : Decreased enterocyte CYP3A4 concentration and mechanismbased inactivation by furanocoumarins. Drug Metab Dispos 1997 ; 25 : 1228-33. Références 12. Kantola T, Kivisto KT, Neuvonen PJ. Grapefruit juice increases serum concentrations of lovastatin and lovastatin acid. Clin Pharmacol Ther 1998 ; 63 : 397-402. 1. Watkins PB. Drug metabolism by cytochromes P450 in liver and small bowel. Gastrointest Pharmacol 1992 ; 21 : 511-25. 2. Kaminsky LS, Fasco MJ. Small intestinal cytochromes P450. Crit Rev Toxicol 1991 ; 21 : 407-22. 252 6. Lown KS, Bailey DG, Fontana RJ, et al. Grapefruit juice increases felodipine oral availability in humans by decreasing intestinal CYP3A protein expression. J Clin Invest 1997 ; 99 : 2545-53. 7. Takanaga H, Ohnishi A, Murakami H, et al. Relationship between time after intake of grapefruit juice and the effect on pharmacokinetics and pharmacodynamics of nisoldipine in healthy subjects. Clin Pharmacol Ther 2000 ; 67 : 201-14. 8. Greenblatt DJ, Von Moltke LL, Harmatz JS, et al. Time course recovery of cytochrome P450 3A function after single doses of grapefruit juice. Clin Pharmacol Ther 2003 ; 74 : 121-9. 9. Becquemont L. Interactions médicamenteuses avec les hypolipémiants. Thérapie 2003 ; 58 : 85-90. 10. Lilja JJ, Kivisto KT, Neuvonen PJ. Grapefruit juice-simvastatin interaction : effect on serum concentrations of simvastatin, simvastatin acid, and HMG-CoA reductase inhibition. Clin Pharmacol Ther 1998 ; 64 : 477-83. 11. Le Goff-Klein N, Koffel JC, Jung L, Ubeaud G. In vitro inhibition of simvastatin metabolism, a HMG-CoA redustase inhibitor in human and rat liver by bergamottin, component of grapefruit juice. Eur J Pharm Sci 2003 ; 18 : 31-5. 13. Paine MF, Khalighi M, Fisher JM, et al. Characterization of interintestinal and intraintestinal variations in human CYP3A-dependent metabolism. J Pharmacol Exp Ther 1997 ; 283 : 1552-62. 3. Bailey DG, Malcolm J, Arnold O, Spence JD. Grapefruit juice-drug interactions. Br J Clin Pharmacol 1998 ; 46 : 101-10. 14. Dresser GK, Spencer JD, Bailey DG. Pharmacokinetic-pharmacodynamic consequences and clinical relevance of cytochrome P450 3A4 inhibition. Clin Pharmacokinet 2000 ; 38 : 41-57. 4. Hall SD, Thummel KE, Watkins PB, et al. Molecular and physical mechanisms of first-pass extraction. Drug Metab Dispos 1999 ; 27 : 161-6. 15. Lilja JJ, Kivisto KT, Neuvonen PJ. Duration of effect of grapefruit juice on the pharmacokinetics of the CYP3A4 substrate simvastatin. Clin Pharmacol Ther 2000 ; 68 : 384-90. 5. Schmiedlin-Ren P, Edwards DJ, Fitzsimmons ME, et al. Mechanism of enhanced oral availability of CYP3A4 substrates by grapefruit consti- 16. Crestor®. Brochure d’information révisée. AstraZeneca. RueilMalmaison, France, février 2004. STV, n° 5, vol. 16, mai 2004