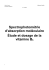Spectroscopie dans l`ultraviolet et le visible
Transcription
Spectroscopie dans l`ultraviolet et le visible
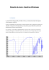
Complément - Chapitre 5 Spectroscopie Spectroscopie dans l’ultraviolet et le visible La région du visible du spectre électromagnétique correspond à la lumière dont les longueurs d’onde varient environ de 400 à 700 nanomètres (1 nm = 10-9 mètre). Les longueurs d'onde de la lumière ultraviolette sont plus courtes, soit environ de 10 nm à 400 nm, alors que la lumière infrarouge possède des longueurs d'onde plus grandes, aux alentours de 2,5 μm à 25 μm (1 μm = 10-6 mètre) dans le cas de l’IR moyen, région utilisée pour les spectres IR. Les anciennes unités utilisées pour ce type de spectroscopie étaient les millimicrons (1 mμ = 1 nm) ou angström (10 Å = 1 nm). Le tableau 5.a dresse une liste des longueurs d’onde correspondant aux régions du visible et de l’ultraviolet exprimées avec les différentes unités. La quantité d’énergie associée à la lumière visible varie de 155 kJ/mol à 314 kJ/mol et celle de la lumière ultraviolette, de 314 kJ/mol à 628 kJ/mol (voir le tableau 5.a). Cette énergie est beaucoup plus élevée que celle employée en spectroscopie infrarouge (8 kJ/mol à 50 kJ/mol). Elle correspond à la quantité d’énergie requise (qui doit être absorbée) pour provoquer le saut d’un électron d’une orbitale moléculaire occupée à une orbitale moléculaire d’énergie supérieure vacante. Les spectres UV-visibles sont donc des spectres d’absorption. De tels sauts d’électrons sont appelés transitions électroniques. Un spectre ultraviolet-visible démontre les transitions électroniques, soit le déplacement des électrons d’une orbitale moléculaire occupée vers une autre orbitale d’énergie supérieure et vacante. 1 nanomètre (nm) = 10–9 mètres 1 millimicron (mµ) = 1 nm 10 angströms (Å) = 1 nm Remarque : La molécule excitée pourra dissiper son énergie absorbée en émettant de la chaleur ou de la lumière (par exemple, dans les phénomènes de fluorescence et de phosphorescence). Tableau 5.a Unités des spectres dans l’ultraviolet et le visible Région du spectre Unités actuelles Anciennes unités Visible (vis) 400–800 nm 4 000–8 000 Å Ultraviolet (UV) 200–400 nm 2 000–4 000 Å Chimie organique 1 – Chapitre 5 – Complément © 2008 Les Éditions de la Chenelière inc. 1 Figure 5.a Spectre d’absorption du 4-méthylpent-3-én-2-one La figure 5.a montre un spectre d’absorption ultraviolet typique. Contrairement aux spectres infrarouges, les spectres ultraviolets-visibles sont assez étendus et ne comportent généralement qu’un petit nombre de bandes d’absorption. Chaque bande d’absorption est enregistrée à la longueur d'onde à laquelle l’absorbance maximale survient (λmax). La cétone conjuguée et insaturée dont le spectre est montré à la figure 5.a présente une absorption intense à λmax = 232 nm et une absorption notablement plus faible à λmax = 330 nm. L’intensité d’une bande d’absorption peut être exprimée quantitativement. Cette intensité est fonction de la structure de la molécule, mais aussi du nombre de molécules qui absorbent les radiations dans le trajet du faisceau. Si l’on suppose qu’un faisceau de lumière à une longueur d’onde donnée traverse un échantillon absorbant situé dans une cuvette d’épaisseur A (voir la figure 5.b), l’absorbance correspond au logarithme du rapport de l’intensité du faisceau incident (I0) sur celle du faisceau sortant (I) de l’échantillon, tel que montré par l’équation 5.a. Cette équation est en fait la loi de BeerLambert 1 . L’absorbance d’un échantillon dépend de la structure moléculaire et du nombre de molécules (concentration), à une longueur d’onde déterminée. 1 En l’honneur du mathématicien, physicien et astronome français Johann Heinrich Lambert (1728-1777) et du mathématicien, chimiste et physicien allemand August Beer (1825-1863) qui découvrirent cette loi à des moments distincts, respectivement en 1760 et en 1852. Dans certains pays, notamment en Russie, cette loi porte le nom du mathématicien, physicien et hydrographe français Pierre Bouguer (1698-1758) qui élabora cette loi en 1729 (on parle de la loi de Bouguer ou de la loi de Beer-Lambert-Bouguer). Chimie organique 1 – Chapitre 5 – Complément © 2008 Les Éditions de la Chenelière inc. 2 Figure 5.b Illustration du faisceau de lumière incident I0 traversant une cuvette contenant l’échantillon étudié. Le faisceau sortant est désigné par I. Io I l A = log I0 = - log T = ε A c I (équation 5.a) où A (qui n’a pas d’unité) est l’absorbance de l’échantillon à la longueur d’onde (λ) sélectionnée (qui correspond généralement à la longueur d’onde où l’absorbance est maximale); ε (la lettre grecque epsilon) représente l’absorptivité molaire, aussi parfois appelé cœfficient d’extinction molaire, (mol-1 ⋅L ⋅cm-1), c est la concentration de la solution (mol/L) et A, la distance parcourue par le faisceau dans l’échantillon, soit la largeur de la cuvette (cm). Remarque : Dans un graphique de l’absorbance en fonction de la concentration (A = y et c = x), la pente de la droite obtenue correspond au produit du coefficient d’extinction molaire avec la largeur de la cellule (m = ε ⋅ A). A=εlc y = mx Chimie organique 1 – Chapitre 5 – Complément © 2008 Les Éditions de la Chenelière inc. 3 La valeur de ε pour toutes les bandes d’absorption du spectre d’un composé est une constante caractéristique d’une structure moléculaire donnée à une longueur d’onde donnée. Les valeurs de ε sont donc différentes d’une bande à l’autre dans un spectre d’absorption. Par exemple, les valeurs de ε pour les bandes du spectre de la cétone insaturée montrées à la figure 5.a sont λmax = 232 nm (ε = 12 600 mol-1 ⋅L ⋅cm-1) et λmax = 330 nm (ε = 78 mol-1 ⋅L ⋅cm-1). Exemple 5.a Si on doublait la concentration d’un échantillon donné, quel en serait l’effet sur l’absorbance A ? Quel en serait l’effet sur le coefficient d’extinction molaire ε ? Solution L’absorbance observée A doublerait puisque l’absorbance est directement proportionnelle à la concentration selon la loi de Beer-Lambert. Toutefois, la valeur de ε dépend de la nature de la substance absorbante (et de la longueur d’onde) et demeure donc constante, c’est-à-dire qu’elle est indépendante de la concentration. Exercice 5.a Une solution de (CH3)2C=CHCOCH3, la cétone dont le spectre est illustré à la figure 5.a, est placée dans une cellule dont la largeur est de 1 cm et donne un pic à λmax = 232 nm avec une absorbance observée de A = 2,2. Calculez la concentration de la solution. Utilisez la valeur de ε mentionnée dans le texte ci-dessus. Les spectres ultraviolets-visibles servent surtout à déceler la présence de conjugaison. En général, les molécules sans liaisons doubles ou avec uniquement une liaison double n’absorbent pas dans la région de l’ultraviolet-visible (de 200 nm à 800 nm), contrairement aux systèmes conjugués. Cela est dû au fait que la liaison σ possède une trop grande différence d’énergie entre son orbitale moléculaire de plus haut niveau d’énergie occupée (orbitale liante) et celle inoccupée de plus bas niveau d’énergie (orbitale anti-liante). Il faudrait donc fournir une énergie nettement supérieure à celle observée dans le domaine de l’UV-visible pour pouvoir réaliser cette transition électronique. Or, dans le cas de liaisons doubles conjuguées, les transitions électroniques entre les orbitales moléculaires liante et anti-liante des liaisons π sont plus faibles en énergie. Plus la conjugaison est importante, plus la longueur d'onde de l’absorption maximale est grande (et donc l’énergie est minimale), comme il est démontré dans les exemples suivants, à la figure 5.c. Chimie organique 1 – Chapitre 5 – Complément © 2008 Les Éditions de la Chenelière inc. 4 Figure 5.c Divers systèmes conjugués avec les longueurs d’onde d’absorption maximale et les coefficients d’extinction molaire ε correspondants CH2 CH CH CH2 CH2 CH λmax = 220 nm CH CH CH CH2 λmax = 257 nm (ε = 21 mol-1 L cm-1) CH2 CH (ε = 35 mol-1 L cm-1) CH CH CH CH CH CH2 λmax = 287 nm (ε = 52 mol-1 L cm-1) λmax = 255 nm (ε = 215 mol-1 L cm-1) λmax = 314 nm -1 -1 (ε = 289 mol L cm ) λmax = 380 nm (ε = 9000 mol-1 L cm-1) λmax = 480 nm (ε = 13 mol-1 L cm-1) Exercice 5.b Selon vous, lequel des composés aromatiques suivants absorbera à la plus grande longueur d'onde ? ou CH2 Chimie organique 1 – Chapitre 5 – Complément © 2008 Les Éditions de la Chenelière inc. 5 Solutionnaire des exercices du complément 5.a La loi de Beer-Lambert est : A = ε A c En isolant c, on obtient : c = A / ε A = 2,2 / (12 600 mol-1 L cm-1 x 1 cm) = 1,7 x 10-4 mol/L 5.b Dans le biphényle (structure de gauche), toutes les liaisons doubles sont conjuguées les unes avec les autres. Par contre, le diphénylméthane (structure de droite) ne possède pas une conjugaison dans toute sa structure, car le groupement -CH2interrompt cette conjugaison. Puisque la longueur d’onde est directement proportionnelle à l’ampleur du système conjugué au sein d’une structure, c’est le biphényle qui aura la plus grande longueur d’onde d’absorption. Chimie organique 1 – Chapitre 5 – Complément © 2008 Les Éditions de la Chenelière inc. 6