Dtection de gardnerella vaginalis et trichomonas
Transcription
Dtection de gardnerella vaginalis et trichomonas
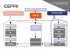
Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis Sibylle Richoz ESsanté, 48ème volée Novembre 2008 – Avril 2009 Laboratoire MCL, Niederwangen Responsable : Dr P-A. Menoud Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Remerciements Je tiens à remercier le laboratoire MCL et plus particulièrement le Dr. P-A. Menoud qui m’a accueillie durant les 3 premiers mois de mon stage afin d’effectuer mon travail de diplôme et de me familiariser avec la routine. Durant ces premiers mois, il m’a apporté son aide pour faire la partie pratique de mon travail et par la suite, ses corrections m’ont été d’une aide précieuse. Il m’a aussi permis d’avoir de l’autonomie et de gérer mon temps pour effectuer la routine et le travail de diplôme en même temps. Un grand merci également à la Dresse M. Affolter ainsi qu’à toute l’équipe de la biologie moléculaire, pour leur aide et leur soutient tout au long de mon stage. Un grand merci à tous! 1 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Sommaire La Gardnerella vaginalis ainsi que le Trichomonas vaginalis, respectivement une bactérie et un parasite, sont responsables d’infections de la sphère uro-génitale. Ils sont à l’origine de maladies sexuellement transmissibles. Les maladies sexuellement transmissibles sont en recrudescence. Elles peuvent passer complètement inaperçues pendant longtemps et se déclarer après quelques mois. Les conséquences de cette apparition tardive ou quasi absente des symptômes peuvent être graves. Cela peut aller de la simple stérilité jusqu’à l’apparition de lésions cancéreuses. Pour diminuer les risques d’infection, il faudrait faire connaître l’existence de ces agents pathogènes et communiquer les précautions d’usage à prendre afin d’éviter les contaminations. Le but de mon travail est de mettre au point une méthode de détection par PCR multiplexe avec détection en temps réel. Ceci permet de détecter les Gardnerella et les Trichomonas en même temps dans une seule réaction d’amplification, de diminuer ainsi le risque de contamination par les produits de PCR et de raccourcir le temps de manipulation. Ces analyses sont habituellement faites par culture ou observation au microscope. Cependant, la sensibilité et la spécificité de ces analyses par ces méthodes traditionnelles sont inférieures à celles des analyses faites avec des méthodes moléculaires. D’autres analyses du profil uro-génital (puro), Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum et Candida albicans, sont déjà effectuées par PCR en temps réel. Afin de pouvoir peut-être par la suite faire toutes ces analyses en même temps, nous avons choisi la méthode de détection avec des sondes TaqMan pour être dans les mêmes conditions que la méthode commerciale utilisée pour la détection de C. trachomatis et N. gonorrhoeae. Mots clés : Gardnerella vaginalis, Trichomonas vaginalis, PCR en temps réel, sondes TaqMan, sensibilité, spécificité. 2 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Abstract Gardnerella vaginalis and Trichomonas vaginalis are bacteria and parasites, respectively. They are responsible for infections of the urogenital area leading to sexually transmitted diseases (STD). Sexually transmitted diseases are increasing within the european population. They can remain undetected in individuals for a long period of time. Consequently, female and male sterilty or even cancerous lesions may originate from this lack of early detection of the infection. Therefore, it is essential to promote the prevention by providing the population with information about STD. My diploma work intends to develop a realtime multiplex PCR for G. vaginalis and T. vaginalis. Such a method decreases the risk of contamination by PCR products and shortens the hand-on-time dramatically. The gold standard is presently the culture for G. vaginalis and the observation of fresh urinary sediments under the microscope for T. vaginalis. However, such methods are relatively unspecific and not sensitive enough in addition to be time consuming. Other analysis of the urogenital analysis profile such as detection of C. trachomatis, N. gonorrhoeae, M. hominis, M. genitalium, U. urealyticum and C. albicans were previously set up by realtime multiplex PCR. Therefore, we considered the PCR conditions used for detection of these organisms as prerequisites for developing the multiplex analysis of G. vaginalis and T. vaginalis. Keywords : Gardnerella vaginalis, Trichomonas vaginalis, realtime PCR, TaqMan probe, sensitivity, specificity. 3 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Table des matières 1 Introduction .....................................................................................................................6 1.1 1.1.1 1.1.2 1.1.3 1.1.4 1.2 1.2.1 1.2.2 1.2.3 1.2.4 1.2.5 1.2.6 1.2.7 1.2.8 1.3 1.3.1 1.3.2 Gardnerella vaginalis........................................................................................................... 6 Caractères bactériologiques .............................................................................................. 6 Habitat et pouvoir pathogène............................................................................................. 6 Diagnostic .......................................................................................................................... 7 Traitement.......................................................................................................................... 7 Trichomonas vaginalis ........................................................................................................ 7 Morphologie ....................................................................................................................... 7 Epidémiologie .................................................................................................................... 8 Transmission...................................................................................................................... 8 Symptômes ........................................................................................................................ 8 Diagnostic .......................................................................................................................... 8 Aspects cliniques ............................................................................................................... 9 Trichomonas et grossesse................................................................................................. 9 Traitement.......................................................................................................................... 9 PCR en temps réel ............................................................................................................... 9 Sonde TaqMan ................................................................................................................ 10 Cycle seuil........................................................................................................................ 11 2 But ..................................................................................................................................12 3 Matériel et méthodes ....................................................................................................13 4 3.1 Prélèvements...................................................................................................................... 13 3.2 Extraction............................................................................................................................ 13 3.3 Séquence : primers et sondes.......................................................................................... 15 3.4 Protocole : mastermix ....................................................................................................... 15 3.5 Lightcycler 480 II ................................................................................................................ 16 3.6 Programme PCR................................................................................................................. 17 Résultats ........................................................................................................................18 4.1 4.1.1 4.1.2 Détection des bactéries..................................................................................................... 18 Exemple de résultats pour une analyse de Gardnerella vaginalis .................................. 18 Exemple de résultats pour une analyse de Trichomonas vaginalis ................................ 19 4 Sibylle Richoz 4.2 4.2.1 4.2.2 4.3 4.3.1 4.3.2 Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Sensibilité ........................................................................................................................... 20 Gardnerella vaginalis ....................................................................................................... 20 Trichomonas vaginalis ..................................................................................................... 23 Spécificité ........................................................................................................................... 23 Gadnerella vaginalis ........................................................................................................ 23 Trichomonas vaginalis ..................................................................................................... 24 5 Discussion .....................................................................................................................25 6 Conclusion.....................................................................................................................27 7 Références bibliographiques.......................................................................................28 8 Annexes .........................................................................................................................29 8.1 Mode opératoire pour l’amplification de Gardnerella vaginalis et Trichomonas vaginalis ........................................................................................................................................... 29 5 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 1 Introduction 1.1 Gardnerella vaginalis 1.1.1 Caractères bactériologiques Gardnerella vaginalis est un bacille d’apparence granuleuse. La paroi de cette bactérie présente des similitudes avec celle des bactéries gram positif mais la coloration nous donne un gram variable ou négatif. Elle est immobile, aéro-anaérobe facultatif, dépourvue de catalase et d’oxydase et à métabolisme fermentatif. (Euzéby, J.P., 1998) Figure 1. Microphotographie de Gardnerella vaginalis. Les bactéries sont mises en évidences par une coloration bleue au milieu de cellules épithéliales. Cette bactérie pousse mal en milieu liquide et est difficile à cultiver après repiquage. En général, elle apparaît après 48 heures sur gélose Columbia au sang de mouton, incubée dans une atmosphère humide et enrichie en CO2. Les bactéries se présentent comme de très petites colonies rondes, opaques, lisses et sans hémolyse. Par contre, on peut voir une hémolyse de type bêta sur les géloses à Gardnerella, faites avec du sang de lapin ou humain. G. vaginalis ne pousse pas sur gélose MacConkey. (Euzéby, J.P., 1998) 1.1.2 Habitat et pouvoir pathogène G. vaginalis a pour habitat le vagin de la femme. Vingt à 40% des femmes sont des porteuses saines. Alors que l’infection se transmet principalement par voie sexuelle, dans de rares cas, elle peut se trouver chez des femmes vierges. Elle est souvent la cause de vaginoses, soit comme seul germe pathogène soit en association avec des bactéries anaérobes. On la retrouve aussi lors de troubles génitourinaires, telles qu’urétrites, cystites, balano-posthites, prostatites et épididymites. Ces infections sont beaucoup plus présentes chez la femme que chez l’homme. On peut aussi 6 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée observer quelques fois des endométrites et des bactériémies chez la femme lors de la délivrance. Dans de rare cas, il y a une atteinte néonatale. (Euzéby, J.P., 1998) 1.1.3 Diagnostic L’isolement est réalisé sur géloses au sang, ou enrichies au sang. Des milieux plus sélectifs peuvent être utilisés telle que la gélose Gardnerella, qui est une gélose Columbia additionnée de 5% de sang humain. Cela permet de limiter ou d’inhiber la croissance des micro-organismes associés. L’incubation se fait à 37°C, en milieu humide et contenant entre 5 et 10% de CO2. La confirmation du diagnostic repose sur l’aspect des colonies, le gram, ainsi que sur différents tests biochimiques effectués. (Euzéby, J.P., 1998) 1.1.4 Traitement G. vaginalis est sensible aux bêta-lactamines, à l’érythromycine, à la pristinamycine, à la clindamycine, à la vancomycine, à la novobiocine et au métromidazole. Elle est résistante à la colistine, l’acide nalidixique et à la néomycine. Les tétracyclines et les sulfamides sont variables selon la souche. (Euzéby, J.P., 1998) 1.2 Trichomonas vaginalis 1.2.1 Morphologie Trichomonas vaginalis (T.V.) est un parasite mobile, équivalent à la taille d’un gros lymphocyte. Il possède 3 à 4 flagelles à sa grosse extrémité, et est entouré d’une membrane ondulante. Son cytoplasme est granuleux. Le noyau est petit et se trouve près du début des flagelles. Les kystes ressemblent fortement à des lymphocytes. Pour les distinguer, on fait une coloration au bleu de crésyl, qui n’imprègne pas les kystes, tandis que les lymphocytes sont colorés. (Bernard P., Sharaf M., 2001) Figure 2. Microphotographie de Trichomonas vaginalis 7 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 1.2.2 Epidémiologie Les infections avec ce parasite touchent les personnes sexuellement actives, femmes et hommes, entre 15 et 35 ans environ. En moyenne, 40% des femmes et 15% des hommes sont infectés une fois dans leur vie. Entre 25 à 85% des hommes sont infectés par T.V. si leur partenaire l’est aussi. Par contre, 100% des femmes le sont lorsque le partenaire a un Trichomonas. L’incidence de cette maladie augmente avec l’âge. (Bernard P., Sharaf M., 2001) 1.2.3 Transmission La transmission est majoritairement sexuelle. Une transmission non-sexuelle peut être évoquée du fait que le parasite peut rester vivant 24 heures sur la literie, le siège de toilette ainsi que dans l’eau du bain par exemple. Il est possible avec cela d’expliquer certains cas d’infection au T.V. chez la femme vierge ou chez le jeune enfant. (Bernard P., Sharaf M., 2001) 1.2.4 Symptômes Les 3 principaux symptômes chez la femme sont : la leucorrhée, les brûlures et les prurits vulvaires. La leucorrhée se manifeste par un écoulement vaginal abondant de coloration verte tirant sur le jaune, de consistance mousseuse et généralement avec une odeur désagréable. Ces symptômes peuvent s’accompagner de dyspareunie (douleur au moment du rapport sexuel), de douleurs du périnée, de dysurie. A l’examen, on voit une vulve et un périnée irrités avec parfois un œdème des lèvres. A l’intérieur du vagin, on distingue quelques fois la présence de petites taches sur la muqueuse écarlate qui va favoriser une sécrétion accrue. Chez l’homme, les infections sont souvent très discrètes mais peuvent néanmoins faire apparaître quelques symptômes tels qu’un écoulement urétral de nature mousseuse, des rougeurs et un gonflement au niveau de l’orifice urétral et de la base du gland ainsi que des difficultés à uriner. (Bernard P., Sharaf M., 2001) 1.2.5 Diagnostic La confirmation du diagnostic s’effectue par l’examen de sécrétions vaginales ou urétrales à l’état frais entre lame et lamelle sous le microscope. Le parasite peut rester vivant plusieurs heures sur un écouvillon et 24h dans un milieu de transport. Il est possible de rechercher le germe dans le culot de centrifugation des urines. (Bernard P., Sharaf M., 2001) 8 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 1.2.6 Aspects cliniques La période d’incubation se trouve entre 2 et 60 jours. 50% des infections chez les femmes et 20% chez les hommes sont asymptomatiques. Chez les femmes, le T.V. peut entraîner plusieurs infections telles que la vulvo-vaginite subaiguëe, pseudo-salpingite, la cystite ou encore des formes rares d’endométrite ou de salpingite. (Bernard P., Sharaf M., 2001) 1.2.7 Trichomonas et grossesse La prolifération du T.V. est favorisée chez la femme enceinte par son état hormonal spécifique. Il pourrait même être la cause de certains avortements. Le parasite a été observé dans le liquide amniotique, le cordon ombilical ainsi que dans le placenta. (Bernard P., Sharaf M., 2001) 1.2.8 Traitement Le traitement se fait sur la base d’un antibiotique de la famille des nitromidazoles. Il s’impose lors de toute infection même asymptomatique que le partenaire soit aussi être traité. (Bernard P., Sharaf M., 2001) 1.3 PCR en temps réel La PCR classique s’effectue en 2 étapes, l’amplification puis l’analyse à l’aide de différentes méthodes : gel d’agarose, hybridation. La PCR en temps réel permet un gain de temps puisque la PCR et la détection se déroule en une seule étape. Beaucoup d’échantillons peuvent être analysés en même temps ce qui constitue un avantage lors d’une analyse de routine mais l’avantage principal de la PCR en temps réel est certainement la diminution du risque de contamination par des produits d’amplification qui peut conduire à la détection de faux positifs. « La PCR en temps réel utilise le principe de base de la PCR classique (amplification cyclique d’un fragment d’ADN en 3 étapes : dénaturation, hybridation et élongation) avec pour différence une amplification mesurée non pas en final mais tout au long de la réaction, donc en temps réel. » (Ameziane N., Bogard M., Lamoril J., 2005). Elle permet l’analyse du produit amplifié, grâce à la mesure en continu de la fluorescence au cours du processus d’hybridation. Il existe plusieurs méthodes de détection en temps réel de produit PCR dont les principales sont : le SYBR Green™, les sondes FRET (fluorescence resonnance energy transfert), les sondes TaqMan™, et les molecular beacons (balises moléculaires). Dans ce 9 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée travail nous avons choisi d’utiliser des sondes de types Taqman pour être en accord avec les conditions imposées au départ. 1.3.1 Sonde TaqMan Le principe de cette technique est basé sur l’activité 5’-nucléase de l’ADN polymérase : l’enzyme hydrolyse une sonde hybridée à la cible. Cette sonde, d’environ 15-20 pb est marquée avec 2 fluorophores : un à l’extrémité 5’ de la sonde (fluorophore donneur, émetteur ou reporter) et l’autre à l’extrémité 3’ de la sonde (fluorophore « extincteur », suppresseur ou quencher). Le quencher, à proximité du donneur, absorbe la fluorescence. Pendant la phase d’extension de la PCR, la Taq polymérase rencontre la sonde hybridée qui se situe à proximité d’une des deux amorces hydrolyse la sonde, grâce à son activité 5’-3’ exonucléase. Le fluorophore donneur est libéré de l’action du quencher et émet un signal fluorescent mesurable par l’appareil. Le nombre de cibles formées est ensuite suivi, cycle après cycle, en temps réel. Comme l’ADN qui sert de matrice augmente à chaque cycle, le nombre de sondes TaqMan qui peuvent s’hybrider augmente aussi, de même que la fluorescence (Jaunin, P., 2004, p.79), (Ameziane N., Bogard M., Lamoril J., 2005, p.258), (Poitras E., Houde A., 2002) Figure 3. Shéma du principe de la technique avec les sondes TaqMan 10 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 1.3.2 Cycle seuil « Pour déterminer la positivité d’une PCR, on détermine le nombre de cycles à partir duquel le produit PCR est détectable. Le moment d’apparition de ce signal seuil dénommé cycle seuil ou Ct (Cycle threshold) est dépendant de la quantité de matrice initialement présente dans l’échantillon amplifié. Le Ct calculé est inversement proportionnel au logarithme décimal du nombre de copies initiales. Il apparaît toujours au cours de la phase exponentielle de la PCR. Le résultat d’une PCR en temps réel est représenté graphiquement sous forme de courbes sigmoïdes. » (Poitras E., Houde A., Ameziane N., Bogard M., Lamoril J., 2002-2006) Figure 4. Chaque courbe correspond à un échantillon. Elle représente la mesure de la fluorescence de cet échantillon pour chaque cycle. Le signal seuil calculé automatiquement est matérialisé sur le graphe par une ligne horizontale. 11 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 2 But Le but de ce travail est de mettre au point, pour Gardnerella vaginalis et Trichomonas vaginalis, une méthode de détection simple et qui s’inscrit dans le flux des autres analyses de microbiologie moléculaire courante dans un laboratoire qui possède un département de diagnostic moléculaire. La PCR standard est fonctionnelle actuellement mais pour une raison pratique mais aussi pour des raisons de sécurité et de rapidité, il serait préférable de passer ces 2 analyses sur PCR en temps réel. Nous avons choisi une méthode de PCR en temps réel avec une détection par sondes « Taqman ». Une contrainte était imposée, une température d’hybridation à 58°C, ceci afin de se trouver dans les mêmes conditions que les autres analyses de même type (profil uro-génital qui comprend l’analyse de Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum et Candida albicans). Le programme de PCR devait également être le même. La sensibilité et la spécificité de la méthode doit être déterminée et la méthode validée par comparaison avec la méthode « Gold standard » qu’est la culture pour G. Vaginalis. 12 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 3 Matériel et méthodes 3.1 Prélèvements L’ADN de Gardnerella vaginalis a été extrait à partir de bactéries provenant de cultures fournies par le département de bactériologie du laboratoire MCL. Ce matériel a été utilisé pour définir la sensibilité. Pour la spécificité, on a utilisé de l’ADN de patients, qui ont été testés préalablement pour G. Vaginalis par une méthode de détection validée sur gel d’agarose. L’ADN de Trichomonas vaginalis a été extrait à partir de 50 sédiments urinaires fournis par l’hôpital cantonal de Fribourg. La recherche de T. vaginalis a été faite sur ces sédiments par microscopie optique dans la routine du laboratoire hospitalier. 3.2 Extraction Les acides nucléiques ont été extraits à l’aide d’un automate, Le NucliSens® easyMAG™ de bioMérieux. La méthode d’extraction des acides nucléiques, basée sur la technologie de Boom, utilise des particules de silice magnétique. Dans un milieu salin élevé, l’ADN se lie aux particules de silice magnétique. Cela constitue la phase solide. Plusieurs lavages successifs permettent d’éliminer les composés non nucléiques. L’ADN est ensuite élué et l’appareil sépare l’éluât des particules de silices à l’aide d’un aimant. - Quelques colonies de bactéries sont prélevées d’une plaque de culture et diluées dans 1000µl de NaCl 0.9% stérile. - 500µl de ce mélange sont utilisés pour l’extraction sur easyMAG. On y ajoute 500 µl de tampon de lyse et on incube 10 minutes à 70°C. - Les 1000µl sont mis ensuite dans un des puits du rack fourni par le fabricant. - On démarre l’appareil. La première étape constitue la lyse cellulaire. L’appareil ajuste à 2ml tous les puits avec du tampon de lyse et procède à une incubation de 10min. - Une fois l’incubation terminée, on ajoute manuellement les particules de silice magnétique à l’aide d’une pipette automatique. Les particules sont diluées préalablement 1/2 avec de l’eau distillée. Une fois les particules mélangées, on poursuit la purification des acides nucléiques. - Une première incubation permet aux acides nucléiques de se fixer sur les particules de silice. 13 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée - Le système d’aimants permet par la suite un lavage dynamique et une purification en fixant la silice à la paroi du puits. - Ensuite 110 µl de solution d’élution sont ajoutée. Une étape de chauffage à 60°C permet aux acides nucléiques d’être libérés de la silice. - L’étape finale consiste à séparer les particules magnétiques de l’éluât. Cette étape s’effectue grâce à un système d’aimants. Il faut si possible décanter les puits dans les 30 minutes qui suivent l’élution car la silice à tendance à se détacher de la paroi. (NucliSens easyMAG User Manual) Figure 5. EasyMAG, extrateur automatique de bioMérieux basé sur la méthode de Boom. 14 Sibylle Richoz 3.3 Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Séquence : primers et sondes Les séquences des amorces (primers) et des sondes ont été décrites dans la littérature et sont reproduites dans le tableau ci-dessous. Seules les concentrations utilisées ont été modifiées pour la mise au point de la réaction multiplexe. Primers et sondes TV_for2 AAGATGGGTGTTTTAAGCTAGATAAGGT TV_rev2 CGTCTTCAAGTATGCCCCAGTAC 83 pb TV_probe1 CCGAAGTTCATGTCCTCTCCAAGCGT GAR_for2 CGCATCTGCTAAGGATGTTG GAR_rev2 CAGCAATCTTTTCGCCAACT GAR_probe1 3.4 Tailles du fragment amplifié Séquences 91 pb TGCAACTATTTCTGCAGCAGATCC RNP309F AGATTTGGACCTGCGAGCG RNP353R GAGCGGCTGTCTCCACAAGT RNP_CY5 TTCTGACCTGAAGGCTCTGCGCG 65 pb Protocole : mastermix L’analyse de G. V. et T. V. se fait dans un seul tube (PCR multiplexe). Le mastermix contient : de l’eau distillée, du FastStart Taq DNA polymerase mastermix (Roche) ainsi que les primers et les sondes. Comme contrôle interne d’amplification nous utilisons le gène humain RNP (Ribonuclease P humaine). . Primers Concentration stock Concentration finale 50 µM 0.50 µM 50 µM 0.40 µM 20 µM 0.03 µM Sondes Concentration stock Concentration finale Trichomonas 20 µM 0.20 µM Gardnerella 20 µM 0.20 µM RNP 20 µM 0.10 µM Trichomonas (forward et reverse) Gardnerella (forward et reverse) RNP (forward et reverse) 15 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Les volumes pour un aliquot sont les suivants : Matériel H2O Roche mastermix Primers T.V. Sonde T.V. Primers G.V. Sonde G.V. Primers ctrl interne Sonde ctrl interne Conc. Stock 2x 50 µM 20 µM 50 µM 20 µM 20 µM 20 µM Volume à aliquoter 4.12 µl 10.00 µl 0.20 µl 0.20 µl 0.16 µl 0.20 µl 0.03 µl 0.10 µl 15.00 µl Volume ADN 3.5 Volume un aliquot 5.00 µl Lightcycler 480 II Ce travail a été effectué sur le LightCycler 480 II. Cet appareil est conçu pour faire des PCR en temps réel « haut-débit », c'est-à-dire que l’on travaille avec une plaque de 96 puits. Il nous permet une analyse rapide de 96 d’échantillons simultanément. Dans ce travail, nous avons utilisé 3 sondes différentes pour Trichomonas, Gardnerella et le contrôle interne, marquées avec trois fluorochromes: Fluorescein (FAM), Yakima yellow et Cy5. Fluorochrome Filtre Filtre Fluorochrome Couleur (reporter) excitation émission (quencher) Fluorescein Trichomonas 465 510 Vert BHQ-1 (FAM) Yakima yellow Gardnerella 533 580 Jaune BHQ-1 (YYE) Contrôle Cy5 618 660 Rouge BHQ-2 interne 16 Sibylle Richoz 3.6 Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Programme PCR Deux conditions ont été imposées pour ce travail: une température d’hybridation de 58°C et le programme PCR identique à celui des autres analyses du profil uro-génital.. 1. 95°C, pendant 10 min : Cela permet d’activer la Taq polymérase, enzyme qui permet l’élongation de la chaîne d’ADN. 2. 95°C, pendant 10 sec : Dénaturation des doubles brins d’ADN pour obtenir un simple brin. 3. 58°C, pendant 30 sec : Hybridation des primers et des sondes sur leur séquences complémentaires, élongation du brin et libération du fluorophore due à l’activité 5’-3’ exonucléase de la Taq polymérase. 4. 72°C, pendant 1 sec : complément d’élongation du brin d’ADN à partir des amorces et grâce à l’ajout successif de désoxyribonucléotide (dNTP) en excès dans le mélange. Les étapes 2 à 4 sont répétées 44 fois (45 cycles). 17 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 4 Résultats Toutes les analyses ont été effectuées dans les mêmes conditions d’amplification afin d’arriver au but final d’une PCR multiplexe pour le profil uro-génital. Une première série d’analyses nous a permis de tester la sensibilité de la méthode. Ensuite la spécificité a été testée. 4.1 Détection des bactéries 4.1.1 Exemple de résultats pour une analyse de Gardnerella vaginalis Pour Gardnerella vaginalis le fluorochrome utilisé est yakima yellow, avec un filtre d’excitation à 533 nm et un filtre d’émission à 580 nm. On peut observer une augmentation de la fluorescence au cours des cycles pour l’échantillon avec Gardnerella positive. En dessous, on voit un trait droit qui ne nous montre aucune fluorescence, c’est un échantillon négatif pour Gardnerella. Figure 6. Exemple de résultats obtenus par PCR en temps réel pour l’analyse de Gardnerella vaginalis. 18 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 4.1.2 Exemple de résultats pour une analyse de Trichomonas vaginalis Pour Trichomonas vaginalis le fluorochrome utilisé est FAM, avec un filtre d’excitation à 465 nm et un filtre d’émission à 510 nm. On peut observer une augmentation de la fluorescence au cours des cycles pour les 2 contrôles positifs. On voit que le contrôle négatif n’émet aucune fluorescence. Figure 7. Figure d’amplification typique pour l’analyse de Trichomonas vaginalis 19 Sibylle Richoz 4.2 Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Sensibilité 4.2.1 Gardnerella vaginalis La sensibilité a été évaluée en comparant la culture et la détection par PCR en temps réel. Des colonies pures de Gardnerella ont été ensemencées dans 1ml de NaCl à 0.9%. A partir de ce tube que l’on va considérer comme pur, des dilutions géométriques de 1/10 ont été effectuées. La dernière dilution était de 107. De ces dilutions, 50μl sont mis en culture sur plaque COS et 500μl sont extrait sur EasyMag avec un volume d’élution de 100μl. 4.2.1.1 Résultat de la sensibilité sur LC480 : Pur Cp (crossing point = point de croisement = Ct) 20.73 101 24.41 2 28.17 3 31.60 4 34.81 5 38.04 6 - 7 - Dilution 10 10 10 10 10 10 Nous pouvons observer une bonne régularité entre chaque courbe. Les Ct ont un intervalle d’environ 3-4 cycles entre chaque dilution. Cela nous indique que la dilution a été faite correctement. 4.2.1.2 Résultat de la sensibilité sur plaque Le tableau ci-dessous indique la comparaison entre le nombre colonies qui a poussé sur les plaques et le nombre de copies génomiques calculé par réaction. 20 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis Dilution Nombre de colonies qui a poussé sur plaque Pur 101 102 103 104 105 106 107 incomptable 500 86 13 1 Aucune Aucune Aucune ESsanté 48 ème volée Nombre de copies par tube PCR 250 43 6.5 0.5 Calcul du nombre de copies/tube PCR avec pour exemple la dilution 1/100 : Sur la plaque 1/100, 50μl de dilutions ont été ensemencés et 86 colonies ont poussé. Dans les 100 μl élués par EasyMag, nous avons 172 colonies (86x2) et dans les 500μl utilisé pour l’extraction, nous avons 860 colonies (172x5). Cela fait 8.6 colonies/μl. Pour chaque réaction PCR, on utilise 5μl d’ADN, donc nous avons 43 copies/tube PCR. Nous observons ici aussi une très bonne sensibilité car au moins une colonie visible sur plaque est détectée par PCR. 4.2.1.3 Quantification absolue Dans une analyse de la quantification absolue, la courbe standard est utilisée pour déterminer la concentration inconnue des échantillons. Dans ce cas, la courbe standard est représentée par une droite de régression. Voici ci-dessous comment la droite de régression a été réalisée. A partir des trois valeurs cible de CP ci-dessous, nous avons calculé la pente, l’ordonnée à l’origine ainsi que l’efficacité de cette méthode à l’aide du programme Excel. Cp 24.41 28.17 31.6 copie log copie 43 1.633468 6.5 0.812913 0.5 ‐0.30103 Pente : -3.67989 Ordonnée à l’origine : 30.69155 Efficacité : 1.869594 21 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée L’efficacité est calculée à l’aide de la formule suivante : E = 10-1/pente. Une efficacité parfaite d’amplification devrait être de 2. Ici nous sommes en présence d’une efficacité de 1.9 ce qui est très bien. Pour la quantification absolue, il faut calculer les CP à l’aide de la pente, de l’ordonnée à l’origine et du log des copies. Ensuite, nous pouvons tracer le graphique. 0.5 log copies -0.30103 Cp calcule 31.79931 1 0 30.69155 10 1 27.01166 copies 100 2 23.33178 1000 3 19.65189 10000 4 15.972 100000 5 12.29211 1000000 6 8.612223 22 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Avec ce diagramme, nous pouvons déterminer, grâce au CP, le nombre de copies génomiques par tube PCR. 4.2.2 Trichomonas vaginalis La sensibilité de Trichomonas vaginalis n’a pas pu être testée, par défaut de prélèvements positifs. L’origine des prélèvements reçus au laboratoire MCL ne vient pas d’une population de patients « à risque ». Pour pallier à ce manque de prélèvements positifs, il eût fallu cloner la région amplifiée de l’ADN de T. vaginalis dans un vecteur et utiliser le plasmide résultant à différentes dilutions dans un milieu à grande complexité génomique (milieux contenant plusieurs ADN de différentes origines bactériennes / humaines) pour tester la sensibilité de la méthode. 4.3 Spécificité 4.3.1 Gadnerella vaginalis Pour la spécificité, 16 anciens patients testés pour Gardnerella vaginalis ont été testés à nouveau, mais cette fois-ci avec la PCR en temps réel mise au point dans ce travail. Voici les résultats : Patients Résultats sur gel 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 + + + + + + + + + + + + - 23 Résultats avec PCR en temps réel + + + + + + + + + + - Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Les échantillons n°4 et 5 sont trouvés positifs sur gel et sortent négatifs sur PCR en temps réel. Les tests ont été refaits sur gel et sur LC480. Après vérification, les deux sortent toujours positif sur gel et négatif sur LC480. L’échantillon n°14 est trouvé négatif sur gel alors qu’il sort positif sur PCR en temps réel. La photo du gel a été retrouvée et en inversant les couleurs, une faible bande a été aperçue. Donc c’est un échantillon positif. Sur 12 vrais positifs, 10 ont été détectés positifs par PCR en temps réel. Ceci nous donne une spécificité de 83,3% pour la PCR en temps réel en prenant la méthode de détection sur gel comme « gold standard ». 4.3.2 Trichomonas vaginalis Pour la spécificité, 60 sédiments urinaires, testé au microscope négatif pour le Trichomonas, ont été testés sur PCR en temps réel. Le résultat des 60 sédiments était négatif au Trichomonas. Seul le contrôle positif était détectable. Nous sommes en présence d’une bonne spécificité mais pour faire correctement il aurait fallut trouver plus de patients positifs à ce parasite, mais cela est rare et fonction de la population des patients. 24 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 5 Discussion Avec ce travail, nous avons pu mettre au point une méthode de PCR en temps réel multiplexe pour réunir dans la même série l’analyse de Gardnerella vaginalis et Trichomonas vaginalis. Au début nous avons testé séparément les 2 analyses avec 2 mélanges réactionnels différents (mélange pour amplification simplex). Cela fonctionnait très bien donc nous avons très vite réuni le tout pour ne faire qu’un seul mélange avec les amorces et les sondes (mélange pour amplification multiplexe). La sensibilité de Gardnerella vaginalis a été testée en premier. La difficulté première était d’arriver à avoir des souches pures et de faire des dilutions correctes pour avoir au final de courbes d’amplification à intervalles réguliers représentatives de la qualité des dilutions. Nous avons pu déterminer une très bonne sensibilité car moins de une colonie qui a poussé sur plaque est détectable par PCR en temps réel. Avec ce résultat, il est difficile qu’un prélèvement positif pour Gardnerella ne soit pas détecté. La sensibilité pour Trichomonas vaginalis n’a pas pu être effectuée par manque de prélèvements positifs. Une façon de résoudre ce problème aurait été d’obtenir un plasmide contenant la région de l’ADN de T. vaginalis amplifiée par nos amorces. Cependant, le laboratoire MCL n’étant pas équipé pour ce genre d’approche nous avons dû y renoncer. La spécificité de Gardnerella vaginalis a été évaluée par la suite. On a pris 11 patients positifs sur gel et 5 patients négatifs sur gel qu’on a analysé avec la PCR en temps réel. La spécificité trouvée ici est de 83,3 %. Cependant, le nombre de patients testé est certainement trop petit. D’autre part les amorces et les sondes utilisées dans ce travail sont différentes de celles utilisées dans la méthode de détection sur gel. Théoriquement, nous attendons que la spécificité de la méthode que nous avons développée dans ce travail soit supérieure à celle de détection sur gel. Par conséquent, cette spécificité de 83% est à considérer avec circonspection et une validation sur un nombre de prélèvements plus important (~100) doit être considérée. Pour Trichomonas vaginalis, il est plus difficile de trouver des patients positifs. Dans la DNAthèque du laboratoire MCL, aucun Trichomonas positif n’a été trouvé. Pour la spécificité nous avons alors pris 60 sédiments urinaires qui ont été préalablement observés au microscope. Tous étaient négatifs soit au microscope soit par PCR en temps réel. Ceci nous indique une bonne spécificité. Pour l’améliorer, il eût fallut aussi avoir des patients positifs au microscope. 25 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée Dans l’ensemble, nous pouvons valider cette méthode sur le LightCycler 480 puisque sensibilité et spécificité sont correctes. Malheureusement la routine ne s’effectue pas encore sur cet appareil et je n’ai pas eu le temps de faire les tests sur le RotorGene (CorbettResearch). 26 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 6 Conclusion Le but de ce travail est atteint. La méthode de détection par PCR multiplexe de Gardnerella vaginalis et Trichomonas vaginalis a été validée sur le Lightcycler 480 II et cette méthode pourra entrer dans la routine du laboratoire MCL. La sensibilité et la spécificité ont été testées pour les 2 organismes sur le LightCycler 480. Les tests démontrent de très bons résultats. La méthode est validée sur cet appareil. Cette méthode est plus rapide et plus pratique que la méthode utilisée actuellement. Il y a moins d’étapes et elle peut se faire parallèlement à d’autres analyses avec un kit commercial tel celui de Roche/TIBmolbiol pour C. trachomatis et N. gonorrhoeae. 27 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 7 Références bibliographiques Ameziane N., Bogard M., Lamoril J. (2005) Principe de la biologie moléculaire en biologie clinique, Paris : Elsevier Masson, p.251-265 Bernard P., Sharaf M. (2001). Les MST parasitaires [Page Web]. Accès : http://www.syngof.fr/~syngof/pages/fmc/MSTmicrobiennes2.html#01 (page consultee le 10 janvier 2009) Euzéby, J.P. (18 juin 1998). Gardnerella vaginalis, Gardnerella vaginalis like organisms [Page web]. Accès : http://www.bacterio.cict.fr/bacdico/gg/Gardnerella.html (page consultée le 10 janvier 2009) Hardick, J. & al. (2006). Performance of the Gen-Probe Transmission-Mediated Amplification Research Assay Compared to That of a multitarget Real-Time PCR for Mycoplasma Genitalium Detection, Molecular Diagnosis of BV, 33-43 Jaunin, P. (2004). Cours de biologie moléculaire [Polycopié]. Lausanne : Ecole Supérieure de la Santé. LightCycler 480 Instrument Operator’s Manuel, Software Version 1.5 NucliSens easyMAG User Manual, Biomérieux, version 1.0, article number : 280139, chap 1 p.10-11, chap 2 p. 1 à 18 Poitras E., Houde A. (2002). La PCR en temps réel: principes et applications. Reviews in Biology and Biotechnology. 2(2):2-11. Poitras E., Houde A., Ameziane N., Bogard M., Lamoril J. (2002-2006). PCR en temps réel [Page Web]. Accès : http://www.ilm.pf/PCRtempsreel (page consulté le 15 janvier 2009). Schirm J. & al. (2006). Trichomonas vaginalis detection using real-time TaqMan PCR, Journal of Microbiological Methods 68, 243-247 Images : Figure 1 : http://www.cytopathnet.org/show_image.php?id=495&scalesize=0&nocount=y Figure 2 : http://www.k-state.edu/parasitology/625tutorials/FIGvaginalis02.jpg Figure 3 : http://www.ilm.pf/PCRtempsreel Figure 4 : (http://www.ilm.pf/PCRtempsreel) Figure 5 : http://www.bbcorp.co.kr/technote7/data/board/kkkgoods/file_in_body/1/easymag_tiles.jpg 28 Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis ESsanté 48 ème volée 8 Annexes 8.1 Mode opératoire pour Trichomonas vaginalis l’amplification 29 de Gardnerella vaginalis et Sibylle Richoz Travail de diplôme Détection par PCR en temps réel multiplexe de Gardnerella vaginalis et Trichomonas vaginalis 30 ESsanté 48 ème volée