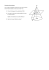3.2.3 Décrire et expliquer la tendance à la périodicité du rayon
Transcription
3.2.3 Décrire et expliquer la tendance à la périodicité du rayon
3.2.3 Décrire et expliquer la tendance à la périodicité du rayon atomique, du rayon ionique, des énergies de première ionisation et de l’électronégativité chez les éléments de la troisième période. (3) Rayon atomique (fig.1) : Distance entre l’électron le plus loin et le noyau. Comme on ne peut pas dire précisément où cet électron est (c’est une probabilité), le rayon atomique est habituellement défini par la moitié de la distance entre les noyaux de deux atomes semblables. Quand on descend dans un groupe, le rayon augmente car les électrons de valences sont dans un niveau d’énergie supérieur, donc + loin du noyau. Quand on avance dans une période, le rayon diminue car les électrons sont ajoutés sur un même niveau d’énergie (niveau 1, 2, 3, 4…), mais la quantité de neutrons et protons augmente. Le dernier niveau d’énergie est donc plus attiré par le noyau. Figure 1. Rayon atomique Rayon ionique (fig. 2) : Rayon d’un ion cation ou anion. Dans les 2 cas, le rayon ionique augmente quand on descend dans le groupe et quand on avance dans la période. Cela est pour les mêmes raisons que le rayon atomique : quand le niveau d’énergie augmente, les électrons de valence sont plus loin du noyau donc le rayon augmente; dans la période, on reste sur le même niveau d’énergie mais la quantité de neutrons et de protons augmente, donc le dernier niveau d’énergie est plus attiré par le noyau. Figure 2. Rayon ionique Cation : contient moins d’électrons que de protons alors le dernier électron de valence est plus attiré au noyau et le rayon ionique est plus petit que le rayon atomique. Il est aussi plus petit car il a un électron de moins. Dans la période, tous les ions ont la même quantité d’électrons, mais de plus en plus de neutrons et protons, donc le rayon ionique diminue. Anion : contient plus d’électrons que de neutrons et protons, est donc plus grand que l’atome parent. Dans la période, le rayon ionique diminue car tous les ions ont la même quantité d’électrons, mais de plus en plus de neutrons et protons, donc le rayon ionique diminue. Énergie de première ionisation (fig. 3): Augmente quand on avance dans une période à mesure que le niveau d’énergie se remplit et que l’atome approche de la stabilité électronique (voir annexe 3.2.1 et notes de cours 3.2.1). Figure 3. Énergie de première ionisation Électronégativité (fig. 4) : Augmente quand on avance dans la 3e période (pour détails voir unité 4.2). Figure 4. Électronégativité RÉSUMÉ Dans la 3e période, lorsqu’on avance vers la gauche : Périodicité de Rayon atomique Rayon ionique Énergie de première ionisation Électronégativité A (augmente), D (diminue) D D A A Sources : Figure 1 : http://www.math.jussieu.fr/~jarraud/campusciences/documents/FSM_c01_strucmat/rpm/c01_c_32ppte_phyki/ Figure 2 : http://bookbuilder.cast.org/view_print.php?book=37167 Figure 3 : http://www.chem1.com/acad/webtext/atoms/atpt-6.html Figure 4 : http://www.math.jussieu.fr/~jarraud/campusciences/documents/FSM_c01_strucmat/rpm/c01_c_32ppte_phyki/