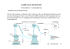ATP – Synthase (F0-F1 – ATP – Synthase)
Transcription
ATP – Synthase (F0-F1 – ATP – Synthase)
Biochemie Seminar ATP – Synthase ATP – Synthase (F0-F1 – ATP – Synthase) ATP: Adenosintriphosphat • Mit 2 energiereichen Phosphorsäureanhydridbindungen • ∆ G0 = - 30,6 kJ/mol • Energieüberträger Bildung von ATP: - Substratkettenphosphorylierung (z.B.: Glykolyse) - Oxidative Phosphorylierung (Elektronentransportkette und ATP-Synthase) Æ Nutzung eines elektrochemischen Gradienten ADP + Pi Æ ATP + H2O Aufbau der ATP – Synthase: F0: • • • • • • F1: • • • • • hydrophob, durchspannt die Membran F0 besteht aus a1b2cn (n =10 - 14) Nutzt Protonenstrom für Rotation a: jeweils halben Protonenkanal, gibt Protonen an c weiter c: bindet Protonen an Asp61 Æ Rotation b2: bildet mit UE a den Stator Hydrophil, ragt in die Matrix Besitzt katalytische Aktivität (β UE) Ist über δ mit dem Stator verbunden γ ist über ε mit c-Ring verbunden (Rotor) γ taucht in Zylinder aus α und β-Heterodimeren ein Bildung von ATP: Elektrochemische Energie Æ mechanische Energie Æ chemische Energie • • • • • durch Protonenrückfluss kommt es zur Rotation des c-Rings und somit der γ UE Asymmetrie der γ UE bewirkt eine Strukturänderung der β UE Die Strukturänderungen beeinflussen die Affinität zu ATP / ADP + Pi. Bildung des ATPs ist spontan Rotationsenergie wird zur Freilassung des ATPs genutzt ´Binding change mechanism´ nach Paul Boyer (Nobelpreis für Chemie 1997) Biochemie Seminar ATP – Synthase Rotationsversuche: • • • • • • • • • • • Rotationsversuche beweisen die Drehung des „Nanomotors“ Links: Rotation eine fluoreszierenden Actinfilaments an γ UE. Mitte: fluoreszierendes Kügelchen Rechts: magnetic bead F1-UE über α mit Histidin-tags an Oberfläche befestigt Komplette ATP-Synthase verwendet Aktinfilament an C-Ring gekoppelt Unter ATP-Verbrauch kommt es zur Rotation des cRings C-Ring an Oberfläche über Histidin-tags befestigt Aktinfilament ist an αUE gekoppelt Unter ATP-Verbrauch kommt es zur Rotation des F1Komplexes Æ in vivo ist die Rotation der γ UE zum F1-Komplex nur relativ anzusehen!!! Literatur: Capaldi, A., Aggeler, R. (2002): Mechanism of the ATP synthase, a biological rotary motor. – TIBS Vol. 27 No. 3; 154 – 159. Weber, J., Senior, A. E. (2003): ATP synthesis driven by proton transport in F1-F0-ATP synthase. – FEBS Letters 545; 61-70. Engelbrecht, S., Junge, W. (1997): ATP synthase: a tentative structural model. – FEBS Letters 414; 485491. Junge, W., Lill, H., Engelbrecht, S. (1997): ATP synthase: an electrochemical transducer with rotatory mechanics. – TIBS Vol. 22; 420 – 423. Abrahams, J. P., Leslie; A.G.W. (1994): Structure at 2.8 Amstrom resolution of ATPase from bovine heart mitochondria. – Nature Vol. 370; 621 – 628. Yoshida, M. (2001): ATP synthase – a marvellous rotary engine of the cell. – Mol. Cell. Biology Vol. 2, 669 – 677. Cross, R. L. (2004): Turning the ATP motor. – Nature Vol. 427; 407 – 408. Sambongi, Y., Ueda, I., Wada, Y., Futai, M. (2000): A Biological Molecular Motor. – Journal of Bioenerg. and Biomembranes Vol. 32; 441 – 448. Itoh, H. et al. (2004): Turning the ATP motor. – Nature Vol. 427; 465 – 468. Lehrbücher: Stryer, Molecular Biology of the cell, Molekulare Zellbiologie