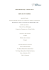Neutralisation CaVa=CbVb
Transcription
Neutralisation CaVa=CbVb
Module 3 École L’Odyssée CH 53411 Neutralisation CaVa=CbVb 1. On neutralise 25ml d'un acide de concentration inconnue avec 45 ml d'une base à 0,6 mol/L. Trouve la concentration de l'acide inconnu. Données: Va = 25ml; Vb= 45 ml et Cb= 0,6mol/L On cherche Ca = ? On part de la formule de base CaVa = CbVb et on isole Ca ce qui donne: C a CbVb Va En remplaçant par les données, on obtient: 2. Si je titre (neutralise) 25,0 ml de HCl avec 19,6 ml de NaOH 0,130 mol/L, quelle est la concentration du HCl ? Puisqu’il s’agit d’un acide fort (pas de Ka) et de base forte (pas de Kb), on peut directement utiliser CaVa=CbVb. Données : Va= 25,0 mL Vb = 19,6 mL Cb = 0,130 mol/L Ca = ? Calcul CaVa =CbVb 25,0 mL Ca = 0,130 19,6 mL Ca= 0,102 mol/L Préparé par Eric Landry : [email protected] neutralisation Module 3 École L’Odyssée CH 53411 3. On utilise une base forte NaOH à 0,2 mol/L pour neutraliser un acide faible et acide fort. a) Il y a 75 mL de l’acide fort est réglé à un pH de 2,7. Combien de NaOH a-t-on besoin pour neutraliser cet acide? Puisqu’il s’agit d’un acide fort (pas de Ka) et de base forte (pas de Kb), on peut directement utiliser CaVa=CbVb. Données : Calcul Va= 75,0 mL Vb = ? Cb = 0,2 mol/L Ca = 10-2,7 CaVa =CbVb 75,0 mL 10-2,7 = 0,2 Vb = 0,74 mL Vb Pour neutraliser l’acide fort, il faut 0,74 mL de la base. b) Il y a 75 mL de l’acide faible a un pH est 2,7 et dont le ka = 1,4x10-4. Combien de base a-t-on besoin pour neutraliser 75 mL de cet acide faible? Données : Ca = [HA]initiale = ? Va = 75 mL Cb = 0,20 mol/L Vb = ? I V É Calcul CaVa =CbVb 75 x 0,012450 Vb= 4,67mL = 0,20 x Vb HA H+ A- x 0 10-2,7 10-2,7 0 10-2,7 10-2,7 10-2,7 x-10-2,7 Préparé par Eric Landry : [email protected] neutralisation Module 3 École L’Odyssée Données : Ca = [HA]initiale = Va = 75 mL Cb = 0,20 mol/L Vb = ? CH 53411 Calcul CaVa =CbVb 75 x 0,03043 = 0,20 x Vb Vb= 11,41 mL Pour neutraliser l’acide faible, il faut 11,41 mL de la base. c) Comment expliques-tu la différence pour neutraliser ces deux acides réglés au même pH ? L’acide faible, qui n’est pas complètement dissocié, va pouvoir continuer à produire des ions H+ lorsque ceux-ci réagissent avec la base (principe de LeChâtelier). De cette façon, il faudra continuer à ajouter de la base jusqu’à l’épuisement de la réserve d’acide faible non-dissocié. L’acide fort, qui est complètement dissocié, ne possède aucune réserve d’acide pouvant se dissocié lors de la diminution de la concentration des ions H+. Préparé par Eric Landry : [email protected] neutralisation