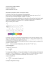L`atome comprend deux parties : un noyau et des électrons en
Transcription
L`atome comprend deux parties : un noyau et des électrons en
L'atome comprend deux parties : un noyau et des électrons en mouvement rapide autour de ce noyau. Le noyau : Il est constitué de protons (leur charge est positive) et de neutrons (leur charge est nulle). Ces particules qui constituent le noyau sont également appelées nucléons. Le cortège électronique : Il est constitué d'électrons (leur charge est négative) qui gravitent autour du noyau. proton (nucléon) neutron (nucléon) électron La masse d'un proton et d'un neutron sont sensiblement égales, par contre la masse de l'électron est environ 2000 fois plus faible. Pour cette raison, on pourra assimiler la masse de l'atome à celle du noyau, la masse des électrons étant négligeable. Dimensions de l'atome Le rayon d'un atome est de l'ordre de 10-10 m. Le rayon du noyau est de l'ordre de 10-15 m. Par conséquent, le rayon du noyau est environ 10 000 fois plus petit ! Les électrons gravitent à une très grande distance du noyau et entre les deux il n'y a que du vide. On dit que l'atome a une structure lacunaire. Représentation symbolique d'un noyau : Le noyau d'un élément quelconque (X) s'écrit à l'aide de Z et A sous la forme suivante : Z le numéro atomique d'un noyau, c'est le nombre de protons qu'il contient. A le nombre de masse d'un noyau, c'est le nombre de nucléons (protons+neutrons) qu'il contient. (N=A-Z) Isotopie Dans la nature, les atomes et ions d'un élément ne possèdent pas forcément la même composition de leur noyau. Ils possèdent bien Z protons (numéro atomique) mais ils peuvent avoir un nombre de neutrons N différent, donc un nombre de masse A différent. Il faut noter qu'un élément chimique est justement défini par son nombre de protons Z. Exemple : pour le carbone, on peut avoir 12 6 C 13 6 C 14 6 C Dans les trois cas on a Z=6 (élément carbone) mais on a A=12 (carbone 12) ou A=13 (carbone 13) ou A=14 (carbone14). On les appelle des isotopes. Voici les atomes des trois isotopes de l'hydrogène : Les isotopes d'un élément sont les atomes ou ions possédant le même numéro atomique Z mais un nombre de masse A différent. Structure électronique des atomes Dans une molécule, les noyaux bougent, mais leur mouvement est beaucoup plus lent que celui des électrons. Ainsi, dans la description de la liaison chimique, on considère les électrons gravitant autour de noyaux fixes, c'est l'approximation Born-Oppenheimer. Plusieurs modèles atomiques ont été proposés pour le système le plus simple: l'atome d'hydrogène (constitué d'un proton et d'un électron). •Modèle de Rutherford L'électron gravite autour du noyau avec une vitesse uniforme en décrivant une orbite circulaire. Ce modèle implique que l'électron se trouve en mouvement dans un champ électromagnétique. Cet électron doit émettre une onde électromagnétique dont la fréquence est fonction de sa vitesse. Il doit rayonner avec une perte d'énergie, ce qui provoque soit un ralentissement du mouvement, soit une diminution du rayon de l'orbite. Dans les deux cas, ce phénomène devrait provoquer une chute de l'électron sur le noyau. Par ailleurs, l'étude des spectres d'émission de l'atome d'hydrogène montra que le rayonnement était discontinu, ce qui amena Bohr à proposer un autre modèle qui tenait compte de ces nouvelles données. •Modèle de Bohr En 1900, Planck a supposé (théorie des quanta) que les systèmes qui émettent un rayonnement le font par saut d'énergie hn (h, la constante de Planck, est la fréquence de la radiation). A partir de cette théorie, Bohr a postulé que: - seules certaines orbites électroniques sont possibles autour du noyau - sur une orbite donnée, l'électron n'émet (ni n'absorbe) aucune radiation - il y a émission ou absorption d'une radiation quand l'électron passe d'une orbite à l'autre Pour calculer les niveaux d'énergie, Bohr admet que l'orbite de l'électron est circulaire et que le moment cinétique angulaire de l'électron sur cette orbite est un multiple entier de h/2p. Comme n est un nombre entier positif, l'électron ne peut se trouver que sur une suite discontinue d'orbites définies par n qui correspond au nombre quantique principal. Le modèle de Bohr donne une représentation presque satisfaisante de l'atome d'hydrogène. Pour n = 1, l'atome se trouve alors dans son état fondamental, sa stabilité est maximale. Le modèle de Bohr recouvre une réalité physique fondamentale mais il ne permet pas d'expliquer tous les résultats expérimentaux. ORBITALE ATOMIQUE Modèle de l’atome issu du développement de la mécanique quantique fondé sur deux principes: - dualité onde / particule (De Broglie): à l’électron de masse m doit être associé une onde de longueur d’onde l = h/mv; v étant la vitesse de l’électron et h la constante de Plank. - Principe d’incertitude d’Heisenberg: il est impossible de déterminer avec précision la position de l’électron et sa quantité de mouvement (donc sa vitesse). L’équation mathématique qui décrit le mouvement de l’électron autour du noyau est l’équation de Schrödinger. Les solutions de cette équation n’existent que pour des valeur quantifiées de l’énergie; elles sont appelées fonctions d’onde ou orbitales atomiques et notées Y(x,y,z). Seul le carré de la fonction d’onde a une signification physique: il exprime la probabilité de trouver l’électron en un point au voisinage du noyau. Par extension, l’orbitale atomique représente un volume à l’intérieur duquel la probabilité de trouver l’électron est d’environ 90%. ORBITALE ATOMIQUE La résolution de l'équation de Schrödinger conduit à l'introduction de 4 nombres quantiques qui interviennent comme paramètres dans les fonctions d'onde. Ces nombres quantiques n, l, m et s caractérisent les mouvements microscopiques de l'électron autour du noyau. Une orbitale atomique est définie par les nombres quantiques n, l et m. Nombre quantique principal: n n peut prendre toutes les valeurs entières positives (n = 1, 2, 3,... ) n est le seul nombre quantique qui influence l'énergie de l'électron dans un atome d'hydrogène (car E ne dépend que de n); n définit une couche électronique ORBITALE ATOMIQUE La résolution de l'équation de Schrödinger conduit à l'introduction de 4 nombres quantiques qui interviennent comme paramètres dans les fonctions d'onde. Ces nombres quantiques n, l, m et s caractérisent les mouvements microscopiques de l'électron autour du noyau. Une orbitale atomique est définie par les nombres quantiques n, l et m. Nombre quantique azimural: l l prend toutes les valeurs entières entre 0 et n-1 (l = 0, 1, 2,...n-2, n-1) l définit la forme et la symétrie des orbitales qui sont nommées par des lettres romaines minuscules l définit une sous-couche électronique l=0 l=1 l=2 l=3 l=4 orbitale s orbitale p orbitale d orbitale f orbitale g n = 3, l = 0 sous-couche 3s n = 3, l = 1 sous-couche 3p n = 3, l = 2 sous-couche 3d ORBITALE ATOMIQUE La résolution de l'équation de Schrödinger conduit à l'introduction de 4 nombres quantiques qui interviennent comme paramètres dans les fonctions d'onde. Ces nombres quantiques n, l, m et s caractérisent les mouvements microscopiques de l'électron autour du noyau. Une orbitale atomique est définie par les nombres quantiques n, l et m. Nombre quantique magnétique: m m peut prendre (2 l+1) valeurs entières comprises entre -l et +l (m=-l, -l+1, …, -1, 0, l, …, l-1, l). m contrôle l'orientation des orbitales dans l'espace. Les 3 orbitales d'une sous-couche p (l = 1) sont dirigées suivant les 3 directions perpendiculaires d'un trièdre trirectangle px, py et pz correspondant aux trois valeurs de m différentes: m = -1, 0, +1. ORBITALE ATOMIQUE La résolution de l'équation de Schrödinger conduit à l'introduction de 4 nombres quantiques qui interviennent comme paramètres dans les fonctions d'onde. Ces nombres quantiques n, l, m et s caractérisent les mouvements microscopiques de l'électron autour du noyau. Une orbitale atomique est définie par les nombres quantiques n, l et m. Nombre quantique de spin : s s détermine le sens de rotation intrinsèque de l'électron sur lui-même. Seuls deux sens sont possibles pour l'électron et s = ± 1/2. s ne dépend pas des coordonnées spatiales des électrons ORBITALE ATOMIQUE Principes permettant de déterminer la configuration electronique d'un atome: - Principe de stabilité: Les orbitales doivent être remplies dans l'ordre croissant de leur niveau énergétique. - Principe d'exclusion de Pauli: Une orbitale ne peut contenir que deux électrons de spins opposés. - Règle de Hund: Toutes les orbitales de même énergie doivent être occupées par un électron avant qu'une de ces orbitales puisse être occupée par un doublet électronique. 6C 2 2 (Z = 6) 1s 2s 2p 8O 2 2p 2p n =2 n =2 2s 2s n=1 1s n=1 1s (Z = 8) 1s2 2s2 2p4 ORBITALE ATOMIQUE Orbitale s: Orbitales p Orbitales d: ORBITALE ATOMIQUE 1 2 H 3 He 4 Li 11 5 Be 12 Na Mg 6 B 13 7 C 14 Al 8 N 15 Si 9 O 16 P 10 F Ne 17 S 18 Cl Ar Période = ligne ; Famille = colonne Lili Bégayait Beaucoup Chez Notre Oncle FerNand Napoléon Mangeât Allègrement Six Poulets Sans Claquer d’Argent HYBRIDATION DES ORBITALES ATOMIQUES Différents états d’hybridation du carbone 2p n =2 2s 6C (Z = 6) 1s2 2s2 2p2 n=1 1s "Etat Hybridé sp" 2p n =2 n =2 n =2 2s n=1 1s "Etat Fondamental" 2p 2p 2s 2s n=1 1s n=1 1s 2 "Etat Hybridé sp " "Etat Excité" 2p n =2 2s n=1 1s 3 "Etat Hybridé sp " FORMATION D’UNE LIAISON COVALENTE De la même manière deux orbitales atomiques peuvent se combiner pour donner deux orbitales moléculaires , l’une liante, de plus basse énergie, l’autre antiliante, deplus haute énergie. FORMATION D’UNE LIAISON COVALENTE Formation d’un liaison s par recouvrement axial de deux orbitales p FORMATION D’UNE LIAISON COVALENTE Formation d’une liaison p par recouvrement latéral d’orbitales p FORMATION D’UNE LIAISON COVALENTE STRUTURE DU FORMALDEHYDE 6C (Z = 6) 1s2 2s2 2p2 Excitation puis Hybridation sp2 2p n =2 n=1 8O Hybridation sp2 (Z = 8) 1s2 2s2 2p4 2p 2s 2s 1s 1s +2xH H π CσO H σ π C sp2 O sp2 FORMATION D’UNE LIAISON COVALENTE STRUCTURE DE L’ACETYLENE