Chromatographie en Phase Gazeuse (CPG)
Transcription
Chromatographie en Phase Gazeuse (CPG)
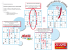
doc from JF Perrin Chromatographie en Phase Gazeuse (CPG) 1. Généralités Les CPG sont des chromatographies analytiques qui se caractérisent par : - La phase mobile est un gaz. - La phase stationnaire peut être : - un solide adsorbant, on parle alors de CPG d'adsorption ou CPG gaz-solide. L'adsorbant le plus utilisé est la silice (adsorbant très polaire). - un liquide imprégnant totalement la surface d'un support devenu inerte, on parle alors de CPG gaz-liquide ou CPG de partage (terme impropre mais très utilisé). La phase stationnaire liquide doit être non volatile dans les conditions de chromatographie pour ne pas s'épuiser au fil des analyses. Ce type de support est en train de disparaître. - un motif chimique déterminé greffé par liaison covalente sur un support devenu inerte (support silice greffé d'un motif organique par exemple), on parle de CPG sur phase greffée. Cette technologie permet une variété de phases stationnaires infinie (toute la gamme des polarités) et une résistance des phases stationnaires très élevée (pas de phénomène d'épuisement de la phase stationnaire par volatilisation). Les gaz utilisés comme phase mobile sont le dihydrogène ou l'hélium ou le diazote ou le dioxyde de carbone. La fonction du gaz phase mobile est d'être le vecteur d'entraînement à travers la colonne des molécules analytes lorsqu'ils se trouvent à l'état gazeux en état de non rétention par la phase stationnaire. La phase mobile se comporte ainsi en gaz vecteur « inerte » (c'est à dire qu'elle n'occasionne aucune interaction avec les analytes à séparer). Remarque : en chromatographie liquide, la phase mobile joue un rôle plus actif puisqu' interviennent des solubilisations des analytes dans la phase mobile et pas seulement des rétentions différentielles par la phase stâtionnaire. De ce point de vue, CPG et CL sont très différentes. Quels sont les facteurs de séparation des analytes en CPG ? Ils sont de deux ordres : 1) la volatilité (il suffira de comparer les valeurs de point d'ébullition des différents analytes à séparer) différente des analytes. La phase mobile est un gaz, elle ne permet donc l'avancement que des analytes qui sont à l'état gazeux à un instant donné. Ainsi, plus un analyte est volatil, plus son élution sera rapide toutes choses étant égales par ailleurs. 2) les interactions (faibles) plus ou moins importantes entre les analytes et la phase stationnaire : - interactions faibles de surface de type adsorption si CPG gaz-solide - solubilisations différentielles dans la phase stationnaire liquide en CPG gaz-liquide - interactions faibles différentielles avec le motif chimique greffé en CPG sur phase On retiendra donc le couple (volatilité de l'analyte, interactions analyte-phase stâtionnaire) comme étant le couple permettant de caractériser le comportement d'un analyte. 2. Les différents types de colonnes On distingue les colonnes remplies classiques et les colonnes capillaires. 2.1. Colonnes remplies : il s'agit de colonnes de métal ou de verre (inerte vis à vis des composants à analyser) de quelques mm de diamètre, de 1 à quelques mètres de longueur (en enroulement spiral). Chaque colonne est remplie du support granuleux désiré : - silice si CPG d'adsorption, par exemple ; - polyethylène glycol imprégnant de la silice en CPG liquide, par exemple. 2.2. Colonnes capillaires : les colonnes se présentent sous forme d'un capillaire dont la surface interne porte un fin film de phase stationnaire. Le diamètre interne est de 0,1 à 0,6 mm ; l'épaisseur de film de Fanny Demay – BTS BioAnalyses & Contrôles 1/4 doc from JF Perrin phase stationnaire est de 0,2 à 0,5 µm ; la longueur dépasse 10 m, atteint généralement 30 m ou plus. La colonne est présentée en un enroulement spiral. Les colonnes capillaires ont aujourd'hui la faveur des analystes et une très très grande variété de phases greffées sont disponibles sur le marché. Les phases greffées utilisent la chimie du greffage covalent d'un motif organique choisi sur une base silice (voir le polycopié HPLC). La construction obéit au schéma : 3. L'échantillon à analyser, l'injection Les analytes doivent absolument être injectés à l'entrée de colonne à l'état de gaz (c'est fondamental !!). C'est pourquoi on injecte l'échantillon dans une chambre d'injection portée à une température telle que la volatilisation des analytes qui vont rentrer dans la colonne soit totale et immédiate. La température de la chambre d'injection est donc, par principe, toujours supérieure à celle de la colonne. (Tout ce qui n'est pas volatilisé dans la chambre d'injection ne rentrera pas dans la colonne). L'analyse CPG exige ainsi que les analytes à séparer dans l'échantillon soient volatilisables à des températures qui ne les dégradent pas. Ceci exclut l'analyse CPG des composés qui sont détruits par les hautes températures avant toute vaporisation. Pour mettre en œuvre une analyse CPG, on procède ainsi : - L'injection est réalisée dans la chambre d'injection-vaporisation en perforant un opercule étanche. La volatilisation de tous les composés à chromatographier doit y être immédiate. D'une façon générale, le volume exact injecté dans la colonne n'est pas exactement connu et l'utilisation d'étalons internes s'impose pour les analyses quantitatives. - Le gaz vecteur qui accède au système via la chambre de vaporisation va faire entrer les analytes (à l'état vapeur) dans la colonne. - L'analyse quantitative exige l'utilisation d'étalon(s) interne(s) (voir chapitre sur les analyses quantitatives en chromatographie). - si l'échantillon contient, en plus des composés volatils à analyser, des composés totalement non volatilisables aux températures de l'analyse, ceux-ci vont se déposer et encrasser la tête de colonne. La colonne va perdre peu à peu ses performances, il faudra en changer ou la nettoyer (certaines colonnes phase greffée sont rincables par des solvants). Une solution usuelle consiste à extraire les analytes volatilisables à chromatographier par un solvant très volatil qui n'extrait pas les substances non volatilisables non désirées. Le solvant d'extraction conduira à un pic solvant puisqu'il sera chromatographie. Lorsque les analytes qu'on désire chromatographier ne sont pas volatilisables (cas des molécules dégradées avant volatilisation ou cas de colonnes ne supportant pas les températures théoriques qui seraient nécessaires), il faut envisager une analyse après dérivation : il s'agit de "transformer" les analytes en dérivés volatilisables stables. Exemples : les oses ne sont pas volatilisables et donc sont a priori non analysables en CPG. Cependant, les oses peuvent être réduits en leurs polyols correspondants puis acétylés. Les dérivés ainsi obtenus sont volatilisables, analysables en CPG. La méthylation des acides gras à longues chaînes les rend volatils et facilement analysables en CPG. Fanny Demay – BTS BioAnalyses & Contrôles 2/4 doc from JF Perrin 4. Température de colonne La colonne d'analyse est placée dans un four dont la température doit être parfaitement réglée. En effet tout changement de température se traduit par la modification de la pression de vapeur saturante des analytes et modifie ainsi leur temps de sortie. Toute élévation de la température se traduira par des temps de sortie plus courts (on favorise l'état gazeux, l'entraînement par la phase mobile). En s'exprimant avec un vocabulaire de chromatographie liquide, on peut dire qu'augmenter la température en CPG, c'est augmenter la force d'élution de la phase mobile. Dans certaines analyses (rarissime aujourd'hui), on travaille en technique isotherme : la température de la colonne est la même pendant toute l'analyse (équivalent à l'analyse isocratique en chromatographie liquide). Pour des analyses complexes, pour des échantillons comportant des analytes aux températures d'ébullition très différentes et/ou aux interactions avec la phase stationnaire très différentes, il n'est pas possible d'obtenir une séparation convenable en technique isotherme (pics de tête non séparées ou pics de queue qui traînent trop). On travaille alors en gradient de température (équivalent à travailler en gradient de force éluante de phase mobile en chromatographie liquide). On augmente la température (le pouvoir éluant) au fur et à mesure de l'analyse. 5. Détecteurs On peut disposer : - d'une analyse par spectrométrie de masse couplée à la sortie de colonne. On peut ainsi identifier chimiquement les analytes élues. Les équipement sont aujourd'hui très populaires car à des prix relativement accessibles et d'emploi assez simple. Il n'est pas possible d'expliquer en quelques lignes le couplage CPG-spectrométrie de masse et ce polycopié renvoie le lecteur - ce sujet - à des ouvrages spécialisés. - de détecteurs simples et quasi universels comme le catharomètre, le détecteur à ionisation de flamme (FID), le détecteur à capture d'électrons. Ces détecteur « signalent » la sortie des analytes de la colonne mais n'en révèlent aucune propriété chimique. 5.1. Catharomètre (détecteur à conductivité thermique) (très peu utilisé de nos jours) Deux propriétés fondent le principe de ce détecteur : - la température prise par un fil métallique chauffé électriquement dépend de la conductivité thermique du gaz qui l'entoure ; - la résistance électrique d'un conducteur varie avec la température. Fanny Demay – BTS BioAnalyses & Contrôles 3/4 doc from JF Perrin Le pont de Weahstone schématisé à droite est placé à une température assez élevée pour que tous les analytes élues soient l'état de gaz. Il est équilibré au départ lorsque la cellule de référence et la cellule de mesure sont traversées par le gaz vecteur (réglage de zéro en contrôlant R1 et R2). Lorsqu'un analyte sort de la colonne et arrive dans la cellule de mesure, sa présence modifie la conductivité thermique de l'atmosphère de celle-ci. Selon ce qui a été décrit ci-avant, le pont de Weahstone se retrouve en déséquilibre et un courant électrique est mesurable par le microampèremètre mA Le déséquilibre est amplifié et enregistré sous forme d'un signal s de tension électrique. Ainsi, chaque analyte donne un pic d'élution ou la relation surface de pic = coefficient X quantité d'analyte est applicable (voir chapitre analyse quantitative et chromatographie). 5.2. Le détecteur à ionisation de flamme (FID) (très utilisé) Dans une flamme dihydrogène/dioxygène, la combustion de tout composé organique conduit à du CO 2 et à des sous produits ionisés. Un FID mesure les ions de combustion sous forme d'un courant électrique grâce à la polarisation du brûleur. Ainsi, chaque analyte donne un pic d'élution ou la relation surface de pic = coefficient X quantité d'analyte est applicable (voir chapitre analyse quantitative et chromatographie). Remarque : – H2O (pas de combustion évidemment), CS2 et HCOOH ne sont pas détectés ; – L'ensemble de détection est inclus dans un bloc réglé en température (en général 250°C). Le FID est un détecteur plus sensible que le catharomètre. 5.3. Détecteur à capture d'électrons Dans un détecteur à capture d'électrons, une source radioactive ionisante β (on utilise du tritium ou du 63 Ni) émet des électrons libres β dans une chambre d'ionisation et les électrons réagissent avec les molécules d'analytes qui atteignent la chambre. 6. Bibliographie Méthodes instrumentales d'analyse chimique et applications, méthodes chromatographiques, électrophorèses et méthodes spectrales ; G. Burgot et J.L. Burgot ; Tec&Doc Lavoisier 2002 Daniel C. Harris, Quantitative chemical anarysis, 6° édition, Freeman and Company, 2003. M.-L. Garrigues , M. Veron, Apport de la chromatographie gaz-liquide au diagnostic microbiologique, Ann Biol. Clin.,1987. 45, 135-143. Analysing fatty acids by capillary column gas chromatography, GC Bulletin 855, Supelco 1990. Fanny Demay – BTS BioAnalyses & Contrôles 4/4