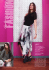Syndrome DRESS (Drug Rash with Eosinophilia and Systemic Symptoms
Transcription
Syndrome DRESS (Drug Rash with Eosinophilia and Systemic Symptoms
curriculum Syndrome DRESS (Drug Rash with Eosinophilia and Systemic Symptoms) Une allergie médicamenteuse grave souvent méconnue Werner J. Pichlera, Thomas Wendlandb, Oliver Hausmanna, Benno Schnydera, Michael Frickera, Christiane Pichlera, Arthur Helblinga Quintessence P Les allergies médicamenteuses imitent fréquemment d’autres mala dies, détrônant désormais la syphilis à cet égard, ce qui vaut particulière ment pour le syndrome d’hypersensibilité médicamenteuse (Drug Rash with Eosinophilia and Systemic Symptoms, DRESS). Difficile à diagnosti quer, ce syndrome compte parmi les allergies médicamenteuses les plus dangereuses. Souvent, il survient uniquement après 2–12 semaines de traitement. Il se manifeste la plupart du temps par des symptômes cuta nés et une hépatite, mais peut également donner lieu à une cardite, à une néphrite, à une pneumopathie et à une colite. Le syndrome DRESS peut persister durant des semaines malgré l’arrêt du traitement causal. P Mis à part les antiépileptiques (carbamazépine, lamotrigine et phény toïne), les sulfamides (sulfasalazine, dapsone et sulfaméthoxazole) ainsi que l’allopurinol, la minocycline et les médicaments antiVIH (névirapine, abacavir) sont des déclencheurs potentiels. P Le syndrome DRESS est associé à une mortalité d’env. 10%. La détec tion précoce du syndrome, l’arrêt immédiat des médicaments en cause et la nonprise d’autres médicaments sont d’une importance vitale. P Déstabilisantes, les réactions de type flare-up (par ex. exacerbations d’une hépatite) peuvent survenir par la suite, malgré l’évitement de l’agent déclenchant. Elles peuvent être déclenchées d’une part par une réactivation de virus herpétiques et d’autre part, par d’autres médica ments pris au cours de la phase de stimulation immunitaire massive. Introduction Werner J. Pichler Les auteurs n’ont pas déclaré des obligations financières ou personnelles en rapport avec l’article soumis. Le syndrome DRESS (Drug Rash with Eosinophilia and Systemic Symptoms), également appelé DiHS (Drug-induced Hypersensitivity Syndrome), est une affection systémique qui peut être déclenchée par une réaction immunologique à certains médicaments [1–4]. Il en ré sulte une réaction inflammatoire souvent éosinophile au niveau de différents organes. Etant donné que les symptômes initiaux (fièvre, exanthème, gonflement des ganglions lymphatiques, hépatite) sont évocateurs de maladies virales ou de maladies autoimmunes graves, qu’ils ne surviennent souvent qu’après plusieurs se maines d’un traitement d’abord bien toléré et que le syndrome est rare (probablement env. 150–200 cas par an en Suisse), la pose du diagnostic correct est retardée dans bon nombre de cas. La complexité de ce syndrome se reflète également dans les nombreuses dénominations qui lui sont don nées. Initialement appelé Drug Hypersensitivity Syndrome (DHS), il a par la suite été nommé DRESS; des chercheurs japonais l’ont appelé Drug-induced Hypersensitivity Syndrome (DiHS), alors que d’autres scienti fiques parlent de Anticonvulsant Hypersensitivity Syndrome (tab. 1 p) [1–6]. Dans cet article, nous le désignerons par DRESS, bien que ce nom soit à juste titre controversé car une éosinophilie, l’un des symp tômes clés, est uniquement présente dans env. 70% des cas et ne s’observe guère avec certains médicaments (lamotrigine, abacavir). D’un autre côté, l’éosinophilie parfois massive est un symptôme très distinctif, qui est utile pour faire la différence entre un syndrome DRESS et d’autres maladies. Le syndrome DRESS est uniquement déclenché par un nombre relativement faible de médicaments (tab. 2 p), parmi lesquels les anticonvulsivants (phénytoïne, carbamazépine, lamotrigine), les sulfamides comme la dapsone, la sulfasalazine (en raison de son composant sulfapyridine) et le sulfaméthoxazole, ainsi que l’allo purinol, la minocycline, l’abacavir et la névirapine. Evolution clinique Le plus souvent, le syndrome DRESS se manifeste uni quement après une période de traitement de 2 à 12 se maines. Les symptômes font généralement leur appari tion après une augmentation posologique. Le tableau clinique peut débuter par des symptômes «grippaux» comme des malaises et de la fièvre, ainsi que par un exanthème maculeux non papuleux très chaud, le plus souvent au niveau des jambes et du tronc (fig. 1 x) [1, 2, 7, 8]. Des démangeaisons sont possibles mais pas obligatoires. Au cours des premiers jours, de rares pa tients présentent des lésions cutanées pustuleuses, qui font penser à une pustulose exanthématique aiguë géné ralisée (PEAG); chez env. 1–2% des patients, des lésions bulleuses apparaissent au niveau de la peau et des muqueuses, tout comme dans le syndrome de Stevens Johnson. La fièvre, l’exanthème, l’épuisement et l’hé patite font d’abord penser à une cause virale ou infec tieuse (tab. 3 p). La présence de lymphocytes activés («virocytes») cadre avec une infection herpétique géné ralisée, mais la sérologie herpétique au début de la maladie n’est pas probante pour une primoinfection Inselspital, Universität Bern a Allergologie, Klinik für Rheumatologie, klinische Immunologie und Allergologie b Klinik für Innere Medizin Forum Med Suisse 2011;11(48):879–884 879 curriculum En fonction du médicament déclencheur, différentes at teintes organiques sont possibles (tab. 4, 5 p): il s’agit typiquement d’une hépatite, d’une néphrite, d’une pneumopathie ou d’une lymphadénopathie générali sée; une cardite s’observe parfois [8] et plus rarement, une colite ou une pancréatite. Sur le plan clinique, le syndrome DRESS se manifeste typiquement par un œdème de la face, qui reflète probablement une per méabilité vasculaire accrue: le syndrome DRESS peut même donner lieu à un œdème pulmonaire, comme c’est le cas dans le syndrome de fuite capillaire consé cutif à un traitement par IL2 à dose élevée. Tableau 1. Dénominations du syndrome DRESS. Anticonvulsant Hypersensitivity Syndrome (Carbamazepin-, Phenytoin-induced hypersensitivity syndrome, etc.) Drug Hypersensitivity Syndrome (DHS) Drug-induced Hypersensitivity Syndrome (DiHS) Drug Rash with Eosinophilia and Systemic Symptoms (DRESS) Drug-induced Delayed Multiorgan Hypersensitivity Syndrome (DIDMOHS) Tableau 2. Médicaments susceptibles de déclencher un syndrome DRESS. Anticonvulsivants Difficultés du diagnostic et du diagnostic différentiel Carbamazepin Phénytoïne Phénobarbital Zonisamide Lamotrigine§ Allopurinol Minocycline Dapsone Sulfasalazine Sulfaméthoxazole Mexilétine Abacavir§ Névirapine Rarement*: quinolone, gabapentine, clindamycine, vancomycine § Souvent sans éosinophilie. * Sur la base de nos propres observations. ou une réactivation virale. Contrairement aux maladies infectieuses, le syndrome DRESS est en plus souvent as socié à une éosinophilie marquée >1,0 G/l, qui n’est pas retrouvée en cas de mononucléose infectieuse ou d’in fection aiguë par le VIH. Il arrive également que l’éosi nophilie ne survienne qu’après 2–3 jours. A La majorité des patients présentant un syndrome DRESS ne sont initialement pas correctement diagnos tiqués; une maladie iatrogène n’est le plus souvent pas soupçonnée (tab. 3). Pourtant, la combinaison de symp tômes cutanés et d’atteintes organiques, accompagnée dans bon nombre de cas d’une éosinophilie importante avec des signes de stimulation immunitaire massive dans le sang («lymphocytes activés»), est assez spéci fique: en cas de prise au cours des 12 dernières se maines d’un médicament connu pour déclencher un syndrome DRESS (tab. 2), ces symptômes devraient toujours faire envisager un syndrome DRESS lors du diagnostic différentiel (tab. 4, 5). La pose du diagnostic d’un syndrome DRESS a d’énormes implications pour l’évolution ultérieure – une négligence ou un retard de diagnostic peuvent être fatals! Les symptômes initiaux et l’évolution ultérieure du syn drome DRESS se distinguent des allergies médica menteuses courantes par les points suivants: – Importante sensation de maladie avec fièvre et ma laise. Les patients touchés se sentent très malades (fièvre, malaise), ce qui est totalement à l’opposé d’un exanthème «banal» avec atteintes organiques B Figure 1 Patiente de 20 ans présentant un syndrome DRESS aigu suite à la prise de gabapentine (ce qui a été confirmé par un test cutané positif et un test de stimulation lymphocytaire positif). A: Œdème de la main, B: Erythème diffus avec gonflement des jambes. La patiente a également présenté un œdème de la face avec sécrétion de lymphe. Dans le sang, «orage cytokinique» massif (IL-5, IL-2). Forum Med Suisse 2011;11(48):879–884 880 curriculum Tableau 3. Diagnostic différentiel du syndrome DRESS (d’après [12]). – Mononucléose infectieuse Infection virale ou bactérienne généralisée Maladie de Kawasaki – Syndrome de choc toxique staphylococcique Syndrome hyperéosinophilique Pseudo-lymphome/lymphadénopathie angio-immunoblastique – Maladie sérique Lupus érythémateux médicamenteux Rougeole Syndrome de libération de cytokines induit par des anticorps Tableau 4. Atteintes organiques en cas de syndrome DRESS (d’après [1, 7, 8]). Hépatite – Myocardite Néphrite interstitielle Pneumopathie interstitielle/syndrome de détresse respiratoire Thyroïdite Inflammation des séreuses Colite/hémorragies intestinales/réactivations du CMV Diabète sucré Encéphalite/méningite aseptique Syndrome de sécrétion inappropriée d’hormone antidiurétique (SIADH) minimes; la mortalité s’élève à env. 10% et elle est principalement imputable à la survenue d’une hépa tite fulminante et d’une insuffisance hépatique. Typiquement, les symptômes d’hypersensibilité ne sont pas provoqués par les antibiotiques bêtalacta mines. Régression lente des symptômes, s’étalant sur plu sieurs semaines. Même après l’arrêt du médicament déclencheur, les symptômes ne s’améliorent que len tement – sur plusieurs semaines à plusieurs mois. Une certaine intolérance à d’autres médicaments persiste souvent durant des semaines. L’instaura tion d’un nouveau médicament peut être à l’origine d’une exacerbation des symptômes (aggravation de la fièvre, de l’hépatite ou de l’exanthème). Il est question de réaction de flare-up, c.àd. que le sys tème immunitaire hyperréactif, comme c’est le cas chez les patients atteints d’un syndrome DRESS, peut facilement être réactivé par d’autres médica ments [9]. Une réactivation de virus herpétiques endogènes présents à l’état latent s’observe fréquemment 2 à 3 semaines après le début de la maladie [4, 10, 11]. A partir de la 2e ou de la 3e semaine après le début des symptômes, il est possible de mettre en évidence l’ADN du virus de l’herpès ainsi que des anticorps IgM dirigés contre le HHV6, et parfois également contre le CMV ou le EBV [10, 11]. Ces réactivations s’accompagnent souvent d’une exacerbation transi toire de l’hépatite avec une élévation des transami nases, même lorsque le médicament causal n’est plus administré depuis des semaines. Tableau 5. Principales caractéristiques du syndrome DRESS. 2–12 semaines après le début d’un traitement: exanthème, fièvre, œdème de la face, malaise, hépatite, gonflement des ganglions lymphatiques; occasionnellement, cardite, colite, pneumopathie, néphrite, pancréatite, encéphalite Lymphocytes activés* Eosinophilie (généralement >1,0 G/l) Fréquence: en cas de traitement antiépileptique, 1:1000 à 1:10 000 Evolution longue, avec une hypersensibilité prolongée (= poussées de symptômes) à différents autres médicaments, tant que des lymphocytes T activés sont détectables Réactivation de virus herpétiques (avant tout HHV-6, CMV), généralement au cours de la 3e semaine après le début des symptômes Mortalité d’env. 10% (transplantation hépatique!) * Correspondant aux «virocytes» dans la mononucléose infectieuse. Tableau 6. Critères diagnostiques. DRESS DiHS Bocquet et al. [3] 1. Exanthème 2. Particularités hématologiques telles qu’éosinophilie (>1,5× 109/l) ou présence de «lymphocytes atypiques» et 3. Affection systémique avec lymphadénopathie (>2 cm de diamètre), hépatite (transaminases >2 fois supérieures à la normale), néphrite interstitielle, pneumonie interstitielle ou cardite Shiohara T et al. [4] 1. Exanthème maculo-papuleux, qui se développe >3 semaines après le début d’un traitement par certains médicaments 2. Symptômes cliniques persistant 2 semaines après l’arrêt du médicament déclenchant 3. Fièvre >38 ºC 4. Troubles de la fonction hépatique (ALAT >100 U/l) 5. Anomalies leucocytaires: leucocytose (>11× 109/l), lymphocytose atypique (>5%) et/ou éosinophilie (>1,5× 109/l) 6. Lymphadénopathie 7. Réactivation HHV-6 5 des 7 critères remplis: DiHS probable ou atypique Forum Med Suisse 2011;11(48):879–884 881 curriculum – Autres allergies médicamenteuses: bon nombre de patients avec syndrome DRESS développent en plus de «véritables» allergies à d’autres médicaments, qui sont administrés simultanément ou ultérieure ment [12]. Le syndrome DRESS peut également survenir chez les enfants et les adolescents; l’hépatite induite par lamo trigine est une complication redoutée chez les enfants épileptiques [13]. Pour ces raisons et pour d’autres raisons qui seront ex pliquées par la suite, le syndrome DRESS représente un cassetête diagnostique dans la pratique clinique quoti dienne. Il peut être difficile à accepter pour les méde cins traitants qu’ils sont confrontés à une maladie iatro gène et que les symptômes aigus et évolutifs puissent être dus à un médicament nécessaire, et non pas à une infection. Dans la mesure où de nombreux patients pré sentent en plus bel et bien une infection, l’interruption du traitement antibactérien tarde souvent à intervenir. En cas de nouvelle poussée d’hépatite (en raison d’une réactivation du virus de l’herpès) après l’arrêt du médi cament, les doutes concernant le diagnostic se trouvent renforcés. Il convient de garder à l’esprit que les éléva tions de la protéine Créactive (CRP) n’ont qu’une faible valeur dans le diagnostic différentiel. Nous avons en ef fet été confrontés à des syndromes DRESS massifs avec des valeurs maximales de CRP de seulement 12 mg/ml, alors que dans d’autres cas, les élévations de la CRP étaient plus importantes. Par conséquent, la pose du diagnostic d’un syndrome DRESS nécessite des connaissances et un grand pou voir de persuasion, car les conséquences sont de longue portée: renoncer à des antibiotiques dans des situations où le pronostic vital est souvent déjà menacé et initier de la prednisone à dose élevée malgré les complications potentielles sont contraires aux principes de traitement généralement admis et en assumer la responsabilité nécessite du courage. A vrai dire, il est uniquement pos sible de diagnostiquer des syndromes DRESS compli qués en possédant une certaine expérience et il est dif ficile d’acquérir cette expérience étant donné que le syndrome DRESS est rare. Comme après des analyses intensives et répétées, certaines cultures sanguines peuvent finalement quand même se révéler positives, une antibiothérapie est parfois débutée: les conséquences peuvent être fatales. Ainsi, il y a peu, nous avons été confrontés à une hépatite fulminante qui s’est soldée par une insuffisance hépatique fatale dans le cadre d’un syndrome DRESS induit par la sulfasalazine; un traite ment par vancomycine avait été initié «par mesure de précaution» sur la base d’une seule culture sanguine positive (Staphylococcus epidermidis) [9]. Le tableau 6 p présente des critères diagnostiques du syndrome DRESS proposés par des experts français et japonais. Une différence frappante entre les deux défi nitions réside dans l’hétérogénéité de l’évolution, la dé finition japonaise mettant l’accent sur les réactivations herpétiques. Cet aspect est controversé. Nous estimons que les réactivations herpétiques sont un phénomène secondaire, qui peut compliquer l’évolution et non constituer une explication initiale. La plupart du temps, ces réactivations n’ont pas de conséquences thérapeu tiques dans la mesure où elles sont rarement à l’origine de complications nécessitant un traitement [8]. La colite à CMV constitue une exception. Pathogenèse Les patients avec syndrome DRESS présentent une forte réaction immunitaire médiée par les lymphocytes T. Lorsqu’ils ne sont pas stimulés, les lymphocytes activés ne sont généralement pas détectables. L’hémogramme peut révéler un nombre élevé de lymphocytes activés («virocytes») en cas de mononucléose infectieuse ou d’infection aiguë par le VIH, mais également dans des situations de stimulation immunitaire généralisée mas sive, comme dans le syndrome DRESS. Une partie des lymphocytes T activés réagissent spécifiquement au médicament ou aux métabolites du médicament causal. Ainsi, les patients ayant un syndrome DRESS ont éga lement tendance à développer des réactions immuni taires contre d’autres médicaments, qu’ils prennent parallèlement au médicament déclencheur du syn drome DRESS ou ultérieurement (Multiple Drug Hypersensitivity Syndrome) [12]. Il n’est pas clair si les lym phocytes T spécifiques des médicaments réagissent aussi contre des peptides des virus herpétiques [14]. Les lymphocytes T réactifs sont cytotoxiques et ils peuvent détruire directement des kératinocytes mais également des hépatocytes [15, 16]. Ils sécrètent des quantités élevées d’IFNg, d’IL5, d’IL2 et d’autres cyto kines, qui sont également détectables en grandes quan tités dans le sérum, comme c’est le cas dans l’«orage cytokinique» rapporté suite à l’administration de l’anti corps antiCD28 «TGN1412» [17]. En effet, certains symptômes du syndrome DRESS font penser à cet effet indésirable grave [18] et le syndrome de fuite capillaire est lui aussi associé à des taux élevés d’IL2 [19]. Aspects génétiques Les allergies médicamenteuses graves sont des exemples types de la médecine personnalisée. Le syn drome d’hypersensibilité induit par l’abacavir survient uniquement chez les sujets porteurs de l’allèle HLA B*5701 [20], alors que le syndrome DRESS (tout comme le syndrome de StevensJohnson) consécutif à l’admi nistration de carbamazépine s’observe préférentielle ment chez les sujets chinois porteurs de l’allèle HLA B*1502 [21]. Les deux déterminations HLA sont déjà réalisées avant l’initiation d’un traitement et elles ont permis de rendre quasiment nulle l’incidence de cet ef fet indésirable. L’allèle HLAB*1502 se rencontre très rarement chez les sujets caucasiens. L’allèle HLA A*3101 a été identifié comme un allèle exposant à un risque d’effets indésirables DRESS à type de manifesta tions bulleuses après l’administration de carbamazé pine, mais cet allèle a uniquement été détecté chez 60– 70% des personnes touchées [22]. Le syndrome d’hypersensibilité induit par l’allopurinol est lui aussi associé au système HLA (env. 60% des sujets touchés Forum Med Suisse 2011;11(48):879–884 882 curriculum sont porteurs de l’allèle HLAB*5801) [23]. De récentes recherches de notre groupe de travail ont montré que ces allèles HLA fixaient bien le médicament. Ainsi, ces complexes HLAmédicament deviennent particulière ment immunogènes et ils provoquent une réaction mas sive des lymphocytes T dans différents organes [24]. Identification des médicaments déclenchants Le syndrome DRESS est un tableau clinique grave et une évaluation allergologique du patient souvent in quiet est nécessaire et indiquée. L’évaluation a pour but de prouver l’allergie médicamenteuse et d’éclairer le patient et le médecin traitant concernant le traitement. Il convient de remettre au patient un passeport d’aller gie et de l’informer au sujet des réactions croisées. Nos expériences confirment que l’allergie médicamenteuse peut persister durant des décennies. Les tests épicutanés et cutanés avec le médicament dé clenchant sont souvent positifs. Lors des tests cutanés, un exanthème généralisé, généralement léger et transi toire, peut survenir en l’espace de 30 min à plusieurs heures, ce qui reflète clairement la réactivité massive des lymphocytes T chez ces patients, provoquant une réaction systémique même après l’exposition à de faibles quantités de médicament. Pour cette raison, cer tains auteurs déconseillent les tests cutanés. Le test de transformation lymphocytaire (TTL) possède une excellente sensibilité et spécificité (>90%) pour les antiépileptiques [15, 16]. Le TTL est aussi le plus sou vent positif pour d’autres médicaments déclencheurs d’un syndrome DRESS. Traitement En premier lieu, il convient de ne plus administrer le médicament déclenchant. Par ailleurs, comme il s’agit d’une affection multisystémique, il faut rechercher une atteinte des organes internes (cœur, reins, poumons, pancréas) au moyen de tests biochimiques ou d’exa mens d’imagerie médicale. En fonction du degré d’at teinte des organes ou en cas d’élévation des ALAT ou des ASAT (valeurs >500 UI/l), il est recommandé d’ini tier des corticoïdes systémiques (0,5–1,0 mg/kg de poids corporel). Dans la majorité des cas, l’évolution est favorable, même si elle est longue, s’étalant sur plu sieurs semaines. Une surveillance étroite des organes touchés, des valeurs hépatiques et de l’éosinophilie dans le sang périphérique doit permettre de prévenir les exacerbations. Durant la phase de stimulation immunitaire maximale, l’utilisation d’autres médicaments devrait être réduite au minimum. Cette stimulation immunitaire se reflète dans le nombre élevé de lymphocytes activés à l’hémo gramme, qui peut dès lors être utilisé comme para mètre d’évolution de la maladie. En se basant sur notre expérience et sur nos réflexions (il n’existe pas d’études à ce sujet), nous recommandons, si possible, de faire une pause thérapeutique en cas de syndrome DRESS aigu. D’après notre expérience, les médicaments qui, dans l’absolu, déclenchent très rarement des allergies, comme les antihypertenseurs, les anticoagulants, la vi tamine K (Konakion®) ou les benzodiazépines, sont éga lement tolérés durant la phase aiguë. Pour faire baisser la fièvre, il faudrait préférer les compresses au paracé tamol ou aux AINS – nous avons assisté à des exacerba tions des symptômes même sous paracétamol. En cas de syndrome DRESS induit par un antiépilep tique et de nécessité de poursuivre un traitement anti épileptique, il convient de ne pas administrer les autres antiépileptiques connus pour déclencher un syndrome DRESS, à savoir phénytoïne, carbamazépine, oxcarba mazépine, lamotrigine et phénobarbital. D’après notre expérience, le valproate et les benzodiazépines sont gé néralement tolérés. Quant aux antibiotiques, nous re commandons de ne pas les administrer à titre «prophy lactique» et si possible, de faire une pause (d’au moins 3–4 jours), afin que l’activation du système immunitaire puisse régresser. Si une antibiothérapie est nécessaire, nous préconisons plutôt les bêtalactamines, car elles ne déclenchent guère de syndrome DRESS. Un exan thème peut néanmoins survenir sous traitement par bêtalactamine, mais il ne s’accompagne généralement pas d’atteinte interne. En revanche, en cas de syn drome DRESS aigu, il convient d’éviter la vancomycine [9] et nous sommes également réticents visàvis des sulfamides et des quinolones, car ces substances peuvent éventuellement déclencher un syndrome DRESS. Il n’est pas clair si la clindamycine et la cla rithromycine sont des déclencheurs potentiels d’un syndrome DRESS. L’administration d’un virostatique (ganciclovir) est absolument indiquée en cas de symp tômes cliniquement pertinents liés au CMV (par ex. co lite à CMV) et ce traitement est apparemment toléré. En règle générale, les corticoïdes sont également tolé rés et l’activation des virus herpétiques en cas de syn drome DRESS n’est pas considérée comme une contre indication à la poursuite d’une corticothérapie. Il est également possible d’initier des corticoïdes afin de ca naliser dans une certaine mesure le système immuni taire suractivé en vue d’améliorer la tolérance d’un autre médicament. Il peut également être pertinent d’administrer un nouveau médicament en augmentant progressivement les doses, car il est clairement établi que les symptômes survenant dans le cadre du syn drome DRESS sont dosedépendants. Par ailleurs, des immunoglobulines intraveineuses ont été initiées avec succès dans différentes études de cas; une expérience moindre est disponible pour les autres médicaments immunosuppresseurs [7]. Dès que le nombre de lymphocytes activés dans le sang périphérique diminue ou qu’ils disparaissent complète ment (souvent uniquement des semaines voire des mois après le syndrome DRESS aigu), les médicaments peuvent à nouveau être administrés «normalement». Pourtant, sur sept patients évalués présentant une multiple drug allergy, c.àd. développement de plusieurs allergies à des médicaments structurellement diffé rents, cinq ont développé un syndrome DRESS comme première manifestation de leur allergie médicamen teuse (certains il y a peu, d’autres il y a plusieurs an Forum Med Suisse 2011;11(48):879–884 883 curriculum nées), laissant supposer une propension accrue aux al lergies médicamenteuses chez les patients avec syndrome DRESS [12]. Le syndrome DRESS n’est pas uniquement déstabili sant en raison des multiples dénominations qui lui sont données. Il est associé à une mortalité d’env. 10% (le plus souvent en raison d’une insuffisance hépatique) et il devrait être connu comme une maladie iatrogène par chaque médecin. Il est essentiel de connaître les quelques médicaments susceptibles de déclencher un syndrome DRESS et d’y penser en présence de tableaux cliniques énigmatiques: il n’est pas rare que la suspi cion d’un effet indésirable médicamenteux se révèle être exacte! Correspondance: Prof. Werner J. Pichler Klinik für Rheumatologie und klinische Immunologie/Allergologie Inselspital, Universität Bern CH-3010 Bern werner.pichler[at]insel.ch Références recommandées – Knowles SR, Shapiro LE, Shear NH. Anticonvulsant hypersensitivity syndrome: incidence, prevention and management. Drug Saf. 1999;21(6):489–501. – Peyrière H, Dereure O, Breton P, et al. Variability in the clinical pat tern of cutaneous sideeffects of drugs with systemic symptoms: does a DRESS syndrome really exist? Br J Dermatol. 2006;155(2):422–8. – Ben m’rad M, LeclercMercier S, Blanche P, Franck N, Rozenberg F, Fulla Y, et al. Druginduced hypersensitivity syndrome: clinical and biologic disease patterns in 24 patients. Medicine (Baltimore). 2009; 88(3):131–40. – Mennicke M, Zawodniak A, Keller M, Wilkens L, Yawalkar N, Stickel F, et al. Fulminant Liver Failure after Vancomycin in a Sulfasalazine Induced DRESS Syndrome: Fatal Recurrence after Liver Transplanta tion: Am J Transplantation. 2009;9(9):2197–202. – Descamps V, Bouscarat F, Laglenne S, et al. Human herpesvirus 6 in fection associated with anticonvulsant hypersensitivity syndrome and reactive haemophagocytic syndrome. Br J Dermatol. 1997;137(4): 605–8. Vous trouverez la liste complète et numérotée des références dans la version en ligne de cet article sous www.medicalforum.ch. CME www.smf-cme.ch 1. Lequel des médicaments suivants ne déclenche pas de syndrome DRESS? A Carbamazépine. B Névirapine. C Sulfasalazine. D Amoxicilline. E Phénytoïne. 2. Quels symptômes ou quelles anomalies de labora toire ne sont pas typiques d’un syndrome DRESS? A Sérologie herpétique/PCR quantitative positive au dé but de maladie. B Réactivations de virus herpétiques (sérologie IgM/PCR quantitative) env. 3 semaines après le début des symp tômes. C Eosinophilie. D Intolérance à d’autres médicaments persistant durant des semaines. E Fièvre et hépatite. 3. Lequel des critères suivants est presque toujours pré sent en cas de syndrome DRESS? A Eosinophilie prononcée (>1,0 G/l). B Elévation de la CRP (>30 mg/l). C Elévation des lymphocytes activés circulants («viro cytes»). D Titre élevé d’IgM ou charge virale élevée (PCR quan titative pour les virus herpétiques) au début de la maladie. E Régression rapide des symptômes après l’arrêt du traitement causal. Forum Med Suisse 2011;11(48):879–884 884 DRESS (Drug Rash with Eosinophilia and Systemic Symptoms / Syndrome DRESS (Drug Rash with Eosinophilia and Systemic Symptoms) Literatur (Online-Version) / Références (online version) 1. Knowles SR, Shapiro LE, Shear NH. Anticonvulsant hypersensitivity syndrome: incidence, prevention and management. Drug Saf 1999; 21(6):489-501. 2. Sullivan JR, Shear NH. The drug hypersensitivity syndrome: what is the pathogenesis? Arch Dermatol 2001; 137(3):357-64. 3. Bocquet H, Martine B, Roujeau JC. Drug-induced pseudolymphoma and drug hypersensitivity syndrome (drug rash with eosinophilia and systemic symptoms: DRESS). Sem Cut Med Surg 1996; 15(4):250-7. 4. Shiohara T, Iijima M, Ikezawa Z, et al. The diagnosis of a DRESS syndrome has been sufficiently established on the basis of typical clinical features and viral reactivations. Br J Dermatol 2007; 156(5):1083-4 5. Peyrière H, Dereure O, Breton P, et al. Variability in the clinical pattern of cutaneous side-effects of drugs with systemic symptoms: does a DRESS syndrome really exist? Br J Dermatol 2006; 155(2):422-8. 6. Ganeva M, Gancheva T, Lazarova R et al. Carbamazepine-induced drug reaction with eosinophilia and systemic symptoms (DRESS) syndrome: report of four cases and brief review. Int J Dermatol 2008; 47(8):853-60. 7. Kano Y, Shiohara T. The variable clinical picture of drug-induced hypersensitivity syndrome/drug rash with eosinophilia and systemic symptoms in relation to the eliciting drug. Immunol Allergy Clin North Am.; 2009 29(3):481-501 8. Ben m'rad M, Leclerc-Mercier S, Blanche P, Franck N, Rozenberg F, Fulla Y, Guesmi M, Rollot F, Dehoux M, Guillevin L, Moachon L. Drug-induced hypersensitivity syndrome: clinical and biologic disease patterns in 24 patients. Medicine (Baltimore). 2009 May;88(3):131-40 9. Mennicke M, Zawodniak A, Keller M, Wilkens L, Yawalkar N, Stickel F, Keogh A, Inderbitzin D, Candinas D, Pichler WJ Fulminant Liver Failure after Vancomycin in a Sulfasalazine Induced DRESS Syndrome: Fatal Recurrence after Liver Transplantation: Am J Transplantation, 2009, in press 10. Descamps V, Bouscarat F, Laglenne S, et al. Human herpesvirus 6 infection associated with anticonvulsant hypersensitivity syndrome and reactive haemophagocytic syndrome. Br J Dermatol 1997; 137(4):605-8. 11. Suzuki Y, Inagi R, Aono T, et al. Human herpesvirus 6 infection as a risk factor of the development of severe drug- induced hypersensitivity. Arch Dermatol 1998; 134 (9):1108-12. 12. Daubner B., Groux-Keller M, Hausmann OV, Kawabata T, NaisbittDJ, Park KB, Wendland T, Lerch M., and Pichler WJ. Multiple Drug Hypersensitivity: normal Treg cell function but enhanced in vivo activation of drug-specific T cells, Allergy 2011, in press 1 13. Iannetti P, Raucci U, Zuccaro P, et al. Lamotrigine hypersensitivity in child hood epilepsy. Epilepsia 1998; 39(5):502-7 14. Picard D, Janela B, Descamps V, D'Incan M, Courville P, Jacquot S, Rogez S, Mardivirin L, Moins-Teisserenc H, Toubert A, Benichou J, Joly P, Musette P. Drug reaction with eosinophilia and systemic symptoms (DRESS): a multiorgan antiviral T cell response. Sci Transl Med. 2010; 2(46):46ra62 15. Naisbitt DJ, Farrell J, Wong G, Depta JP, Dodd CC, Hopkins JE, Gibney CA, Chadwick DW, Pichler WJ, Pirmohamed M, Park BK. Characterization of drug-specific T cells in lamotrigine hypersensitivity. J Allergy Clin Immunol. 2003; 111(6):1393-403 16. Naisbitt DJ, Britschgi M, Wong G, Farrell J, Depta JP, Chadwick DW, Pichler WJ, Pirmohamed M, Park BK. Hypersensitivity reactions to carbamazepine: characterization of the specificity, phenotype, and cytokine profile Mol Pharmacol. 2003; 63(3):732-41 17. Suntharalingam G, Perry MR, Ward S, Brett SJ, Castello-Cortes A, Brunner MD, Panoskaltsis N. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 2006; 355(10):1018-28 18. Pichler WJ Drug hypersensitivity reactions: Classifications and relationship to T cell activation, in Pichler WJ (Hrsg) Drug Hypersensitivity, Karger Basel 2007, p168-189 19. Shusterman S, London WB, Gillies SD, Hank JA, Voss SD, Seeger RC, Reynolds CP, Kimball J, Albertini MR, Wagner B, Gan J, Eickhoff J, DeSantes KB, Cohn SL, Hecht T, Gadbaw B, Reisfeld RA, Maris JM, Sondel PM. Antitumor activity of hu14.18-IL2 in patients with relapsed/refractory neuroblastoma: a Children's Oncology Group (COG) phase II study. J Clin Oncol. 2010; 28(33):4969-75 20. Mallal S, Phillips E, Carosi G, Molina JM, Workman C, Tomazic J, Jägel-Guedes E, Rugina S, Kozyrev O, Cid JF, Hay P, Nolan D, Hughes S, Hughes A, Ryan S, Fitch N, Thorborn D, Benbow A; PREDICT-1 Study Team. HLA-B*5701 screening for hypersensitivity to abacavir. N Engl J Med. 2008 Feb 7;358(6):568-79. 21. Chung WH, Hung SI, Hong HS, Hsih MS, Yang LC, Ho HC, Wu JY, Chen YT. Medical genetics: a marker for Stevens-Johnson syndrome. Nature. 2004 Apr 1;428(6982):486. 22. McCormack M, Alfirevic A, Bourgeois S, Farrell JJ, Kasperavičiūtė D, Carrington M, Sills GJ, Marson T, Jia X, de Bakker PI, Chinthapalli K, Molokhia M, Johnson MR, O'Connor GD, Chaila E, Alhusaini S, Shianna KV, Radtke RA, Heinzen EL, Walley N, Pandolfo M, Pichler W, Park BK, Depondt C, Sisodiya SM, Goldstein DB, Deloukas P, Delanty N, Cavalleri GL, Pirmohamed M. HLA-A*3101 and carbamazepine-induced hypersensitivity reactions in Europeans. N Engl J Med. 2011; 364(12):1134-43 23. Hung SI, Chung WH, Liou LB, et al. HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol. PNAS 2005; 102(11) 4134-9. 24. Adam J, Pichler WJ, Yerly D. Delayed drug hypersensitivity: models of T-cell stimulation. Br J Clin Pharmacol. 2011; 71(5):701-7. 2