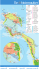le contexte de la peche crevettiere
Transcription
le contexte de la peche crevettiere
Première partie :
LE CONTEXTE DE LA PECHE CREVETTIERE
5
6
Il semble indispensable, pour la bonne compréhension du sujet, de résumer les
connaissances antérieures sur la biologie des crevettes pénéides ainsi que les
conditions du milieu auxquelles elles sont soumises. Dans le premier chapitre, nous
tenterons de présenter la position systématique des principales espèces rencontrées
à Madagascar, de rappeler sommairement la biologie des crevettes pénéides en
général et de dégager ainsi les caractéristiques particulières des pénéides tropicales.
Ensuite, les caractéristiques des conditions physiques et hydroclimatiques des zones
exploitées à Madagascar seront décrites. Le dernier chapitre précise l’importance de
la pêche aux pénéides au niveau mondial, régional et national, ensuite retrace
l’évolution de la pêcherie crevettière malgache depuis le début de son exploitation
jusqu’à la situation actuelle.
1. BIOLOGIE ET ECOLOGIE DES CREVETTES PENEIDES
1.1. POSITION SYSTEMATIQUE
Les crevettes appartiennent à la classe des crustacés, à l’ordre des décapodes. Les
décapodes constituent l’ordre le plus important des crustacés par le nombre des
espèces et contiennent toutes les espèces comestibles (crevettes/camaron,
homards, langoustes, langoustines, écrevisses, crabes, …). Le terme
crevette/camaron englobe plusieurs groupes ; on distingue :
Les crevettes pénéides (Infraordre des Penaeidea)
Les crevettes Caridea ; ces dernières incluent les crevettes grises (Crangon
crangon, superfamille des Crangonoidea) et les crevettes nordiques
(Pandalus borealis, superfamille des Pandaloidea)
Les crevettes de la famille des Palaemonidae qui sont soit d’eau de mer
comme les crevettes roses (Palaemon serratus), soit d’eau douce comme les
camarons d’eau douce (Macrobrachium rosembergii).
Le groupe des crevettes pénéides contient de nombreuses espèces marines des
régions tropicales et subtropicales. Ce groupe renferme les deux superfamille
Penaeoidea (familles Aristeidae, Benthesicymidae, Penaeidae, Sicyoniidae et
Solenoceridae) et Sergestoidea (familles Luciferidae et Sergestidae). Les crevettes
pénéides sont dénommées en anglais ‘’shrimps’’ ou ‘’prawns’’, en espagnol
‘’camaron’’ ou ‘’gamba’’ ou ‘’langostino’’ et en portuguais ‘’camarão’’. Les crevettes
pénéides sont classées de la manière suivante (Pérez Farfante et Kensley, 1997) :
Embranchement : Arthropoda
Super-classe : Crustacea (Pennant, 1777)
Classe : Malacostraca (Latreille, 1806)
Ordre : Decapoda (Latreille, 1803)
Sous-ordre : Dendrobranchiata (Bate, 1888)
Super-Famille : Penaeoidea (Rafinesque-Schmaltz, 1815)
Famille :
Penaeidae (Rafinesque-Schmaltz, 1815)
Solenoceridae (Wood-Mason, 1891)
Sicyoniidae (Ortmann, 1898)
7
Les crevettes pénéides côtières (famille des Penaeidae) qui alimentent les
différentes pêcheries du monde appartiennent à une quarantaine d'
espèces (Garcia
3
et Le Reste, 1981) reparties en dix genres :
Penaeus (Fabricius, 1798)
Fenneropenaeus (Pérez Farfante, 1969)
Marsupenaeus (Tirmizi, 1971)
Melicertus (Rafinesque-Schmaltz, 1814)
Metapenaeus (Wood-Mason 1891)
Parapenaeopsis (Alcock, 1901)
Metapenaeopsis (Bouvier, 1905)
Trachypenaeus (Alcock, 1901)
Trachysalambria (Burkenroad, 1934)
Xyphopenaeus (Smith, 1869)
Dans la nouvelle nomenclature du Museum National d’Histoire Naturelle, les sousgenres Fenneropenaeus, Marsupenaeus et Melicertus (Pérez Farfante, 1969) sont
élevés au rang de genre et le genre Trachysalambria (Burkenroad, 1934) est
ressuscité. Ainsi, les nouvelles dénominations suivantes ont été adoptées :
Fenneropenaeus indicus (H. Milne Edwards, 1837) pour Penaeus
(Fenneropenaeus) indicus (H. Milne Edwards, 1837)
Le genre Fenneropenaeus (Pérez Farfante, 1969) précédemment placé dans le
genre Penaeus (Fabricius, 1798) se distingue de ce groupe par l’absence (ou à
peine visible) de la crête hépatique.
Marsupenaeus japonicus (Bate, 1888) pour Penaeus (Marsupenaeus)
japonicus (Bate, 1888)
Le genre Marsupenaeus (Tirmizi, 1971) précédemment placé dans le genre
Penaeus (Fabricius, 1798) se distingue de ce groupe par les caractères suivants :
thélycum formé d’un seul lobe, telson armé et présence de crête gastrofrontale.
Melicertus latisulcatus (Kishinouye, 1896) pour Penaeus (Melicertus)
latisulcatus (Kishinouye, 1896)
Le genre Melicertus (Rafinesque-Schmaltz, 1814) se distingue du genre
Marsupenaeus (Tirmizi, 1971) par son caractère bilobé du thélycum.
Trachysalambria curvirostris (Stimpson 1860) pour Trachypenaeus
curvirostris (Stimpson 1860)
Le genre Trachysalambria (Burkenroad, 1934) se distingue du genre
Trachypenaeus (Alcock, 1901) par ses réceptacles séminaux bilobés s’ouvrant
dans un sillon commun et une courte suture longitudinale sur la carapace.
Au cours des campagnes de prospection en 1958-59-60, neuf espèces de crevettes
pénéides ont été capturées le long de la côte ouest malgache (Crosnier, 1965). Ce
sont les espèces Penaeus monodon (Fabricius, 1798), Penaeus semisulcatus (De
Haan, 1844), Fenneropenaeus indicus (H. Milne Edwards, 1837), Marsupenaeus
japonicus (Bate, 1888), Metapenaeus monoceros (Fabricius, 1798), Trachysalambria
curvirostris (Stimpson, 1860), Parapenaeopsis acclivirostris (Alcock, 1905), Sicyonia
lancifer (Olivier, 1811), Sicyonia trispinosa (De Man, 1907). L’auteur a signalé que
les trois dernières espèces sont présentes dans les captures mais assez rares, et les
six premières constituent les principales espèces rencontrées à Madagascar. La
correspondance entre la nouvelle nomenclature et la dénomination citée par Crosnier
(1965) est donnée dans le tableau 1.
3
Les nouvelles dénominations récentes (Pérez Farfante et Kinsley, 1997) sont ici utilisées ; de même
que pour citer les travaux d’auteurs employant les anciennes dénominations.
8
De mars 1965 à février 1967, une série de chalutages mensuels, limités à la zone de
la baie d’Ambaro et à la zone comprise entre les isobathes 0 et 10m, a été entreprise
(Chabanne et Plante, 1969). Sur les neuf espèces citées par Crosnier (1965), les
cinq premières espèces ont été capturées au cours de ces campagnes. En outre,
une autre espèce, Metapenaeus stebbingi (Nobilis, 1904), est présente en quantité
très faible dans les traits de chalut.
Tableau 1 : Dénomination des espèces citées par Crosnier (1965)
et nouvelle nomenclature
Nomenclature utilisée par Crosnier, 1965 Nouvelle nomenclature
Muséum National d’Histoire Naturelle (1997)
Penaeus monodon Fabricius, 1798
Penaeus semisulcatus De Haan, 1844
Penaeus indicus H. Milne Edwards, 1837
Penaeus japonicus Bate, 1888
Metapenaeus monoceros Fabricius, 1798
Trachypenaeus curvirostris Stimpson, 1860
Parapenaeopsis acclivirostris Alcock, 1905
Sicyonia lancifer Olivier, 1811
Sicyonia trispinosa De Man, 1907
- idem - idem Fenneropenaeus indicus, H. Milne Edwards, 1837
Marsupenaeus japonicus Bate, 1888
- idem Trachysalambria curvirostris Stimpson 1860
- idem - idem - idem -
Les observations faites sur les débarquements des ‘’Valakira’’ (barrages côtiers en
forme de V implantés dans la zone de balancement des marées) dans la baie
d’Ambaro ont relevé la présence plus ou moins importante des adultes de
Metapenaeus stebbingi Nobili, 1904 (Rabarison, 1984). Cette espèce prend la
troisième place dans les captures de la pêche traditionnelle après F. indicus et P.
monodon. En raison de sa petite taille, elle est souvent confondue par les
observateurs avec des juvéniles de M. monoceros.
Au cours des campagnes de chalutages scientifiques en 2000/2001 sur l’ensemble
de la côte ouest de Madagascar, nous avons capturé d’autres espèces, plus ou
moins connues depuis longtemps par les marins pêcheurs mais qui n’ont pas été
citées dans la littérature, comme Metapenaeus affinis (H. Milne Edwards, 1837),
Melicertus latisulcatus (Kishinouye, 1896) appelée ‘’Marfil’’, Solenocera crassicornis
(H. Milne Edwards, 1837) et Solenocera hextii (Wood-Mason et Alcock, 1891). Les
Metapenaeus affinis et M. latisulcatus sont quelquefois capturées en quantité assez
importante, les Solenocera spp. sont assez rares.
Au total plus d’une dizaine d’espèces de crevettes pénéides serait ainsi présente à
Madagascar. Au niveau de la pêche commerciale industrielle, il apparaît que cinq
espèces constituent l’essentiel des débarquements (tableau 2, annexe 1), dont trois
en quantité importante (F. indicus, M. monoceros et P. semisulcatus) et les deux
autres en quantité moindre (P. monodon et M. japonicus). P. monodon est peu
abondante mais à forte valeur commerciale.
9
Tableau 2 : Espèces principalement capturées par les chalutiers
Principales espèces commercialisées
Quantité importante Quantité moindre
P. monodon
F. indicus
M. japonicus
M. monoceros
P. semisulcatus
Espèces secondaires
Commercialisées
Non commercialisées
M. latisulcatus
M. affinis
1.2. CYCLE BIOLOGIQUE
La plupart des Pénéides ont un cycle amphibiotique avec une phase estuarienne. De
nombreuses études ont été faites sur les cycles biologiques des crevettes pénéides
côtières : sur les côtes ouest Américaines (Gross, 1973 ; Edwards, 1978), sur les
côtes est américaines (Pérez Farfante, 1969), aux Indes (Jones, 1969), au Japon
(Ota, 1949), sur la côte nord-ouest de Madagascar (Marcille, 1978), sur la côte ouest
Africaine (Garcia et Lhomme, 1977). Les différents stades du cycle biologique des
crevettes pénéides des plateaux continentaux se schématisent de la façon suivante :
Les femelles pondent au large des œufs démersaux. De ces œufs éclosent des
larves planctoniques au stade ‘’nauplius’’. Le développement larvaire s’effectue à
travers plusieurs stades successifs : 5 stades ‘’nauplius’’, 3 stades ‘’protozoe’’ et 3
stades ‘’mysis’’. La dernière ‘’mysis’’ subit une mue qui la transforme en postlarve.
Les premiers stades postlarves sont encore planctoniques, mais les suivants sont
semi-benthiques. Les postlarves pénétrent dans les estuaires ou se rapprochent de
la côte. Lorsque les crevettes ont acquis leur formule rostrale définitive, elles sont
qualifiées de ‘’juvéniles’’. A ce stade, les crevettes quittent le milieu estuarien et
migrent vers les zones intertidales. Elles sont appelées ‘’subadultes’’ lorsque les
organes sexuels externes (petasma chez les mâles et thelycum chez les femelles)
sont entièrement formés. Les crevettes retournent en mer lorsqu’elles atteignent une
dizaine de cm. Le stade adulte est atteint lorsque les crevettes sont capables de se
reproduire. (figure 1)
Les crevettes pénéides tropicales passent par ces nombreux stades du cycle de
développement avant d’atteindre le stade adulte. Leur cycle de vie est relativement
court, aux environs de 18 mois. Ce sont des espèces à croissance rapide.
Les crevettes pénéides peuvent avoir une très grande adaptabilité à des conditions
de milieu très diverses. La tolérance aux variations du milieu est plus grande chez
les adultes que chez les jeunes. En effet, des crevettes de grande taille peuvent se
rencontrer dans les zones intertidales, mais les très jeunes se trouvent rarement en
pleine mer. Farfantepenaeus notialis juvénile habite dans des eaux presque douces
mais également dans des estuaires sursalés (Garcia et Lhomme, 1977). Garcia et Le
Reste (1981) citent le cas des Penaeus semisulcatus du golfe entre l’Iran et l’Arabie
Saoudite (Basson et al., 1977) où les larves ne sont jamais rencontrées dans
l’estuaire. Melicertus latisulcatus et Penaeus esculentus ont leurs nourriceries dans
la zone littorale marine (Kirkegaard et Walker, 1969). Les Metapenaeus stebbingi,
capturées par les barrages côtiers dans la baie d’Ambaro sont déjà au stade adulte
(Rabarison, 1984). Cette espèce n’est jamais signalée en pleine mer.
C’est chez les Fenneropenaeus indicus, d’après les nombreuses observations
effectuées en baie d’Ambaro (Crosnier, 1965, Le Reste et Marcille, 1976 et Le Reste,
1978), que le phénomène de migration estuaire-zone intertidale-mer ouverte est le
10
plus net. La taille et l’âge moyens à la migration (Lmig50) seraient de (Anonyme,
1989a) :
9mm LC 4 (1,5mois) pour le passage vers la zone intertidale ;
28mm LC pour les femelles(4,5mois) migrant vers la mer ;
24mm LC pour les mâles(4,5mois) migrant vers la mer.
Le Reste et Marcille(1976) ont observé également le phénomène de migration
estuaire-zone intertidale-mer chez les Metapenaeus monoceros.
Figure 1 : Schéma du cycle vital des crevettes pénéides (Source : Motoh, 1981 ;
étiquette modifiée par l’auteur)
1.3. DISTRIBUTION GEOGRAPHIQUE ET BATHYMETRIQUE
Les distributions géographiques et bathymétriques des principales espèces
rencontrées à Madagascar sont données ci-après.
Fenneropenaeus indicus (H. Milne Edwards, 1837) est principalement observée dans
les zones du sud-est et est de l’Afrique jusqu’au sud de la Chine et aux Nouvelle
Guinée et nord Australie (Mohamed, 1970 ; cité par Holtius, 1980). Elle se rencontre
entre 2 et 90 m de profondeur. Les adultes sont marins et les juvéniles estuariens. A
Madagascar, l’espèce est rencontrée sur toutes les côtes de l’Ile, à l’ouest et à l’est.
Notons sa présence dans les eaux lagunaires de la région de Fort-Dauphin (à
l’extrême sud). L’abondance maximale observée à Madagascar se situe à 8-10 m
(Crosnier, 1965).
4
LC : Longueur céphalothoracique mesurée entre le creux orbitaire et le bord posterieur de la
carapace
11
Metapenaeus monoceros (Fabricius, 1798) est principalement observée dans les
zones du sud-est et est de l’Afrique, de la mer rouge jusqu’aux baies de Bengale et à
l’Atlantique est(George, 1970; cité par Holtuis, 1980). Elle se rencontre entre 1 et 170
m de profondeur. A Madagascar, on l’observe également sur toutes les côtes.
L’abondance maximale observée à Madagascar se situe à 6-15 m (Crosnier, 1965).
Penaeus semisulcatus (De Haan, 1844), est principalement observée en Mer Rouge,
sur les côtes Est et sud-est de l’Afrique jusqu’au Japon, Corée, aux archipels de
Malaisie, sur la côte nord de l’Australie et à l’est de la Méditerranée en passant par le
Canal de Suez. Elle se rencontre entre 2 et 130 m de profondeur. A Madagascar,
Penaeus semisulcatus est présente principalement sur la côte nord-ouest et de la
région de la Tsiribihina jusqu’à l’estuaire du Mangoky.
Penaeus monodon (Fabricius, 1798), est surtout observée à l’est et sud-est de
l’Afrique, au Pakistan jusqu’au Japon, aux Archipels de Malaisie et sur la côte nord
Australienne (Mohamed, 1970 ; cité par Holtius, 1980). Elle se rencontre entre 1 et
110 m de profondeur.
Marsupenaeus japonicus (Bate, 1888), est observée depuis la Mer Rouge, sur les
côtes est et sud-est africaine jusqu’en Corée, Japon et les Archipels de Malaisie, et
également aux Iles Fidji. L’espèce s’étend jusqu’à la Méditerranée est en passant par
le Canal de Suez. Elle se rencontre entre 1 et 90 m de profondeur.
La distribution écologique de ces espèces est largement étendue. Globalement, elle
se situe principalement dans les eaux côtières Indo-Pacifique ouest et la partie est
de la Méditerranée, comprise entre 40°N/30°S et 10°E/150°E (figure 2). Ces espèces
sont d’origine Indo-pacifique mais remontent jusqu’à la Méditerranée par
l’intermédiaire du Canal de Suez.
12
•••
Figure 2 : Distribution géographique des principales espèces rencontrées à Madagascar
13
1.4. COMPORTEMENT
1.4.1. Les déplacements
Les exigences liées à la nature du substrat, à la richesse trophique du milieu, à
l’hydrologie peuvent obliger les crevettes à se déplacer. Lindner et al.(1956) avaient
signalé un déplacement de 580 km de Litopenaeus setiferus le long de la côte
Atlantique des USA. Ruello (1975) mentionne également qu’une crevette Melicertus
plebejus a parcouru 930 km en Australie.
Les résultats obtenus lors des études sur les migrations géographiques des
Farfantepenaeus duorarum aux Etats-Unis ont montré que des distances de 5 milles
nautiques pouvaient être couvertes dans la journée par l’animal et que des
déplacements de plus de 150 milles pouvaient être observés (Costello et Allen, 1965).
Pour les adultes en mer, la répartition géographique est liée aux conditions de milieu.
Les migrations saisonnières de grande amplitude en hiver sont signalées aux limites
extrêmes de distribution de l’espèce chez les pénéides (Burkenroad, 1939 ; Lindner et
al., 1956). Dans certaines régions limites, l’adaptation des pénéides se traduit par l’arrêt
de la croissance et une baisse de l’activité de l’animal (Garcia et al., 1973 ; Lhomme,
1978).
A Madagascar, le phénomène de migrations géographiques de grande amplitude n’a
pas été signalé. La stabilité assez grande des conditions hydrologiques et de
l’isolement relatif des fonds à crevettes pourrait expliquer ce comportement. Toutefois,
Vincent-Cuaz (1964) a signalé l’existence d’une migration trophique pendant la saison
sèche (de mai à juillet), mais cette supposition reste à vérifier.
Ce phénomène de déplacement/migration des crevettes est étudié dans le chapitre 5.3.
à partir des données de marquage-recapture.
1.4.2. La dispersion
Le comportement des crevettes et leur aptitude à se grouper en banc est variable
suivant les espèces et la saison (Garcia et Le Reste, 1981). Certains auteurs admettent
l’absence de comportement « grégaire » ou de « banc », notamment pour
Farfantepenaeus aztecus (Cook et Lindner, 1970). Généralement, les pénéides
présentent des phases de «bancs», « essaims » ou « mattes » (Costello et Allen, 1970 ;
Kirkegaard et Walker, 1970 ; Kirkegaard et al., 1970 ; Panikkar et Menon, 1956 ; De
Bruin, 1965, Pérez-Farfante, 1969 ; Crosnier, 1965 ; Chabanne et Plante, 1969 ; Munro,
1975 ; Marcille, 1978)
D’après les données de prospection de 1964/1965, Chabanne et Plante (1969) ont
remarqué que les crevettes ont un comportement « grégaire » pendant la saison sèche
où elles se rassemblent en bancs denses et isolés les uns des autres, et « dispersé »
pendant la saison chaude où la distribution peu être considérée comme homogène. Les
travaux de Marcille (1978), précisent que les F. indicus ont un comportement en banc
permanent tandis que M. monoceros et P. semisulcatus sont grégaires en début
d’année (saison pluvieuse) et dispersées en fin d’année (saison sèche).
14
1.4.3. Le rythme nycthéméral
Les pénéides adultes s’enfouissent généralement dans la vase durant le jour et nagent
au voisinage du fond pendant la nuit. Ce schéma peut cependant être perturbé en
fonction de l’intensité de lumière traversant la couche d’eau qui diminue si les eaux sont
turbides et le rythme quotidien (rythme nycthéméral) d’activité ‘’apparent’’ 5 pourrait
avoir des changements saisonniers en relation avec les variations hydroclimatiques
(Garcia, Petit et Fonteneau, 1973).
A Madagascar, Chabanne et Plante (1971) font apparaître que l’abondance estimée par
les captures des F. indicus varie de 10% entre 2h et 6h à 90% entre 6h et 18h pendant
que celle de M. monoceros passe de 75 à 2%, et celle de P. semisulcatus de 14 à
2,5%.
1.4.4. L’influence du cycle lunaire
L’influence du cycle lunaire est plus nette pour les subadultes en migration estuaire-mer
que pour les adultes en mer.
Certains auteurs indiquent que la sensibilité des crevettes au stimulus de migration
dépend du stade de mue. Cette dernière est centrée sur la pleine lune inhibant la
migration qui commence après le dernier quartier lorsque la mue est terminée (Racek,
1959 ; Boddeke, Dijkema et Stemelink, 1977).
Les courants de marée sont plus forts en pleine et nouvelle lune, et cela joue aussi sur
les migrations. Plusieurs études confirment que les captures dans la zone intertidale ont
un maximum en période de nouvelle lune (Copeland, 1965 ; Subrahmanyam, 1967 ; De
Bondy, 1968 ; Yokel et al., 1969 ; Garcia, 1972 et 1977 ; Rabarison, 1984 ;
Rasoarimiadana ; 1985 ; Rabarison, 1987 ; Rafalimanana, 1990 ; Razafindrainibe et al.,
1995).
Pour les adultes de P. semisulcatus et M. monoceros, Marcille(1978) signale que les
captures seraient plus élevées en période de pleine lune à la fin de la saison fraîche et
en début de saison chaude, mais les résultats varient d’une année à l’autre et la
significativité de la différence constatée n’est pas certaine.
1.5. CROISSANCE ET RELATION TAILLE-POIDS
Les paramètres de croissance, coefficient de relation longueur/poids inclus, figurent
parmi les paramètres de base de la dynamique des populations.
1.5.1. La croissance
Les conditions de température et de nourriture paraissent intervenir essentiellement
dans la croissance. La croissance est rapide à une température élevée ; elle peut
même s’arrêter dans les zones où le refroidissement est important en hiver. Une étude
sur l’influence combinée des facteurs température et salinité sur la croissance larvaire
des crevettes rose Palaemon serratus (de la famille des Palaemonidae) in vitro, a été
faite par Yagi et Ceccaldi (1984). L’expérience montre que ni la température, ni la
salinité n’agissent séparément sur la physiologie de l’animal au cours du
développement larvaire, c’est la combinaison des deux facteurs qui doit être
considérée.
5
Le rythme d’activité ‘’apparent’’ des captures est l’inverse du rythme réel de l’animal.
15
Chez les pénéides, les mâles ont en général une croissance plus faible que celle des
femelles. Chez les jeunes crevettes cette différence n’est pas décelable. Dans la baie
d’Ambaro, Le Reste (1971) a trouvé une croissance moyenne de 3,3 cm de longueur
totale (LT) par mois pour les jeunes F. indicus, femelles et mâles confondus. Chabanne
et Plante (1969) indiquent une croissance de 0,7 cm LT/mois pour les mâles et de 1 cm
LT/mois pour les femelles. Le Reste et Marcille (1976) ont estimé une vitesse de
croissance moyenne de 4,8 mm/mois LC pour les jeunes avant recrutement dans
l’estuaire, et de 7,5 mm/mois LC pour les jeunes après recrutement dans l’estuaire.
Comme chez tous les êtres vivants évolués la vitesse de croissance tend à diminuer au
fur et à mesure que la taille augmente (Von Bertalanffy, 1938). Au bout d’un an, les
crevettes pénéides côtières ont atteint leur taille adulte. Des crevettes âgées d’au moins
27 mois avaient été observées par marquage (Baxter, 1971). Les crevettes au-delà de
un an ne participent significativement pas aux captures. Les tailles adultes varient
beaucoup suivant les espèces et différent selon le sexe (tableau 3). Chez F. notialis ou
F. duorarum, la durée de vie des mâles et des femelles sont comparables. Les femelles
ont toujours une taille maximale plus élevée que les mâles.
Tableau 3 : Tailles maximales atteintes par les principales espèces exploitées
à Madagascar
!"#
$ %&'$(
!"#
+ %&'$
!,#
+ %&'-(
!-#
+ %&'(.
%)* ..#
"
%)* ..#
"
((#
/
%)* ..#
%)* !,#
-
%&'%&'-,
%&',+
%&'
%&'-+
%)*
%)*
%)*
%)*
%)*
$.
$!
$(
("
%)
%)
%)
%)
%)
!
$/
/(
-/
$"
%)
%)
%)
%)
%)
La croissance individuelle des crevettes est discontinue. En effet, le squelette des
crevettes est constitué d’une carapace rigide appelée cuticule. L’organisme tout entier
est enfermé et l’animal doit abandonner sa carapace pour grandir : c’est le phénomène
de mue. La mue ou exuviation consiste en un rejet par l’animal de l’ancienne carapace
qui est remplacée par une nouvelle. La mue n’est pas simultanée chez tous les
individus et la croissance se poursuit partiellement dans l’intermue (Bodeke et al.,
1977). L’approximation par une fonction continue ne devrait donc pas entraîner de biais
considérable. Le modèle de Von Bertalanffy est bien adapté à la croissance des
crevettes pénéides (le Reste et Marcille, 1976 ; Parrack, 1979). L’expression classique
de ce modèle est de la forme suivante :
Lt = L∞ ( 1 – e –K (t – to) )
où
Lt est la taille de l’animal au temps t
La résolution de cette équation nécessite la connaissance des paramètres L∞ , K et to.
0
*40
)
#1 1 2
'
#!, -*
(#
-
% 8
#
2
(#
+
2
(#
.
2
9
'!,/$* :
%& %)4
'
*
'%) 5
#)7
1
6
'%&*
'!, ,*
3
$#
. 2 ')
*46
%& %)
(#
/
(#
!
(#
(
1
16
(
1
L∞ est la taille moyenne asymptotique
K est le coefficient de croissance (proportionnel au catabolisme)
to est l’âge théorique des individus lorsque L=0
Les paramètres de croissance de l’équation de Von Bertalanffy obtenus par Le Reste et
Marcille (1976) à partir des données de marquage en 1972 dans la zone nord sont
donnés dans le tableau 4.
Tableau 4 : Paramètres de croissance des F. indicus et M. monoceros
obtenus par Le Reste et Marcille (1976) à Madagascar
F. indicus
M. monoceros
Mâles
Femelles
Mâles
Femelles
42,41
28,20
36,10
29,88
LC∞(mm)
0,373
0,344
0,257
0,253
K/mois
Les travaux récents ont évoqué les difficultés d’utiliser les paramètres de croissance de
F. indicus mâle de Le Reste et Marcille dans les modèles d’évaluations. Les effectifs
estimés des deux sexes sont mieux équilibrés (Dintheer et al., 1998, Moguedet et al.,
2001) en utilisant les paramètres de croissance des mâles trouvés par Coss et al.
(1993) au Mozambique (tableau 5).
Tableau 5 : Paramètres de croissance des F. indicus et M. monoceros
obtenus par Coss et al. (1993) au Mozambique
F. indicus
M. monoceros
Mâles
Femelles
Mâles
Femelles
39,0
48,2
36,0
48,3
LC∞(mm)
0,25
0,21
0,25
0,14
K/mois
Les valeurs données dans le tableau ci-après sont exposées à titre indicatif pour avoir
une idée sur les grandeurs des paramètres de croissance obtenus et utilisés pour
d’autres espèces de pénéides.
Tableau 6 : Paramètres de croissance des autres crevettes pénéides
obtenus par divers auteurs
Femelle
Mâle
Auteur
Espèce
Lieu
K/mois LC∞(mm) K/mois LC∞(mm)
F. notialis
Lhomme, 1978
Sénégal
0,38
43,2
0,50
31,3
F. notialis
Garcia, 1975a
Côte d'
Ivoire
0,16
51,6
0,26
34,4
F. notialis
Berry, 1967
Tortugas
0,22
20,2
0,19
17,7
Iversen et al., 1961 F. notialis
46,5
0,07
46,4
Floride
0,09
P. plebejus Australie
Lucas, 1974
0,43
49
0,43
40
0,20
Lindner et al., 1956 P. setiferus G. du Mexique
19,0
0,27
17,8
1.5.2. La relation taille-poids
Avant introduction dans les modèles, la courbe de croissance en longueur sera
transformée en courbe en poids. D’une façon générale, poids et taille sont liés par une
relation de la forme : P = a LC b (Hall, 1962), P étant le poids en gramme (g), LC la
longueur de la carapace en millimètre (mm) et a et b deux constantes propres à chaque
espèce. Hall a trouvé la relation suivante chez les F. indicus de la région Indo-Pacifique
ouest : P = 0,006918 LC 2,922.
17
Le groupe de travail CNRO/OISO7 qui s’est tenu à Nosy-Be en 1989 utilise les valeurs
des coefficients suivants pour la simulation de la pêcherie dans la zone nord (ex-zone
1) de Madagascar. Pour les deux groupes d’espèces (diurne et nocturne) et pour les
deux sexes (femelle et mâle) le groupe de travail a pris les valeurs a = 0,0023 et b =
2,68. Dans les évaluations récentes sur l’ensemble de l’Ile, Dintheer et al.(2001)
utilisent les coefficients de relation taille/poids figurés dans le tableau 7.
Tableau 7 : Coefficients de relation taille/poids utilisés dans les évaluations récentes
) 22
% 8
+#
++.$"
.#((/
4'!,/$*
+#
++!/.
.#
//(,
)
+#
++.,
.#
-$
4'!,,(*
+#
++.(
.#
-
1.6. CYCLE DE REPRODUCTION ET DE RECRUTEMENT
1.6.1. La reproduction
Les crevettes sont très prolifiques ; chaque femelle peut pondre jusqu’à 500 000 voir un
million d’œufs suivant les conditions du milieu et suivant la taille de l’animal. Cette
grande fécondité fait que la ressource est assez robuste, de sorte que la pression de
pêche au niveau actuel ne met pas en péril le potentiel de reproduction de la ressource
– autrement dit, la surexploitation de recrutement mettant en danger la capacité
reproductive du stock ne serait atteinte que dans des cas extrêmes. Tout accroissement
de l’effort de pêche se traduira par une destruction de richesse au sens économique du
terme. La prudence doit s’imposer en matière de gestion de l’effort global de pêche, afin
d’éviter que la pêcherie ne se trouve en situation de surexploitation économique.
Toutefois, la survie des larves est très variable suivant les conditions du milieu. Les
stocks se reconstituent d’année en année et les liens entre le niveau de stock et les
prises ne sont pas certains.
La fécondité varie avec l’âge, donc avec la taille, et l’espèce. La taille à la première
maturité trouvée par Le Reste et Marcille (1976) est de 27 mm LC pour F. indicus et de
24 mm LC pour M. monoceros. Elle correspond à la taille pour laquelle 50% au moins
des femelles observées étaient matures. Ce paramètre est caractéristique de l’espèce,
et il est souvent utilisé pour quantifier l’intensité de la reproduction.
Chez les crevettes pénéides tropicales la reproduction au niveau de la population est
pratiquement continue mais des pics de reproduction sont observés sur certaines
périodes. Pour F. indicus, deux périodes de ponte sont observées : l’une en
octobre/novembre (génération ‘’A’’) et l’autre en mars/avril (génération ‘’B’’) (Le Reste et
Marcille, 1976). La génération ‘’B’’ constitue une biomasse reproductrice importante et
contribuerait de manière substantielle à la reproduction en octobre. Pour M. monoceros,
une période de ponte est observée en septembre/octobre et une autre observée en mai
(Le Reste et Marcille, 1976).
7
CNRO/OISO : Centre National de Recherches Océanographiques (Nosy-Be) / Projet Régional pour le
Développement et l’Aménagement des Pêches dans l’Océan Indien Sud-Occidental, RAF/87/008
18
Le phénomène de la ponte, au niveau de l’ensemble de la population, dépend à tout
instant du potentiel propre de la population et des conditions du milieu. Vincent-Cuaz
(1964) avait signalé à partir des données de campagne ‘’CHIDORIGO’’que dans la
zone comprise entre la baie de Narindra et le Cap St André, une période de ponte en
mars/avril correspond à une température élevée de l’eau. Le Reste (1973) suggère qu’à
faibles variations thermiques saisonnières, la reproduction soit étroitement liée aux
variations de deux stimuli : décharge continentale et richesse planctonique.
1.6.2. Le recrutement dans la zone de chalutage
Le recrutement est défini ici comme le processus par lequel un groupe d’âge de
crevettes s’intègre pour la première fois dans le stock exploitable.
Dans la plupart des cas, le recrutement en mer dure toute l’année mais présente des
variations saisonnières plus ou moins marquées suivant les conditions
environnementales. Il varie également d’une année à l’autre principalement en fonction
des conditions hydroclimatiques, notamment la pluviosité et les débits des fleuves. La
variabilité du recrutement expliquerait l’essentiel des variations d’abondance inter
annuelles.
La taille moyenne au recrutement en mer varie saisonnièrement et d’année en année
en fonction des conditions du milieu (Pullen et Trent, 1969 ; Parker, 1970 ; Ruello,
1973 ; Garcia, 1977 ; Le Reste et Marcille, 1976, Le Reste, 1978 ; Lhomme, 1979).
Globalement, l’âge moyen des crevettes au recrutement est de 2,5 à 4 mois (Garcia,
1970, 1977 ; Galois, 1975 pour F. notialis, Le Reste 1971, 1973 pour F. indicus). La
taille au recrutement représente une donnée de base pour les modèles de simulation.
Le Reste et Marcille (1976) ont signalé que chez les F. indicus et les M. monoceros à
Madagascar, le recrutement dans les pêcheries se fait à des tailles différentes pour les
femelles et les mâles. A noter que les tailles différentes des femelles et des mâles
correspondent globalement aux même âges. Ils constatent également que les crevettes
sont recrutées à une taille plus petite en février/mars (pleine saison des pluies) que
pendant le reste de l’année.
Les F. indicus sont recrutées à une taille moyenne de 9 cm LT (21 mm LC), aussi bien
les femelles que les mâles, en février-mars (pleine saison des pluies). Pendant le reste
de l’année, cette taille est de 11,5 cm LT (27 mm LT) pour les femelles et de 10,5 cm
LT (25 mm LC) pour les mâles.
Chez les M. monoceros femelles, la taille au recrutement varie de 11 à 18 mm LC en
février, puis elle tend à augmenter jusqu’en juin et atteint 23 à 24 mm LC ; elle reste la
même jusqu’en septembre, puis tend à diminuer. Les individus mâles sont recrutés à
14-15 mm LC ; la longueur au recrutement tend à augmenter jusqu’à 20 mm LC en
août, elle change peu jusqu’en novembre, puis tend à diminuer.
Dans la zone nord et pour F. indicus, la quasi-totalité des captures dans la zone de
chalutage dépend des recrutements de janvier-février (Le Reste et Marcille, 1976 ; Le
Reste, 1978). Ces recrutements proviennent de la ponte d’octobre-novembre (Le Reste,
1978).
Dans cette zone où la pêche traditionnelle avec des engins non sélectifs est très
importante, il y aurait un risque de surexploitation de croissance en exerçant une
pression insupportable sur les populations juvéniles. Une augmentation de la mortalité
19
sur les individus jeunes affecte négativement les effectifs d’individus plus âgés qui
seront accessibles à la pêche industrielle.
2. CONDITIONS PHYSIQUES ET HYDROCLIMATIQUES
2.1. LE MILIEU PHYSIQUE
2.1.1. Topographie
Madagascar dispose d’un plateau continental, jusqu'
à l’isobathe de 200 mètres, d’une
superficie d’environ 117 000km2. Ce plateau continental est relativement large sur la
côte ouest où il s’étale entre 30 à 60 milles et étroit sur la côte est (3 à 5 milles sauf
dans la baie d’Antongil où il est beaucoup plus vaste).
L'
Ile de Madagascar se caractérise par une dissymétrie qui oppose l'
est et l'
ouest.
On peut distinguer 2 grands secteurs littoraux à l'
ouest :
du Cap St Marie au cap St André, s'
étend une côte basse (sauf au cap St Marie
lui-même et à la Baie de St Augustin) bien régularisée par des cordons littoraux,
mal pourvue en mouillage en dehors de quelques grandes embouchures
(Onilahy, Mangoky et Tsiribihina) et marquée par un climat sec.
au nord jusqu'
au Cap d'
Ambre, s'
étire un secteur moins plat, beaucoup plus
découpé et surtout plus humide.
Le littoral oriental a un caractère rectiligne surtout entre Tolagnaro et Toamasina et est
bordé par une suite sans fin de cordons littoraux. Les lagunes restent partiellement à
l'
abri des influences marines, en raison d'
une faible amplitude des marées. La
mangrove est réduite à quelques bosquets de palétuviers installés aux embouchures
fluviales et aux passes des lagunes, par suite de la faiblesse du marnage (Lebigre,
1990).
La localisation des points ou régions géographiques cités dans cette étude est
présentée sur la figure 3. Pour ne pas trop surcharger cette figure, nous avons porté sur
la figure 4 la délimitation en grande zone (zone nord, zone nord-ouest et zone sud)
utilisée au cours de cette étude.
20
Figure 3 : Carte de Madagascar – Localisation des baies et points géographiques
cités
2.1.2. Bathymétrie
Le relief côtier est caractérisé par la dissymétrie fondamentale entre l'
est et l'
ouest. La
plate-forme continentale est très étroite sur la côte est, avec une profondeur de 100 m
jusqu'
à 3 à 5 km des côtes. Sur la côte ouest, une profondeur de 100 m ne s'
observe
qu’à 30-80 km du rivage (figure 4).
21
Figure 4 : Carte de Madagascar - Isobathes de 30 m et 200m et Grille des carrés
statistiques de 20 milles de côté
(Source : PNRC et Centre de Surveillance des Pêches – Madagascar)
2.1.3. Nature des fonds
Sur la côte nord-ouest, la pêche s'
effectue sur les petits fonds vaseux ou sablo-vaseux
du plateau continental qui dépassent rarement la sonde de –40 mètres. Les fonds
vaseux des mangroves ne se trouvent qu'
à 3-4 m de la surface (marnage sur la côte
ouest : 3 m).
Selon Crosnier (1965) P. japonicus paraît préférer les fonds contenant toujours une
assez forte proportion de sable, F. indicus, M. monoceros et P. monodon se trouvent
essentiellement sur les fonds de vase.
22
2.2. HYDROCLIMAT
Les conditions de l’environnement ont une grande influence sur les écophases des
crevettes, notamment sur leur distribution géographique et bathymétrique. L’Ile de
Madagascar s'
étend du nord au sud sur 1 650 km et se situe entre 11°57’ et 25°30’ de
latitude Sud. Les variations régionales sont donc importantes selon un gradient nordsud.
2.2.1. Les conditions climatiques
Pendant l'
hiver austral (de mai à octobre), la ceinture anticyclonique tropicale qui est
cependant plus ou moins perturbée par le passage de dépression d'
ouest en est,
entraîne sur Madagascar un régime d'
alizés d’est à sud-est pour la région de Nosy-be,
ou d’est à nord-ouest pour la région de Mahajanga. Sur la côte sud-ouest, le régime
d’alizés est établi mais les alternances de brises de terre et de mer sont plus marquées
que sur la côte nord-ouest (Crosnier, 1965). Pendant l'
été austral (de novembre à avril),
la zone de convergence inter-tropicale étend son influence sur Madagascar. Le régime
d'
alizés devient moins régulier et une instabilité orageuse se développe. L'
alizé du sudest est contrarié par la mousson du nord-est qui provoque une houle de nord-est. C'
est
au cours de cette saison pluvieuse que les dépressions et cyclones tropicaux peuvent
se produire le cas échéant à Madagascar. Ceux-ci rendent la navigation plus périlleuse
et la côte orientale est la plus exposée.
Globalement, le climat est caractérisé par l'
alternance d'
une saison fraîche et sèche de
mai à octobre et d'
une saison chaude et pluvieuse de novembre à avril. Toutefois, des
variations selon les façades maritimes et les situations géographiques sont observées
(figure 5) :
La côte nord-ouest est caractérisée par des amplitudes thermiques peu
marquées. Toute l'
année, le climat est chaud et humide. La période des pluies
les plus marquées et le risque des cyclones se situent aux mois de
novembre/mars.
La côte ouest présente également une température élevée toute l'
année. On
note la présence de deux saisons bien marquées; la saison chaude et
pluvieuse qui s'
étend d'
octobre à mars et la saison chaude et sèche qui s'
étend
d'
avril à septembre.
La côte sud-ouest présente une température parfois élevée et l'
amplitude
thermique est beaucoup plus forte avec une importante différenciation
saisonnière (saison froide marquée). Le climat est pratiquement chaud et sec
toute l'
année.
La côte est présente un climat chaud et humide toute l'
année. Cette région
présente également plus de risques cycloniques de novembre à mars.
La température et la précipitation n’ont pas une influence directe sur les activités de
pêche. Par contre, le régime saisonnier des vents régit dans une certaine mesure la
possibilité de chalutage et de sortie en mer des pêcheurs piroguiers.
23
Figure 5 : Température de l’air et pluviométrie moyenne mensuelle (1990-1999)
(Source : Service de la météorologie nationale, site Web www.matvonline.tv)
2.2.2. Les conditions hydrologiques et océanographiques
La mer du littoral occidental est chaude en toute saison. Le canal de Mozambique est à
l'
origine d'
un certain nombre de caractères propres à cette façade : marée à forte
amplitude, houles australes puissantes entre le Cap St Marie et le cap St André, eaux
chaudes et claires propices aux formations récifales.
Les principaux paramètres liés à l'
eau qui vont régir les écosystèmes estuaire-mer sont
le niveau de l'
eau, le degré de salinité et le degré de turbidité.
Le mélange des eaux terrestres et marines est en perpétuel changement et se trouve
sous les influences saisonnières :
pour les eaux de mer :
24
• des cycles de marées quotidiennes toutes les 06h15mn environ,
• du cycle lunaire tous les 14 jours de mortes et vives eaux,
• du cycle annuel de fortes marées d'
équinoxe et de solstice
pour les eaux douces :
• du bilan des pluies de l'
année recueillies sur les bassins-versants et dont
dépend le débit moyen des fleuves,
• de l'
intensité des pluies torrentielles en saison des pluies qui engendrent
chaque année des crues.
Le cycle de marée/lunaire :
L'
ensemble des côtes est soumis à un régime de marée semi-diurne avec un marnage
très faible à l'
est et au sud, mais qui est relativement important à l'
ouest. A l’ouest, le
marnage est compris entre 0,5 mètre en mortes eaux et 4,2 mètres en vives eaux.
Le mouvement des masses d’eaux marines :
Les côtes malgaches subissent dans leur ensemble l'
influence du Courant Sud
Equatorial (CSE). En butant sur la partie nord-est de l'
Ile, le CSE se divise en deux
branches : l'
une qui longe la côte orientale en direction du sud et l'
autre qui dévie sur le
Cap d'
Ambre et le contourne par le nord pour se diriger vers la côte Est africaine. Les
eaux qui baignent les côtes malgaches sont chaudes et pauvres en éléments nutritifs
dissous venant des grandes profondeurs. Cette relative stabilité hydrologique ne serait
troublée que par :
un mouvement tourbillonnaire avec remontée d'
eau froide vers 24°S dans le
Canal de Mozambique en été austral (Menache, 1961, cité par Ralison, 1990)
un front thermique à fort gradient vers 22°S au milieu du Canal de Mozambique
en hiver austral (Marcille, 1967, cité par Ralison, 1990)
des upwellings intermittents à hauteur de 17°S près de l'
Ile de Juan de Nova
(Citeau et al, 1973 ; Marcille, 1972, cité par Ralison, 1990).
La partie nord-ouest de Madagascar est largement sous l'
influence d'
une masse d'
eau
chaude présente dans le Canal de Mozambique une grande partie de l'
année. La partie
sud-ouest présente une circulation d'
eau moins chaude que la précédente. Cet écart
thermique s'
explique par la latitude mais aussi par la présence d'
une zone de
divergence entre deux masses d'
eau vers 20°S.
Les baies et les estuaires qui découpent la côte nord-ouest fonctionnent par ailleurs,
grâce à un système de circulation à deux couches de mouvements opposés, comme
des trappes à matières organiques qui s'
accumulent et se minéralisent au ras de la
côte. Cette richesse organique est à la base de la forte productivité en crevettes
constatée dans les dites baies.
Les apports d'eau douce :
Les fleuves et rivières de Madagascar sont soumis à un régime tropical avec les deux
saisons bien marquées sur la côte ouest (saison sèche et saison de pluie). Les
répartitions mensuelles des précipitations selon les stations sont présentées sur la
figure 5.
Les estuaires reçoivent les eaux issues d’un bassin versant (zone hydrogéologique)
spécifique (figure 7). Une multitude de bassins d’importances inégales en étendue et en
volume d’eau drainée est répertoriée sur les versants ouest de Madagascar. Les
fleuves qui capturent les eaux des bassins fluviaux se jettent dans les baies, les deltas,
estuaires ou lagunes. La Betsiboka est le premier fleuve de Madagascar par la surface
25
de son bassin versant et le volume d’eau écoulé annuellement. Elle forme un delta
important à travers une forêt dense de palétuviers avant de se jeter dans l’estuaire de
Bombetoka. La Tsiribihina tient la deuxième place après La Betsiboka et se jette en mer
par un immense delta. A noter également le bassin de Manambolo qui se jette
directement dans le canal de Mozambique par un delta à peine marqué. Les principaux
autres fleuves se jettent dans une baie spécifique.
Figure 6 : Madagascar – Bassins versants et marais maritimes (mangroves)
sur la côte ouest (Source superficie : Chaperon et al., 1993, et Lebigre, 1990)
Les marais maritimes et les mangroves :
Une forte production primaire est constatée particulièrement dans les baies et les
estuaires qui découpent essentiellement la côte occidentale de Madagascar. On y
rencontre des mangroves à palétuviers qui ont une importance halieutique et
écologique bien reconnue, particulièrement indispensable dans le cycle biologique des
crevettes Penaeïdes. La faune y est abondante et particulièrement c'
est une zone de
nourricerie pour les jeunes crevettes. Madagascar compte de 300.000 à 400.000ha de
mangroves selon les auteurs (Kiener, 1972). Les nouvelles estimations tiennent compte
de l'
ensemble des mangroves et tannes (Lebigre, 1990) : environ 425.000ha.
En Louisiane, Browder et al. (1989) ont mis en évidence une relation positive entre les
captures de P. aztecus et la longueur totale de l’interface terre-eau des marais côtiers.
A Madagascar, une analyse sur la relation entre production totale de crevettes et
surface de mangrove trouve une relation de type linéaire avec deux points excentrés :
la baie d’Ambaro où la production est très forte et la baie de Bombetoka où la
production est particulièrement faible (Lhomme, 2001)
26
2.2.3. Les conditions hydroclimatiques
La température et la salinité sont deux paramètres essentiels dans l'
étude de la
ressource halieutique car ils conditionnent directement la croissance des animaux. La
température a une influence directe sur la croissance; une crevette d'
élevage de
l'
espèce P. monodon grossit deux fois plus vite à 28° qu'
à 24° (cité par Toussaint et al.,
1994). La salinité a également une influence sur la croissance des animaux, le point
iso-osmotique des crevettes se situant autour de 20‰ (cité par Toussaint et al., 1994).
D'
autre part les conditions d'
eaux saumâtres sont plutôt favorables au développement
d'
une forte productivité naturelle (alimentation des crevettes).
Dans les eaux très côtières où se pratique la pêche traditionnelle, le facteur de
différenciation des deux périodes climatiques est la pluviométrie se traduisant par une
forte dessalure des eaux en février (de 5 à 20‰) et par une salinité maximale en
novembre (de 30 à 35‰). Une série de mesures récentes (1997-2000) de salinité des
canaux où se pratique la pêche traditionnelle et/ou la prise d'
eau des fermes de
crevetticulture est disponible (figure 7). Dans l'
ensemble, les mesures ont été réalisées
chaque jour à marée haute.
Figure 7 : Variations saisonnières de la salinité moyenne dans les différentes zones
de pêche traditionnelle (Source : Données 1998/1999, PNRC)
Les salinités moyennes mensuelles les plus faibles sont observées au mois de février
où il y a certainement une influence directe des précipitations. La salinité moyenne
mensuelle croit rapidement jusqu’au mois de mai. Elle augmente ensuite régulièrement
pour atteinte la valeur maximale aux environs de 30; et 35; au mois de novembre
puis diminue brusquement jusqu’au mois de février. Cette saisonnalité est surtout
marquée dans les baies des zones nord et nord-ouest où la pluviométrie est importante.
Dans la zone sud, la variation saisonnière de la salinité est moins importante.
Un peu plus au large, donc dans la zone côtière exploitée par la pêche industrielle, la
différence existante entre les températures du mois le plus chaud et du mois le plus
27
froid est plus marquée au sud qu’au nord. La saisonnalité est donc ici surtout
thermique. Le même phénomène est également constaté en ce qui concerne la salinité.
Au nord, la valeur moyenne est entre 35 et 36; tout au long de l’année. En dehors des
grandes périodes de pluie, la salinité moyenne oscille autour de 35; dans la région de
Mahajanga et au environ de 36; dans les zones Sud. Le décalage de la valeur
moyenne minimum atteint au mois de février est plus marqué au sud qu’au nord (figure
8).
Figure 8 : Température/Salinité moyenne des eaux de fond des zones chalutées
(Source : Campagne de chalutage 2000-2001)
28
3. EXPLOITATION DE LA RESSOURCE CREVETTIERE
L’exploitation des ressources crevettières est depuis longtemps parmi les activités
halieutiques les plus lucratives. Les crevettes pénéides, souvent de grande taille, ont un
intérêt considérable en raison de leur haute valeur marchande, associée à une forte
demande sur le marché. La majorité des espèces vivant sur le plateau continental et
exploitables économiquement se trouve dans les eaux tropicales.
Les crevettes pénéides côtières se rencontrent depuis les eaux plus ou moins
dessalées (lagunes, estuaires, delta, mangroves) jusque dans les eaux à une centaine
de mètres de profondeur. Depuis fort longtemps, les crevettes sont capturées au
voisinage des estuaires au moyen de barrages fixes dans la zone des marées, ou de
nasses et de filets mouillés dans les embouchures des fleuves ou aux débouchés des
lagunes. La pêche industrielle n’a démarré que vers 1910 avec le développement du
bateau de pêche à moteur et du chalut.
A Madagascar, les premières prospections à caractère scientifique faites en mer datent
de 1951 (Fourmanoir, 1952). L’exploitation industrielle a commencé réellement en
1967. Depuis, la pêcherie s’est développée et le problème de rationalisation de
l’exploitation des stocks se pose avec de plus en plus d’acuité.
3.1. PECHE CREVETTIERE DANS LE MONDE
Le développement de l'
exploitation des crevettes est dû à l'
accroissement de la
demande et à la forte hausse des cours de la crevette sur les marchés de plusieurs
pays ou groupes de pays industrialisés, notamment le Japon, les Etats-Unis et l’Union
européenne. Cette activité offrait également de grandes possibilités de gains en devises
pour les pays producteurs.
3.1.1. La production
L'
exploitation des crevettes pénéides côtières est une activité très ancienne.
Traditionnellement exploitées par les artisans pêcheurs de nombreux pays (Mexique,
Sénégal, Côte d'
Ivoire, Bénin, Madagascar, Indes, etc.), les crevettes ont dû supporter
depuis les années cinquante un accroissement de l'
exploitation de la pêche industrielle
qui se développe rapidement en Amérique latine, en Afrique, dans l'
Océan Indien et en
Océanie.
Globalement, le volume de capture de crevettes représente de 2 à 3% de la production
halieutique mondiale (figure 9). Toutes espèces confondues, le volume de la capture
mondiale de crevettes est passé d'
environ un million de tonnes en 1970 à près de deux
millions de tonnes en 1990 et à près de trois millions de tonnes actuellement. La
production de l'
élevage de crevettes ne cesse également de se développer. Le volume
total de crevettes d'
élevage représente aujourd'
hui près de la moitié du volume des
pêches. La hausse de la production en volume se ralentit en Asie et en Amérique latine,
tandis que la production en Afrique, encore limitée en volume, connaît une expansion
rapide (Anonyme, 1999).
29
L'
évolution récente des captures de crevettes est régulièrement à la hausse avec un
taux d'
accroissement annuel d'
environ 5% depuis 1995
Figure 9 : Evolution des captures halieutiques globales, captures des crevettes et
productions de l’élevage de crevettes (Source : FISHSTAT-FAO)
C'
est la Chine qui est le premier producteur de crevettes de pêche (figure 10).
D’ailleurs, c'
est le même pays qui est le premier producteur mondial de crevettes
d'
aquaculture. Il représente 31,7% des captures mondiales de crevettes. Suivi de loin
par les deux autres pays de la région Asie-Pacifique l'
Inde et l'
Indonésie avec 10,2% et
8,3% des prises mondiales. Toutes espèces confondues (crevettes tropicales, crevettes
grises, crevettes nordiques, …) Madagascar occupe la 30e place avec ses 11 000
tonnes de crevettes et représente 0,4% de la capture mondiale de crevettes.
La ventilation des captures mondiales par famille de crevettes montre la prédominance
des crevettes Pénéides qui représente 28% du total des prises (figure 11). Les
Palaemonidae (bouquet,…) représentent une part non négligeable avec 20% des prises
mondiales. Les crevettes nordiques (Pandalidae) prennent également une part
importante (13%). A noter qu'
une quantité assez importante de capture n'
ont pas été
répartie en grande famille de crevettes (ND) du fait des imprécisions dans la base
FISHSTAT-FAO où les captures sont enregistrées sous l’appellation Décapodes
natantia nca.
30
Figure 10 : Capture moyenne des années 97/98/99 des principaux pays producteurs
de crevettes (Source : FISHSTAT-FAO)
Figure 11 : Répartition par famille des crevettes capturées (moyenne 1997/98/99)
(Source : FISHSTAT-FAO)
31
La répartition des captures de crevettes pénéides par grandes régions témoigne de
l'
importance de la région de l'
Océan Indien ouest, au second rang après le Pacifique
Centre-Ouest (figure 12).
Figure 12 : Répartition des captures des crevettes pénéides par région
(Source : FISHSTAT-FAO (moyenne 1997/98/99)
Au niveau de l'
Océan Indien ouest, la répartition par pays des captures de crevettes
pénéides (figure 13) montre une place largement prépondérante de l'
Inde (107 000 t).
Madagascar avec ses 11 000 tonnes de capture annuelle vient en troisième rang après
le Pakistan (27 000 t) suivi de près par le Mozambique (10 000 t).
Figure 13 : Répartition des captures par pays au niveau de l’Océan Indien ouest
(Source : FISHSTAT-FAO, moyenne 1997/98/99)
32
3.1.2. Le commerce
Par rapport aux autres produits de la pêche, les crevettes sont largement
commercialisées sur le marché international. Ces dernières années, 25 à 30% de la
production de crevettes (pêche et élevage) sont rentrés dans les circuits commerciaux
internationaux. Les échanges commerciaux ont continué de progresser légèrement
malgré les difficultés à absorber l'
accroissement de la production de crevettes. Le
volume des exportations a dépassé un million de tonnes depuis 1995 (figure 14), soit
près du double du poids commercialisé en 1985. En 1999, les exportations mondiales
de crevettes représentent plus de 8 milliards de dollars US.
Figure 14 : Evolution du commerce international et production mondiale de crevettes
(Source : FISHTAT-FAO, moyenne 1997/98/99)
En 1999, la Thaïlande a été le principal exportateur mondial de crevettes, avec 134 000
tonnes. L'
Inde figure aussi parmi les principaux fournisseurs mondiaux de crevettes
(108 000 t). Le troisième pays grand exportateur de crevettes est l'
Equateur (tableau 8).
Ces trois pays ainsi que l'
Indonésie et le Vietnam assurent près de la moitié du marché
mondial de crevettes. Les Etats-Unis d'
Amérique et le Japon absorbent environ 50%
des importations mondiales de crevettes. Madagascar est en tête des fournisseurs en
importations françaises de crevettes tropicales suivi de loin par le Brésil (source CFCE).
Dans certains pays comme Madagascar, le commerce de crevettes constitue un apport
en devises étrangères vital pour l'
économie nationale.
33
Tableau 8 : Exportation et Importation de crevettes des principaux Pays
Pays
Importation (t)
Exportation (t)
134 225
Etats-Unis d'
Amérique
270 446
108 315
Japon
251 367
105 731
Espagne
90 253
95 188
France
56 011
63 999
Danemark
49 535
44 819
Canada
43 193
43 769
Italie
34 631
40 180
Royaume-Uni
30 741
32 095
Chine, RAS de Hong Kong
21 557
27 716
Belgique
21 054
27 066
Pays-Bas
19 143
22 003
Prov. chinoise de Taiwan
16 565
17 224
Chine
15 303
17 187
Islande
15 131
15 246
Thaïlande
13 650
14 496
Norvège
13 559
13 650
Portugal
11 871
13 500
Allemagne
10 787
12 835
Australie
9 320
11 481
Suède
8 634
10 649
République de Corée
6 281
189 351
Autres
45 442
1 060 724
1 054 474
Source : FISHSTAT-FAO (la différence entre les totaux constitue la quantité ré-importée
par certains pays)
Pays
Thaïlande
Inde
Equateur
Indonésie
Vietnam
Danemark
Chine
Mexique
Groenland
Canada
Bangladesh
Pays-Bas
Pakistan
Royaume-Uni
Argentine
Belgique
Australie
Malaisie
Philippines
Panama
Madagascar
Autres
3.2. SYSTEME D’EXPLOITATION MALGACHE : caractéristiques et aperçu
historique
Le système d’exploitation est composé de trois segments : la pêche industrielle, la
pêche artisanale et la pêche traditionnelle (annexe 2). Cette distinction est fondée à la
fois sur des dispositions légales mais aussi sur des pratiques de pêche différentes.
3.2.1. La pêche industrielle
Les premières informations sur les Pénéides malgaches et leurs possibilités de
chalutage apparaissent dans la littérature à la suite des traits réalisés en 1951 sur les
côtes nord-ouest par "GABRIEL-II" (Fourmanoir, 1952), puis des prospections
effectuées de 1958 à 1960 par l'
"ORSTOM-I", le "MARANATHA" et l'
"ALEXIS
LALANNE" (Crosnier et al., 1958, Crosnier, 1965). Les espèces Fenneropenaeus
indicus, Penaeus monodon et Metapenaeus monoceros y sont signalées, des fonds
chalutables sont identifiés et des rendements intéressants sont enregistrés. Il faut
toutefois attendre les prospections effectuées sur une base commerciale par le
"CHIDORIGO" en 1964 (Vincent-Cuaz, 1964) et le "BIBELOT" en 1966 (Vincent-Cuaz,
1966) pour que l'
intérêt d'
une pêche par chalutage s'
affirme. L'
exploitation industrielle
ne débute réellement qu'
en 1967 sur la côte nord-ouest et dans la région de
Morondava. Par ailleurs, les essais de chalutage sur la côte est ne débutent que plus
tardivement, vers la fin des années 70.
34
De 1967 à 1975, quatre sociétés de pêche exploitent la ressource crevettière malgache
: la SIPMAD (Société Industrielle de Pêche de Madagascar), la SOMAPECHE (Société
Malgache de Pêche), la GPO (Grande Pêcherie de l'
Ouest) et les PNB (Les Pêcheries
de Nossi-Be). En 1970, les 5 navires pêchant dans la région de Morondava quittent
cette zone pour travailler sur la côte nord-ouest. A partir de 1971, certains navires
commencent à exploiter régulièrement les fonds au Sud du Cap St André (côte sudouest). Par la suite, cette activité ne cesse de se développer par l'
implantation des
nouvelles sociétés, l'
augmentation du nombre de bateaux (gel d’octroi de licence de
pêche depuis 1999) et la durée de pêche et l'
amélioration de l'
efficacité de pêche.
Le chalutage commercial des crevettes ne devient effectif sur la côte Est qu'
en 1981,
par la REFRIGEPECHE. La société débute ses activités avec 2 chalutiers congélateurs.
L’exploitation est concentrée initialement dans la Baie d'
Antongil et d'
une façon plus
générale au nord de Toamasina. La découverte de nouveaux fonds de pêche situés
plus au sud, jusqu'
à la hauteur de Mahanoro, est plus récente.
Les différentes étapes d’installation ou de restructuration de l’industrie crevettière
malgache suivent les circonstances historiques de l’économie nationale (tableau 9).
L’exportation des produits de culture de rente (la vanille et le café) a été sujette à des
problèmes liés aux fluctuations des cours mondiaux. La politique de diversification des
produits d’exportation en misant sur les produits halieutiques favorise le développement
du secteur pêche industrielle crevettière.
Tableau 9 : Les circonstances historiques et les évènements marquants de la pêche
industrielle crevettière malgache
Années de Les circonstances
Evènements marquants
référence
historiques
1967-1968 Industrialisation du système de Implantation des sociétés industrielles
production
1978-1980 Politique d'
investissement à
Installation de nouvelles sociétés de pêche
outrance
1985-1986 Structuration de l'
ensemble des Reconversion des autres sociétés de pêche
activités halieutiques
en exploitants crevettiers : RefrigepêcheOuest (crabes), Groupe KALETA (langoustes),
…
1992-1993 '
'
Capitalisme sauvage'
'
Multiplication des sociétés dont certaines sont
éphémères ; comme SOVOREX, SIPA, BEST
FISHER, MAZAVA sarl, …
1995-1996 Renforcement des capacités de Création du '
'
Groupement des Aquaculteurs et
gestion du secteur
des Pêcheurs de Crevettes de Madagascar'
';
le GAPCM
2000-2001 '
'
Mises aux normes
Regroupement des sociétés existantes
européennes'
'
(groupes UNIMA, SOCOTA, SOMAPECHE,
REFRIGEPECHE
La pêche industrielle fait appel à des chalutiers de taille importante et possédant un
équipement électronique conséquent (sondeurs, radars, équipement de
télécommunication, …). Ces unités utilisent un gréement de type floridien et peuvent
être classées en 3 catégories selon leur longueur, puissance, moyen de conservation et
autonomie en mer :
35
Chalutiers glaciers, de 15 à 17 m de LHT 8, équipés d’un moteur principal de 150
à 270 cv, qui ne sont pas équipés de moyen de réfrigération à bord mais utilisant
de la glace pour le stockage des produits. Leur autonomie ne dépasse pas une
semaine.
Chalutiers semi-congélateurs, de 23 m de LHT, équipés d’un moteur principal de
270 cv, qui effectuent des marées de 18 jours en moyenne et font des crevettes
en vrac congelées en saumure qui seront triées et calibrées à l'
usine
Chalutiers congélateurs de 26 à 30 m de LHT, équipés d’un moteur principal de
400 à 500cv, qui effectuent des marées de 20 à 30 jours. Ils sont équipés de
tunnel de congélation et généralement font des produits finis à bord.
Depuis la campagne 2001, les chalutiers-glaciers opérant dans la zone nord ont été
remplacés par des chalutiers-congélateurs de puissance totale équivalente.
Un essai de remplacement du système de congélation en vrac par saumurage utilisé
par les chalutiers dits ‘’semi-congélateurs’’ par le système à tunnel de congélation avait
été fait en 2002, mais les résultats ne sont pas satisfaisants.
Cette pêche est pratiquée entre 5 m et 30 m de fond et concerne principalement les
crevettes adultes.
3.2.2. La pêche artisanale
A la fin des années 60, des essais de pêche par des mini-chalutiers dits "catchers" ont
été entrepris par la Division des Pêches maritime de Mahajanga. Cette initiative de
l'
administration avait initialement pour raison de substituer progressivement la pêche
traditionnelle à la pêche artisanale.
Une société familiale, MARIE THERESE, créée en 1976 et basée à Nosy Be exploite
les crevettes dans la Baie d’Ambaro et dans la Baie de Narindra avec ses trois
chalutiers glaciers. Cette société est associée depuis 1999 à la Société DONNE & Fils,
actuellement dénomée Dieudonné-PNB pour la branche des activités de pêche et de
collecte des crevettes.
La société Précoopérative-AVOTRA basée à Nosy Be, exploite également les crevettes
de la zone de la Baie de Narindra avec ses deux chalutiers glaciers.
A noter que le bateau de la société HASSANALY HELY (basée à Nosy Be) ne fait
pratiquement pas la pêche, mais assure la collecte des produits auprès des pêcheurs
traditionnels.
La SOGEDIPROMA (Société Générale de Distribution des Produits Marins), créée en
1988 et basée à Mahajanga, fait la pêche par chalutage de crevettes, la capture à la
ligne de poissons de fond et la collecte des crevettes et des crabes capturés par les
pêcheurs traditionnels dans la baie de Narindra.
Depuis 1996, la société PECHEXPORT exploite les zones proches du port de
Mahajanga ; particulièrement les fonds de pêche de la baie de Baly (Soalala).
Dans les zones sud, l’exploitation du type artisanal apparaît tardivement. Ce n’est que
depuis 1996 que les chalutiers de la SOPEMO (Société de Pêcherie de Morondava)
commencent à exercer ses activités dans les zones proches du port de Morondava.
La pêche artisanale par chalutage fait une timide apparition en 1992 sur la côte Est,
plus précisément dans la baie d'
Antongil avec 2 mini-chalutiers mais l'
opération est
abandonnée par son promoteur 2 ans plus tard.
8
LHT : Longueur hors tout
36
Les pêcheurs artisans utilisent des mini-chalutiers dont la taille avoisine les 10 mètres
pour une puissance motrice maximale autorisée de 50 cv. Avant 1994, la puissance
motrice maximale autorisée pour ce type de pêche était de 25cv.
Les mini-chalutiers sont soit équipés de gréement type floridien (avec tangon), soit
pratiquent la pêche arrière selon le type de bateau. Ils ont généralement un équipage
de 4 à 5 hommes. La durée d’une marée est de 3 à 4 jours. Ils chalutent généralement
très près de la côte et dans les estuaires. La pêche artisanale s’exerce en deçà de 10 m
de fond et concerne principalement les crevettes sub-adultes.
Les crevettes sont en majorité étêtées à bord, conservées en vrac sous glace puis
débarquées dans les usines à terre pour les traitements nécessaires à l’exportation.
Généralement, les usines appartiennent à la filière industrielle.
Il arrive que les infrastructures portuaires soient insuffisantes et que les armateurs
artisanaux soient obligés de collaborer avec les armateurs industriels
(Andriambalotiana, 1996). Ainsi, certains armateurs de la pêche artisanale sont affiliés
aux armateurs de la pêche industrielle, à qui ils livrent leurs produits destinés à
l’exportation.
A noter également que certaines sociétés exploitant des chalutiers industriels arment en
parallèle des unités de type artisanale, notamment pour le cas des sociétés
PECHEXPORT et Les Pêcheries du Menabe et du Melaky.
3.2.3. La pêche traditionnelle
La capture des crevettes au moyen des "Valakira", dans les zones de balancement des
marées, existe depuis fort longtemps sur les côtes ouest et nord-ouest de Madagascar.
L'
expansion de ce type de pêche a commencé en 1974, année où des sociétés de
collecte se sont installées surtout sur la côte nord-ouest. Autrefois, les produits de ces
activités étaient tout simplement bouillis, séchés et ensuite acheminés vers les centres
de consommation de l'
arrière-pays. Avec le développement de la pêche crevettière,
certaines sociétés collectent les produits de ces pêches et les écoulent soit sur le
marché local soit sur le marché extérieur.
Un aperçu de l’exploitation de la pêche traditionnelle à Madagascar est décrit par
Chaboud et al. (2002). Les pêcheurs traditionnels exercent leurs activités au moyen de
pirogues en général non motorisées d'
une longueur de 4 à 9 mètres et demeurent
localisés à l'
intérieur des baies ou des estuaires. La pêche est pratiquée dans les zones
de balancement des marées (pêche au '
'
Valakira'
'
, au '
'
Poteau'
'
), dans les zones de
plage (les sennes de plage, les '
'
Kopiko'
'
), dans les petits fonds allant jusqu'
à 10 à 15 m
(les sennes encerclantes ‘’Koakobe’’, les filets maillants ‘’Periky’’). La pêche
traditionnelle capture principalement les crevettes au stade juvénile.
Les engins de pêche utilisés pour la capture de crevettes sont variés :
Les "Valakira" (barrage de fascines, débouchant sur une chambre de capture)
sont des barrages côtiers en forme de "V" implantés dans la zone de
balancement des marées. La pêche aux ‘’Valakira’’ est une activité importante le
long de la baie d’Ambaro (zone nord).
Les sennes regroupent les filets sans poche (‘’Kaokobe’’ et ‘’Taritarika’’dont la
technique de mise en œuvre est d'
encercler le banc de crevettes repéré.
Les "Poteau" se présentent comme un chalut à l’étalage.
Les "Kopiko", dans sa forme et dans sa technique, reprend le principe de chalut.
Il revêt l’aspect d’une poche d’ouverture rectangulaire.
Les filets maillants à crevettes ("Periky")
37
3.3. EVOLUTION DE LA FLOTTILLE
3.3.1. Les navires industriels
Côte ouest :
La pêche industrielle commerciale a commencé en 1967 sur la côte ouest avec une
flotte de 5 chalutiers glaciers et un chalutier congélateur. Depuis 1970, l'
effectif de la
flottille a augmenté rapidement pour atteindre 44 bateaux en 1974 ; composés de 30
Congélateurs et 14 Glaciers. Jusqu'
en 1984, l'
effectif de la flotte s'
est stabilisé aux
alentours de 40 navires. Depuis 1985, l'
effectif a, à nouveau, augmenté d'
une façon
progressive pour atteindre une cinquantaine de navires depuis 1988. A signaler qu'
en
1993, 14 bateaux grossissent le rang de la flotte crevettière, mais seulement pendant
quelques mois car la plupart des licences octroyées sont retirées à la fin de la même
année. En 1997, l’effectif de la flotte crevettière atteint les 60 unités (figure 15a).
La taille et la puissance des bateaux évoluent parallèlement à l'
accroissement de
l'
effectif. De 1968/69 à 1974/75 la puissance moyenne des bateaux passe du
simple(160 cv) au double (312 cv). Depuis 1980, cette moyenne oscille autour de 400
cv (figure 15b).
Figure 15 : Evolution de l’effort nominal sur la côte ouest (pêche industrielle)
(Source : Données Marcille, 1978, données Archives CNRO, données BANACREM)
38
Côte est :
Le début de la pêche industrielle sur la côte est remonte à 1981 avec un chalutier de
450 cv. Un autre navire de 150 cv s'
ajoute à celui-ci en 1984. En 1987, l'
entrée d'
un
bateau de 1 250 cv dans la pêcherie fait augmenter la puissance moyenne à 617 cv
(figure 16b). Cette augmentation de la puissance moyenne des navires n’induit pas
directement une augmentation de la puissance de pêche. En effet, une partie de la
puissance est absorbée pour produire le froid nécessaire pour la congélation et le
stockage des produits finis à bord.
Le nombre de navires en activité passe à 4 en 1992, puis à 5 vers la fin de l'
année
1995. L'
augmentation des effectifs de la flotte en 1996 et 1997 correspond à la période
d'
activité des bateaux de la société AQUAMEN sur la côte est. Depuis 1998, ces
bateaux sont transférés sur la côte ouest. Actuellement, le nombre de navires
opérationnels sur la côte est est de six (figure 16a).
Il faut signaler la présence des chalutiers chinois ayant opérés de façon sporadique en
1994. Ces bateaux qui n'
ont travaillé que de façon marginale sur cette côte ne sont pas
pris en compte dans les effectifs présentés.
Figure 16 : Evolution de l’effort nominal sur la côte est (pêche industrielle)
(Source : Rakotozanany, 1996 et données BANACREM)
3.3.2. Les mini-chalutiers (pêche artisanale)
Deux navires opèrent marginalement dans la baie d'
Antongil de 1992 à 1994.
Aujourd'
hui, la pêche artisanale est pratiquée uniquement sur la côte ouest.
39
Les mini-chalutiers sont, le plus souvent, des embarcations à faible tirant d’eau et
travaillant entre les isobathes 1,5 et 10 m (Rabearintsoa, 1998). Les bateaux s’éloignent
peu de leur port d’attache, ils se concentrent à Nosy Be, Mahajanga et Morondava.
Sur la côte ouest, le nombre de "catchers" opérationnels est passé de 3 en 1973 à 6 en
1975 et à 19 en 1990. En 1993, le secteur a vu son effectif renforcé par des nouveaux
bateaux que l’on peut qualifier de ‘’flotte occasionnelle’’ car la plupart d’entre eux vont
disparaître l’année suivante (Rakotozanany, 1996).
En 1995, on dénombre 24 navires opérationnels sur les 34 licences octroyées. L’effectif
de la flotte opérationnelle remonte à 37 en 1998 (figure 17). Ce nouveau dynamisme du
secteur artisanal est dû en partie à l’affiliation des sociétés artisanales à des sociétés
industrielles. Actuellement, le nombre de mini-chalutiers opérationnels est de 20.
Figure 17 : Evolution du nombre de bateaux artisanaux
(Source : Rakotozanany, 1996, Rabearintsoa, 1998 et données BANACREM)
3.3.3. Les engins de pêche traditionnelle
Les engins de pêche les plus utilisés sont les ‘’Valakira’’ et les filets maillants (et
récemment les filets à l’étalage).
Le long de la baie d’Ambaro, un maximum du nombre de ‘’Valakira’’ avait été signalé en
1975 sous l’impulsion des nombreuses sociétés de collecte nouvellement installées
dans la région. Cet effectif maximum ne dure pas longtemps à cause de l’insuffisance
de collecteurs. Dans les années suivantes, l’effectif des ‘’Valakira’’ augmente petit à
petit parallèlement à l’intensification des investissements en pêche crevettière
industrielle. L’enquête la plus récente estime le nombre total de ‘’Valakira’’ le long de la
baie d’Ambaro à 386 (figure 18). A noter que, compte tenu de la surface utilisable (zone
de balancement des marées), il semble que ce maximum ne puisse être dépassé. Si
cette évolution est limitée spatialement pour les ‘’Valakira’’ (d’ailleurs ils sont
superposés par les filets à l’étalage) celle du filet maillant est remarquable. Ces
dernières années, l’augmentation de l’effort de pêche est caractérisée par
l’accroissement exponentiel des filets maillants et filets à l’étalage.
40
Les derniers recensements réalisés par le PNRC donnent les effectifs de pêche
suivants (Domalain et al., 2001) :
Dans la zone nord-ouest s’étandant du Cap St Sébastien au nord au Cap St
André au sud : 720 unités de "Valakira", 390 unités de "senne", 200 unités de
"Kopiko" et 250 unités de filet maillant
Dans la zone sud-ouest couvrant la partie sud du Cap St André jusqu’à
Morombé : 800 unités de ‘’petite senne’’
Les échantillonages réalisés sur les filets à l’étalage montrent que ces filets ne sont pas
sélectifs et ils ne laissent pas passer à travers leurs mailles (également colmatés de
végétaux) les crevettes de très petites tailles. Les pêcheurs de la baie d’Ambaro sont
actuellement conscients de la nature destructive de ces filets et ils sont prêts à arrêter
cette pratique de pêche.
Figure 18 : Evolution du nombre de ‘’Valakira’’ dans la baie d’Ambaro (Source :
Rabarison, 1984 ; Rasoarimiadana, 1985 ; Bellemans,1989 et Domalain et al., 2001)
3.4. EVOLUTION DES CAPTURES ET DES RENDEMENTS
Les productions sont exprimés ici en équivalents crevettes entières.
3.4.1. Les débarquements de la pêche industrielle
La capture industrielle de crevettes est estimée par le Service statistique du Ministère
des pêches à 9 900 t en 1998, 7 800 t en 1999 et 8 300 t en 2000 (Anonyme, 2001a).
Globalement elle représente 72% de la production totale en crevettes de pêche9. La
campagne de pêche 1999 s'
est traduite par une baisse des captures d'
environ 16% par
rapport à l'
année précédente. Ceci constitue l'
une des plus mauvaises campagnes des
cinq dernières années qui pourrait trouver son origine dans une météorologie
capricieuse et des pluviométries insuffisantes, se traduisant par des conditions
estuariennes défavorables au recrutement des juvéniles. A noter également l’arrêt des
exportations suite à une épidémie de choléra survenue à Madagascar au mois de mars
1999, mais les armateurs s’étaient préparés par le programme de mises aux normes
européennes et la situation est rapidement maîtrisée. La campagne 2000 apparaît
9
Par ailleurs, la production industrielle de l'
aquaculture de crevettes était de 3 486 t en 1999 (837 ha) et
de 4 800 t en 2000 (1 022 ha) ; d’apès le Service statistique du Ministère des pêches.
41
légèrement meilleure mais ne parvient pas à rattraper l'
année 1998 qui est considérée
comme une année exceptionnelle.
Côte ouest :
L'
évolution des captures fait apparaître quatre périodes différentes dans l'
histoire de
cette industrie (figure 19a).
• Période de 1967 à 1969 : Augmentation rapide de la production.
L’évolution des débarquements de crevettes montre une hausse jusqu’à 1971. Cette
situation d'
augmentation rapide de la production est due à l'
amélioration de l'
efficacité
de pêche. Pendant cette période, l’augmentation de l’effort s’accompagne d’une
augmentation des rendements en passant de 112 t/bateau/an à 272 t/bateau/an ;
caractéristique d’une pêcherie qui était encore vierge.
• Période de 1970 à 1982 : Stabilité de la production
L’augmentation de l’effectif de la flottille, de 7 chalutiers à 19 chalutiers, a provoqué une
chute de rendement en 1970. Pendant cette période la production annuelle globale
fluctue autour de 4.500 tonnes à 5.000 tonnes malgré une intensification de l’effort de
pêche.
• Période de 1983 à 1987 : Nouvelle augmentation rapide de la production
La production s’accroît de 5 000 t en 1983 à 7 700 t en 1987. Cette augmentation
s'
explique par l'
extension de la pêcherie vers les zones sud. Pendant cette période, le
rendement s’est amélioré en passant de 115 t/bateau/an à 165 t/bateau/an.
•
Période de 1988 à 2000 : Nouvelle situation de stagnation de la
production autour de 8.000 tonnes.
Le rendement annuel par bateau se stabilise aux environs de 150 t/bateau/an. La
pêcherie est pleinement exploitée (Moguedet et al., 2001).
Côte est
L’évolution des captures et des rendements de crevettes sur la côte est montre une
hausse jusqu’en 1996 et atteint les 500 tonnes avec un rendement de près de 100
t/bateau/an (figure 19b). Les rendements se sont effondrés en 1996/1997 (40
t/bateau/an) sans doute à cause d’un doublement de l’effectif de la flottille. Depuis
1998, après le tranfert des bateaux supplémentaires vers la côte ouest, les rendements
s’améliorent petit à petit pour atteindre leur niveau d’avant 1996.
42
Figure 19 : Evolution des captures et rendements en crevettes (Source : Données
Marcille, 1978 ; Données CNRO et Données BANACREM)
- Notons qu’ici seul les données figurées dans BANACREM sont prises en compte,
tandis-que l’estimation des productions annuelles avancée par le Service statistique du
Ministère cumule diverses sources de données 3.4.2. Les débarquements de la pêche artisanale
La pêche artisanale est une activité récente et en croissance (figure 20), mais dont la
contribution à la capture totale reste modeste (de l’ordre de 4% de la production globale
annuelle). Il faut signaler que ce segment de la pêche est très disparate : des
armements aux navires très rustiques (Nosy Be et Mahajanga) aux armements gérés
de manière quasiment industrielle (Morondava). La production est estimée à 520 t en
1998, 480 t en 1999 et 460 t en 2000. (Anonyme, 2001).
Les statistiques retenues officiellement pour la pêche artisanale débutent en 1985.
L’évolution des captures de 1985 à 2000 montre une tendance à la hausse. La pêche
43
artisanale a connu une baisse de rendement jusqu’en 1988, puis se stabilise autour de
10-15 t/bateau/an depuis le début des années 1990. Le niveau de rendement remonte à
nouveau à partir de l’année 1997.
Figure 20 : Evolution des captures et rendements de la pêche artisanale (Source :
Rakotozanany, 1996 ; Rabearintsoa, 1998 ; données BANACREM)
- Notons qu’ici seul les données figurées dans BANACREM sont prises en compte,
tandis-que l’estimation des productions annuelles avancée par le Service statistique du
Ministère cumule diverses sources de données 3.4.3. Les débarquements de la pêche traditionnelle
La production moyenne annuelle est estimée à environ 3.400 tonnes de crevettes, soit
24% de la production globale du secteur. La région de la baie d’Ambaro contribue à elle
seule à 56,2% de la production totale de la pêche traditionnelle provenant en grande
partie des ‘’Valakira’’, des ‘’Kaokobe’’ et des ‘’Periky’’ (Domalain et al, 2001).
L’évolution de la production des ‘’Valakira’’ montre une augmentation des captures et
rendements jusqu’en 1973. L’augmentation galopante de l’effectif de cet engin en
1974/1975 ne se traduit que par une légère augmentation de la capture totale au début
et a pour conséquence une chute brusque des rendements moyens (figure 21). La
diminution de la capture totale quelques années plus tard est due en grande partie au
problème de débouché plutôt qu’à une diminution réelle de l’abondance. Au milieu des
années 80, la pêche aux ‘’Valakira’’ s’accroît avec l’augmentation du nombre des
collecteurs sur place.
44
Figure 21 : Evolution des captures et rendements moyens de la pêche aux ‘’Valakira’’
dans la baie d’Ambaro (Source : Rabarison, 1984 ; Rasoarimiadana, 1985 ;
Razafindrainibe et al., 1995 ; Domalain et al., 2001)
3.5. COMPOSITION ET SAISONNALITE DES CAPTURES
Pour la pêche industrielle, trois espèces de crevettes constituent l’essentiel des prises. :
Fenneropenaeus indicus (White), Metapenaeus monoceros (Pink, Brown, Calendre) et
Penaeus semisulcatus (Tiger, Brown). Au début de l'
exploitation industrielle les
captures étaient constituées à 94% en poids par Fenneropenaeus indicus (Marcille,
1978). En 1973/74, la proportion baisse à 67% au profit de Metapenaeus monoceros.
Malgré une légère remontée en 1977, les captures industrielles de Fenneropenaeus
indicus diminuent légèrement pour atteindre le niveau actuel de près de 64% sur la côte
ouest. Sur la côte est, Metapenaeus monoceros représente 52% de la capture et
viennent en seconde position les Fenneropenaeus indicus qui représentent 43% de la
capture totale (Moguedet et al., 2001).
Toussaint et al. (1994) ont avancé la proportion de 51% en 1991 et 60% en 1992 pour
Fenneropenaeus indicus en analysant les données de la zone nord et sud-ouest de
Madagascar. Ces auteurs ont indiqué également que Metapenaeus monoceros
représente 22% de la capture et 18% pour Penaeus semisulcatus au cours de l’année
1992.
Au niveau de la pêche traditionnelle, près de 90% des captures totales sont constituées
de Fenneropenaeus indicus (Marcille et Stequert, 1974 ; Razafindrainibe et al., 1994 ;
Moguedet et al., 2001). Pour la pêche aux ‘’Valakira’’ en baie d’Ambaro, F. indicus
représente 73% de la capture, suivi de loin par Penaeus monodon et Metapenaeus
stebbingi qui représentent respectivement 11% et 10% de la capture totale
(Rasoarimiadana, 1985).
Il faut noter que malgré sa faible proportion dans le volume des captures Penaeus
monodon a son importance en raison de sa valeur unitaire élevée et représente l’unique
espèce de crevette d’aquaculture rencontrée à Madagascar. Nous n’avons pas
suffisamment de données pour l’étude des paramètres biologiques de cette espèce.
Toutefois, nous essayons d’analyser les données de cette espèce dans le chapitre sur
l’étude des variations spatio-temporelles des captures (cf. § 5.2.5.).
45
Dans les zones ouvertes à tous les armements, la saisonnalité des captures de la
pêche chalutière est très marquée. Plus de 50% des crevettes sont pêchés dans les 3
premiers mois de la campagne (de février à avril). En début de campagne, les
chalutiers travailleraient à la limite de leur capacité technique d'
exploitation.
Il faut signaler que depuis 1972, les navires augmentent leur temps de chalutage de
nuit, et donc l’effort appliqué aux stocks de P. semisulcatus et de M. monoceros.
Fenneropenaeus indicus, essentiellement capturée le jour, Metapenaeus monoceros et
Penaeus semisulcatus, essentiellement capturées de nuit présentent un comportement
grégaire en début d’année et un comportement diffus en fin d’année (Marcille, 1978).
Toute espèce confondue, la pêche du jour donne un rendement plus élevé que la pêche
de nuit pendant la haute saison. La différence est moins nette pendant la basse saison
et pourrait être inversée.
Les variations liées au rythme des marées et aux phases lunaires sont surtout nettes
pour la pêche traditionnelle où les captures sont effectuées pendant les reflux. Les
barrages côtiers fonctionnent durant les périodes de vives eaux et en dehors de la
saison des crues.
3.6. EVOLUTION DE LA GESTION DE LA RESSOURCE
La gestion des pêcheries crevettières a été initialement et jusqu’aux environs de 1980
basée sur les résultats des travaux de l’ORSTOM (dénommé actuellement IRD), puis
sur les recherches complémentaires du Centre National de Recherches
Océanographiques (CNRO) de Nosy Be. Depuis 1997, les travaux de recherche relatifs
à la pêche crevettière sont confiés à la cellule de recherche basée à Mahajanga, le
Programme National de Recherche Crevettière (PNRC). Celui-ci est un programme de
recherche finalisée pour le compte de la filière pêche crevettière qui vise à conforter les
bases scientifiques de la prise de décision, pour le développement et la gestion durable
de l’ensemble des composantes de la pêcherie crevettière.
Du point de vue constitutionnel de l’Etat malgache, l’exercice des compétences en
matière de définition du régime des ressources marines relève, de façon exclusive, du
pouvoir central. Le Ministère chargé de la Pêche et de l’Aquaculture assure la gestion
de l’exploitation des ressources crevettières ; définies parmis les ‘’ressources
stratégiques’’. Le Groupement des Aquaculteurs et Pêcheurs de Crevettes de
Madagascar (GAPCM), créé en 1994, intervient également dans le cadre de la gestion
de la pêcherie. Un projet d'
aménagement concerté "Zones d'
Aménagement Concerté
(ZAC)" de la pêche crevettière est prévu visant à une gestion durable de la ressource,
associant les différents segments de la pêcherie, et visant également une
responsabilisation de l'
interprofession dans la conduite des opérations d'
exploitation, de
valorisation et de commercialisation du produit.
La capacité de contrôle et de surveillance a été renforcée depuis que le MPRH dispose,
grâce à l’appui de l’Union européenne, d'
un Centre de Surveillance des Pêches (CSP)
pour la mise en application des mesures réglementaires. Depuis l’année 2001, tout
chalutier crevettier doit s'
équiper d’une balise satellitaire avec système Argos ou
Inmarsat. Egalement, les navires autorisés doivent embarquer, à la demande du CSP,
un observateur à bord pour le suivi des activités de pêche.
46
Des mesures de gestion de la pêcherie ont été mises en place axées sur les deux
groupes classiques des méthodes d'
aménagement : le contrôle de l'
effort de pêche et le
contrôle des engins de capture (maillage et dimensions).
Le contrôle de l’effort de pêche passe par différents outils : la définition du nombre de
licences, leur affectation à des zones, le choix de la période d’ouverture de la pêcherie.
La mise en place d’un observatoire économique des pêches auprès de l’Administration,
appuyé par les professionnels et les bailleurs de fonds étrangers, devrait doter le
système de gestion d’indicateurs économiques qui permettront d’évaluer plus
objectivement les performances sectorielles et des firmes halieutiques.
Pour la pêche chalutière la réglementation limite la longueur totale des cordes de dos
des chaluts à 77 m par bateau et le maillage étiré à 40 mm (valeur minimale).
Une fermeture de la pêche chalutière crevettière a été appliquée pour la première fois
sur les côtes nord-ouest en 1973. Depuis 1985, cette mesure a été appliquée sur toute
l’étendue de la façade occidentale malgache. La fermeture annuelle de la pêche
crevettière sur la côte ouest (du début de décembre à mi-février) vise à protéger les
juvéniles, à augmenter la biomasse disponible lors de l'
ouverture de la pêche et surtout
à accroître la valeur tirée de l'
exploitation en profitant de la croissance très rapide des
pénéides. En effet l’augmentation de prix en fonction de la taille des individus est très
marquée. La campagne est ouverte pendant toute l'
année sur la côte est. Une étude
sur la détermination de la date d’ouverture de la pêche par l’application de la méthode
d’extrapolation des données recueillies pendant les semaines précédentes à la date
d’ouverture habituelle a été initiée par le PNRC avant l’ouverture de la campagne 2000
sur tout l’ensemble de la côte.
Un mode d’encadrement de l’accès à la pêcherie existe à Madagascar sous la forme
d’un régime de licences 10. La gestion de ce secteur est basée sur des limitations du
nombre de navires autorisé à pêcher dans les zones d’aménagement délimitées par
l’Administration (figure 22). Depuis 1986, LES PECHERIES DE NOSSI-BE et la
SOMAPECHE bénéficient de l’exclusivité pour le chalutage de la crevette dans la zone I
et les zones II à V respectivement, comme une allocation de droits de pêche
territoriaux. Les résultats du groupe de travail sur l’aménagement des pêcheries de
crevette côtière du nord-ouest de Madagascar qui a eu lieu au CNRO en 1989 ont
confirmé l’hypothèse théorique que l’instauration des zones exclusives est l’un des
meilleurs systèmes de gestion des stocks halieutiques relativement sedentaires comme
les crevettes. La pêche chalutière dans les zones VI à X n’est pas régie par ce système
de droits exclusifs. Les caractéristiques techniques des navires et les stratégies
d’exploitation dans les zones communes ont considérablement évolué au cours des
années. Ceci avait pour conséquence d’accroître les efforts effectifs locaux.
Avant l’année 2000 la pêche par chalutage est subordonnée à la possession d’une
licence de pêche attribuées aux bateaux d’une part, et à un certain nombre
d’autorisations de pêche par zone attribuées annuellement à chaque armement d’autre
part. Le Comité Interministériel des Pêches, organe de gestion de l’industrie crevettière
malgache, se réunit ordinairement avant l’ouverture de la pêche pour déterminer le
nombre d’autorisations à attribuer correspondant à chaque zone ainsi que la répartition
entre les différents armements. Ces nombres sont fixés chaque année par un arrêté
ministériel. Les scientifiques jouent le rôle de Conseiller aux différentes réunions du
10
Citons quelques pratiques utilisées dans d’autres pêcheries : TAC (capture totale admissible), Quotas
individuels, Droits territoriaux, …
47
Comité. Le nombre maximum de chalutiers titulaires de licences autorisés à pêcher
dans chaque zone (zone 1 à 10 sur la côte ouest) est fixé par armement (tableau 10).
a) avant l’année 2000
b) après l’année 2000
‘’Les carrés statistiques suivant le carroyage de 20’ X 20’ sont codés de 3 caractères composés
d’une lettre suivie de deux chiffres, par exemple G15’’
Figure 22 : Zone d’aménagement des pêches crevettières (Source : PNRC)
Tableau 10 : Répartition par société et par zone des autorisations de chalutage aux
crevettes sur la côte ouest - année 1998
Sociétés
Bateau
I
II
III IV
V VI
VIIIX-X TOTAL
VIII
LES PECHERIES DE
15 13
4
5
5
27
NOSSI-BE
SOMAPECHE
28
5
5
4
4
4
8
8
38
REFRIGEPECHE OUEST
5
2
2
3
3
10
PECHEXPORT
6
2
2
2
2
8
LES PECHERIES DU
3
2
2
4
MELAKY
Groupe KALETA
3
1
2
2
5
CRUSTAPECHE
2
1
1
2
4
COPEMAD
1
1
1
2
AQUAMEN
5
2
2
3
7
TOTAL
68 13
5
5
5 11 15
26
25
105
Source : Rapport d’activité annuel, 1998 du MPRH
48
En principe, le nombre d’autorisations alloué à chaque zone correspond à l’effort FMSY
11
basée sur l’étude effectuée par Marcille en 1978 et complétée par les évaluations
faites par le CNRO en 1991 (tableau 11). Après l’année 2000, le principe de répartition
de l'
effort de pêche a été modifié. La répartition des autorisations de chalutage par zone
de pêche et par société sont supprimées. A la suite des recommandations des
expertises effectuées sur le secteur et également au vu des résultats de l’atelier
national sur l’aménagement de la pêche crevettière, le principe de prudence est adopté
et en conséquence il a été décidé de geler le nombre de licences de pêche à son
niveau de 1998 (69 chalutiers sur la côte ouest, 6 chalutiers sur la côte est et 36
chalutiers artisanaux).
Ce nouveau système d’octroi de licence prévoit en particulier la création d’un droit de
pêche de 20 ans, transférable, la fixation des prix des redevances de pêche et la
répartition géographique de la pêche par le biais d’appels d’offres public sur
performances (Andrianaivojaona, 2001).
Depuis 2001, les 6 chalutiers-glaciers opérant dans la zone A ont été remplacés par 3
chalutiers-congélateurs de puissance motrice totale équivalente.
Les deux licences, de type C, non encore attribuées en début de campagne 2000 ont
été octroyées, depuis 2002 et de commun accord avec le GAPCM et le Ministère
chargé de la pêche, à un opérateur qui a d’ailleurs travaillé dans la zone depuis
quelques années. Le gel de l’effort de pêche a été appliqué et les résultats des travaux
d’évaluations des stocks en cours seraient attendus pour lever ou confirmer cette
situation.
Tableau 11: Répartition de l’effort de pêche par zone sur la côte ouest de Madagascar
a) avant l’année 2000
b) après l’année 2000
Zone
MSY (Fox)
Nombre
Type
Nombre.de Puissance
en tonnes
d’autorisations (1998)
licences
totale (cv)
1
1 377
13
A
8
3 800
2
745
5
B
10
3 140
3
349
5
4
401
5
5
751
11
6
1 055
15
C
48
21 160
7
725
26
8
823
9
372
25
10
1 267
TOTAL
7 865
105
TOTAL
66
28 100
Source :
Marcille, 1978
MPRH
Source :
MPRH
CNRO, 1991
3.7. FICHE DE PECHE STANDARD ‘’CREVETTES’’ - BANACREM ET SES
OBJECTIFS
La standardisation des fiches de pêche a été initiée en 1995 par l’Administration
chargée de la pêche. La fiche de pêche avec carroyage standard adoptée a été
présentée au cours de l’atelier sur l’aménagement de la pêche crevettière malgache de
1996. Les contenus de ces fiches sont à la base de BANACREM (BAse NAtionale sur
11
FMSY : Mortalité par pêche associée à la prise maximale équilibrée
49
les statistiques de la pêche CREvettière Malgache). Cette base de données a été mise
en place et gérée par l’Administration des Pêches depuis 1998 (cf. communication
Andriantsoa, atelier 1998). La base est prévue pour couvrir aussi bien la pêche
industrielle que la pêche artisanale. Par ailleurs, le Service statistique de
l’Administration suit les productions de la pêche traditionnelle à travers les fiches de
collecte.
BANACREM permet un archivage de l’historique de la pêcherie (structure de
l’exploitation) et des activités de la flottille (effort de pêche et capture). Les objectifs de
BANACREM sont de : (tels qu’ils sont présentés au cours de l’atelier)
Archiver des données sur plusieurs années permettant une analyse comparative
de l’exploitation
Disposer des résultats fiables et évolutifs par période
Mettre à la disposition de l’Administration un outil de gestion permettant une
prise de décision optimale pour la gestion de la pêche crevettière
Satisfaire les besoins des opérateurs en matière de statistiques des pêches tout
en garantissant un dégré de confidentialité des informations
BANACREM devrait être un outil opérationnel pour affiner les connaissances sur la
pêcherie, ainsi que pour identifier et caractériser des stratégies de pêche particulières
mises en œuvre.
Pour les décideurs et les professionnels, BANACREM permettrait d’avoir des synthèses
périodiques sur la conjoncture de la pêcherie comme la distribution de l’effort, l’origine
et le volume des captures et les rendements.
Certains aspects de la problèmatique scientifique de la recherche sont espérés
analyser à partir des données BANACREM, comme l’analyse spatio-temporelle des
données d’effort et de captures pour une meilleure compréhension de la dynamique des
flottilles et par là-même de celle de la ressource.
La pertinence des résultats extraits de la BANACREM dépend en premier lieu de la
qualité des informations qui y sont archivées. Il s’avère que cette qualité peut et doit
être encore améliorée. L’ensemble des parties (professionnels, administrateurs et
scientifiques) devraient réunir ses efforts pour le bon fonctionnement de cet outil.
CONCLUSION DE LA PREMIERE PARTIE
Cette première partie met en évidence que :
La côte ouest est une région à forte potentialité en crevettes.
Les fonds de pêche peuvent être subdivisés en trois grands ensembles
géographiques :
La zone nord-ouest s'
étendant du Cap St Sébastien au nord au Cap Saint
André au sud. Les estimations faites ont montré que cet ensemble de
zones possède une potentialité annuelle d'
environ 7 400 tonnes dont
4 600 tonnes pour la pêche industrielle et 2 800 tonnes pour la pêche
traditionnelle.
La zone sud-ouest couvrant la partie sud du Cap St André jusqu'
à
Morombe. Le potentiel annuel de cet ensemble se situerait aux environs
de 3 600 tonnes dont 3 400 tonnes pour la pêche industrielle et 200
tonnes pour la pêche traditionnelle.
50
La zone est qui s'
étend de la Baie d'
Antongil au nord à Mahanoro au sud.
On estime la potentialité de l'
ensemble de la zone à environ 530 tonnes
(450 tonnes pour la pêche industrielle et 80 tonnes pour la pêche
traditionnelle).
Ainsi, dans l’ensemble de la pêche crevettière malgache, la côte ouest
occupe une place prépondérante ; elle représente 95% de la potentialité
crevettière malgache évaluée entre 11 et 12 000 tonnes.
L’exploitation crevettière sur la côte ouest concerne essentiellement
trois espèces.
Fenneropenaeus indicus, Metapenaeus monoceros et Penaeus semisulcatus
constituent l’essentiel du débarquement total de la pêche crevettière sur la
côte ouest. Fenneropenaeus indicus représente la première espèce cible de
l’exploitation crevettière. La pêche de nuit vise essentiellement Penaeus
semisulcatus. Globalement, Metapenaeus monoceros représente la
deuxième espèce capturée après Fenneropenaeus indicus.
La crevette est une ressource très convoitée.
Exploitée par les pêcheurs individuels piroguiers, les petites entreprises
familiales, les sociétés industrielles et les groupes industriels, la crevette est
une ressource extrêmement convoitée. Le commerce international de la
crevette affiche une continuelle croissance. Cette situation a pour
conséquence, d’une part, un accroissement de l’effort de pêche
consécutivement à l’augmentation du nombre de bateaux de pêche ou
d’engins de pêche pour la pêche traditionnelle, d’autre part une
augmentation des puissances de pêche développées.
C’est une ressource fortement liée aux conditions du milieu.
Les espèces principalement exploitées à Madagascar ont une aire de
distribution étalée de 40° de latitude Nord jusqu’à 30° de latitude Sud. La
biologie des crevettes est dominée par plusieurs facteurs complexes
caractérisant les environnements dans lesquels elles vivent. Les
concentrations localisées des crevettes correspondent davantage à des
conditions environnementales. L’abondance relative, le comportement
migratoire estuaire-zone intertidale-mer, la croissance et le phénomène de
reproduction et recrutement seraient conditionnées par les facteurs du milieu.
Les captures et rendements en crevettes sur la côte ouest malgache
sont restés plus ou moins stables depuis le début des années 90.
Les phénomènes de surexploitation biologique des ressources crevettières
ne sont pas encore survenus sur les pêcheries malgaches par suite des
mesures de prudence sur l’augmentation de l’effort de pêche.
Les évaluations des stocks ainsi que les travaux d’expertises récents
démontrent la nécessité d’une situation de gel de l’effort de pêche, à son
niveau actuel, dans l’état des connaissances biologiques actuelles. Certains
paramètres biologiques doivent être revus ou estimés, ce qui affinerait la
valeur des évaluations des stocks faites sur la ressource crevettière. Ainsi,
nous nous sommes attachés à aborder cette étude dans la deuxième partie
de cette thèse.
51