Réseau trophique benthique et flux de contaminants - GIP Seine-Aval
Transcription
Réseau trophique benthique et flux de contaminants - GIP Seine-Aval
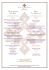
Réseau trophique benthique et flux de contaminants Hervé Rybarczyk, Laurence Ochs, Nicolas Loquet, Bernard Elkaim Introduction 77 1. Bilan énergétiques et composition biochimique 77 2. Les biomasses 80 2.1. Intertidal 80 2.2. Subtidal 80 3. Contamination et flux de Cadmium 81 3.1. Teneur en cadmium. 81 3.2. Flux de cadmium. 83 4. Réseau trophique benthique 84 4.1. Méthode et analyse 4.1.1. Réseau trophique 4.1.1.1. Les producteurs primaires 4.1.1.2. Le Zooplancton 4.1.1.3. La macrofaune benthique 4.1.1.4. Les poissons 4.1.1.5. Les Oiseaux 4.1.1.6. La Matière Organique Particulaire 84 84 85 87 89 91 93 94 5. Conclusions 97 Page 76 Réseau trophique benthique et flux de contaminants Hervé Rybarczyk, Laurence Ochs, Nicolas Loquet, Bernard Elkaim Laboratoire d'Hydrobiologie 12 rue Cuvier 75005 Paris Introduction L'année 1998 a permis de compléter les analyses biochimiques afin de déterminer les valeurs énergétiques en hiver et en été des principales espèces du benthos intertidal et subtidal ainsi que leurs principaux paramètre écologiques fonctionnels : respiration, excrétion et production. Ce travail avait deux objectifs ; 1) Réaliser en collaboration avec l'Université de La Rochelle une synthèse des flux de Cadmium transitant par ces espèces jusqu'au Bar et Flet 2) Proposer un premier bilan trophique sous la forme d'une ébauche de réseau trophique benthique. Le développement de ce réseau et son analyse fonctionnelle sera assurée dans une deuxième phase. 1. Bilan énergétiques et composition biochimique L'analyse des bilans énergétiques permet de fournir des valeurs de production en g/m²/an. Elle permet également de mettre en évidence pour Cerastoderma edule, Bivalve suspensivore de la zone intertidale, une perte d'énergie importante due à l'egestion (fécès + pseudofécès), en Baie de Seine par rapport à la Baie de Somme (figure 1). Cette différence de production se traduit par une importante différence de biomasse pour un individu standard de 25 mm, comme le montre la figure 2. L'étude de la composition biochimique (glucides totaux, glycogène, lipides totaux, protéines) permet de fournir des équivalents énergétiques de la biomasse (tableau I) et de la production, en tenant compte des variations, saisonnières, dues à l'âge et spécifiques (figure 3). Page 77 14.00 12.00 10.00 8.00 6.00 4.00 2.00 0.00 C R F Coque Seine U P Coque Somme Figure 1 :Comparaison des bilans énergétiques de Cerastoderma edule sur les deux sites. 0,35 g PSLC ind. de 25 mm 0,3 0,25 0,2 0,15 0,1 0,05 0 Seine (Station Se) Biomasse 96 Somme (station So) Biomasse 97 Figure 2 : Différence de biomasse pour des individus de Cerastoderma edule de 25mm issus de la Baie de Seine et de la Baie de Somme en 1996 et 1997. Page 78 mg/g 500 450 400 350 300 250 200 150 100 50 0 glucides.tot glycogène Pectinaria koreni lipides tot. protéines Owenia fusiformis Figure3 : Composition biochimique relative (mg/g) de deux Annélides Polychètes du benthos subtidal de la Baie de Seine. Tableau I : Equivalent énergétique (Kcal/g PSLC) des principales espèces benthiques (intertidal et subtidal). Kcal/g (PSLC) intertidal Cerastoderma edule Macoma balthica Nereis diversicolor 1996 Hiver Kcal/g (PSLC) subtidal 1997 Hiver 4,36 4,54 4,4 4,53 5,4 4,76 Abra alba Pectinaria koreni Owenia fusiformis Les résultats des analyses sont présentés en annexe. Page 79 1996 Eté 5,77 5,39 5,83 1997 Eté 5,12 6,34 5,14 1997 Hiver 4,92 4,86 4,58 1997 Eté 5,4 5,79 5,67 2. Les biomasses 2.1. Intertidal Dans la situation hivernale 1996 et 1997, Macoma balthica représente 54 à 67 % de la biomasse. Cerastoderma edule, l’autre Mollusque Bivalve, participe de façon constante à cette biomasse avec respectivement 12 à 10 %. En revanche Nereis diversicolor voit sa proportion varier de 34 à 23% (Figue 4). En situation estivale les résultats sont très différents, Macoma balthica et Nereis diversicolor voient leur part respective dans la biomasse passer respectivement de 26 à 37 % et de 14 à 6 %. Dans le même temps Cerastoderma edule représente 60 à 57 % de la biomasse. Le réseau trophique intertidal est dominé en hiver par Macoma balthica (54 à 67 %) et en été par Cerastoderma edule (60 à 57 %). Cette alternance est sans doute imputable au fait que le recrutement de Cerastoderma edule (fin de printemps-été) ne se maintient pas. Il est remarquable de constater qu’en hiver le réseau trophique intertidal fonctionne sur un schéma « déposivore » classique pour les écosystèmes estuariens, alors qu’en été il bascule sur un schéma « suspensivore ». 2.2. Subtidal On observe qu’Owenia fusiformis domine la biomasse avec une participation de 50 à 70 % respectivement en été et en hiver. En été la participation de Pectinaria koreni et d’Abra alba est équivalente (27 à 23 %). En revanche en hiver celle de Pectinaria passe à 18% et celle d’Abra à 9%. La caractérisation trophique de ces variations est moins évidente que dans le domaine intertidal. Il semble que le type trophique variant le plus est celui de Pectinaria, soit : déposivore de subsurface. Mais Owenia est susceptible d’être suspensivore et il serait intéressant de pouvoir superposer cette possibilité de changement trophique avec la variation de participation à la biomasse pour faire le parallèle avec le réseau trophique intertidal. Cerastoderma edule 12% Nereis diversicolor 34% Owenia fusiformis 50% 10% 23% Macoma balthica 54% Hiver 1996 67% Pectinaria koreni 13% Hiver 1997 Hiver 1997 6% 14% Abra alba 23% 9% 18% 37% 26% 57% 60% 73% Eté 1996 Eté 1997 Eté 1997 Figure 4 : Biomasses relatives des principales espèces benthiques du domaine intertidal et subtidal. Page 80 3. Contamination et flux de Cadmium 3.1. Teneur en cadmium. - Les valeurs des concentrations en cadmium pour ces mêmes espèces en Baie de Seine ont été déterminées à chaque fois que nous avons pu recueillir suffisamment d'individus. On remarque que d'une façon générale les valeurs sont faibles, avec des différences saisonnières bien marquées, et que les bivalves Cerastoderma edule (suspensivore) et Abra alba (déposivore) sont plus riches en Cd que les annélides et que d'autres bivalves comme Macoma balthica (figure 5a et b). µg/g a 2 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 0 Abra alba Pectinaria koreni Owenia fusiformis Cerastoderma edule Macoma Balthica Nereis diversicolor µg/g b 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 0 Abra alba Pectinaria koreni Owenia fusiformis Figure 5 : Teneur moyenne en Cadmium (mg/g) des principales espèces benthiques en été (a) et en hiver (b). Page 81 - Ces teneurs sont faibles, mais comparées à celles mesurées en Baie de Somme elles sont huit fois supérieures ( la Baie de Somme étant un site référence pour les très faibles concentrations en cadmium), figure 6. - Les concentrations mesurées chez la coque en baie de Seine sont largement supérieures à celles rencontrées à la même période en Gironde (Les Mathes), site soumis à une forte pollution en cadmium. Elles correspondent à une zone contaminée. Transposées au cas de la Gironde, cela correspond à des huîtres à plus de 20µg/g. µg/g 2 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 0 Cerastoderma edule Somme Cerastoderma edule Seine Macoma Balthica Somme Macoma Balthica Seine Figure 6 : Teneur moyenne en Cadmium (µg/g) de Cerastoderma edule et Macoma Balthica en Baie de Seine et Baie de Somme. - Mobilisation du cadmium. Il est intéressant de rapprocher les estimations de biomasse des espèces en µgCd/m² et la mobilisation en cadmium (Tableau II). Les quantités mobilisées (%) ne se superposent pas avec les biomasses et l'on observe une grande variation saisonnière, notamment pour Abra alba et Owenia fusiformis. Les bivalves fixent en zone intertidale près de 99% du cadmium soit 178µgCd/m². Cette mobilisation est d'un ordre de grandeur inférieur en zone subtidale (20 µg Cd/m²). Tableau II : Cadmium mobilisé (%) en fonction de la biomasse (%) des principales espèces benthiques (intertidal et subtidal). Biomasse (%) 57 37 6 Eté Hiver 23 9 13 18 50 73 Espèces Cerastoderma edule Intertidal Macoma Balthica Nereis diversicolor Subtital Abra alba Pectinaria koreni Owenia fusiformis Page 82 Cd mobilisé (%) 83 16 1 Eté Hiver 22 77 14 11 64 12 3.2. Flux de cadmium. Le calcul des flux de cadmium en µg/m²/an par rapport au poids sec est illustré sur la figure 7a et b. Ces flux ne sont pas, pour l'instant, intégrés sur l'année et présentent deux états (maximum et minimum). On observe une différence entre les deux zones (intertidale et subtidale) de plus d'un facteur 10. µg/kcal 0.35 0.3 0.25 0.2 0.15 0.1 0.05 0 Eté Abra alba Pectinaria koreni Owenia fusiformis Abra alba Pectinaria koreni Owenia fusiformis Cerastoderma edule Macoma Balthica Nereis diversicolor µg/kcal 0.3 0.25 0.2 0.15 0.1 0.05 0 Hiver Figure 7 : Teneur en µg de Cd par Kcal des principales espèces benthiques (intertidal et subtidal) en été (a) et en hiver (b). Page 83 En terme de transfert vers les consommations de ces espèces : le flet (Platichthys flesus), le bar (Dicentrarchus labrax) en été la consommation des bivalves (Cerastoderma edule en intertidal et Abra alba en subtidal) apporte les plus fortes doses de cadmium (respectivement 0,3 et 0,2 µgCd/Kcal ingérée); pour toutes les autres espèces cet apport est largement plus faible (0,06 à 0,08 µgCd/Kcal ingérée). 4. Réseau trophique benthique Le volume d’eau moyen utilisé de l’estuaire de la Seine pour l’analyse est celui recouvrantla zone Sainte Adresse-Trouville-Tancarville soit équivalent à 313 155 888, 5 m3 ; la surface utilisée pour la même zone est de 35 839 340 m². Le réseau trophique de l’estuaire de la Seine (figure 1) est structuré en 9 compartiments pour chacun desquels cinq paramètres biodémographiques ont été calculés. Les résultats obtenus au niveau de ces neuf compartiments sont représentés sous forme de flux énergétiques entrants et sortants au sein du réseau. Le premier paramètre, indispensable, est la biomasse, permettant d’évaluer la masse de substance vivante sur une unité de surface donnée. Ce paramètre est considéré comme une ‘’stase’’ de l’énergie (Frontier et Pichod-Viale, 1998) alors que les autres, vont être caractéristiques de flux, traversant l’écosystème ou recyclés dans un de ces compartiments. Cette mesure permet indirectement d’estimer la production des différents constituants du système, et ainsi la quantité de nourriture disponible pour les maillons trophiques supérieurs. Puis, la consommation de chaque compartiment est calculée selon leurs propres types trophiques. L’activité métabolique de ces divers organismes engendre des pertes que nous considérons dans notre étude comme provenant de la respiration et des fèces. Nous négligeons ici l'énergie liée à l'excrétion car nous travaillons sur les flux énergétiques de carbone et non d’azote. 4.1. Méthode et analyse 4.1.1. Réseau trophique Les producteurs primaires forment le premier niveau du réseau trophique utilisant l’énergie solaire afin d’élaborer leur propre matière organique ; ils se composent ici du phytoplancton (1)1 et du macrophytobenthos (2). 1 Les chiffres entre parenthèses correspondent aux numéros des différents compartiments constituant le réseau trophique. Page 84 Les consommateurs de ce premier compartiment, sont les consommateurs primaires, appelés aussi Herbivores ; ce dernier terme étant employé au sens large compte tenu des espèces qui, dans notre étude, le composent. Ils sont constitués par le zooplancton (3), par la macrofaune suspensivore (4) et déposivore (5). Les consommateurs secondaires regroupent les compartiments carnivores : la macrofaune prédatrice (6), les poissons (7), et les oiseaux (8). Enfin, la matière organique particulaire (M.O.P.) (9) forme le compartiment de matière morte et le point de retour des fèces produits par les autres compartiments de l’écosystème. Dans un soucis de clarté, les fèces sont regroupés au niveau de ce compartiment par une flèche plus importante. Si l’importation de matière organique au niveau des compartiments producteurs primaires et MOP a pu être calculé, nous avons considéré l'exportation de ces compartiments comme nulle car difficile, à déterminer dans le contexte étudié. 4.1.1.1. Les producteurs primaires Les producteurs primaires sont représentés par deux compartiments : les organismes pélagiques (1), représentés par le phytoplancton d’une part, et les organismes benthiques (2) d’autre part, ne comprenant que les macroalgues ; le microphytoplancton n’ayant pu être déterminé. L’analyse de la composition spécifique de la Seine a montré que le peuplement phytoplanctonique (1) est dominé par deux principaux groupes algaux ; les diatomées et les Chlorophycées ( Garnier et al., 1995). La biomasse phytoplanctonique est évaluée à partir de quatre campagnes (profils longitudinaux) effectuées au printemps (Mars et Mai 1993) et en été (Juillet et Septembre 1995) par l ‘URA 1367 et le GMMA, dans le cadre du programme Seine-Aval (Garnier, J., Leporcq, B., 1996). Onze stations de l’estuaire ont été échantillonnées pour appréhender le processus de la photosynthèse, mesurée selon la méthode proposée par Steeman-Nielsen (1952) qui se base sur l’incorporation de C14-bicarbonate de sodium (0,5 µCi.ml-1) par les cellules algales. L’activité photosynthétique est mesurée in situ simulé dans un photosynthétron dont la température est imposée par un régulateur thermique (RC20 Lauda, Prolabo) pour des incubations courtes (1 heure) et sur des petits volumes (20 ml). Après l’incubation, les échantillons sont filtrés sur des filtres GF/F (25 mm de diamètre), placés dans une fiole à scintillation dans laquelle ils sont imbibés de 500 µl de HCl 2N pour éliminer le C14 adsorbé. La radioactivité est ensuite comptée par la technique de scintillation liquide (10 ml de liquide scintillant, Instagel, Packard). Les dosages de l’alcalinité sont effectués selon Rodier (1984), les valeurs étant assimilées à la concentration en bicarbonate, fraction prépondérante des équilibres Page 85 ‘CO2’. La biomasse phytoplanctonique moyenne au sein de l’estuaire de la Seine est ainsi de 478,9 kJ.m-2. Le module du phytoplancton permet de calculer la production journalière moyenne de la colonne d’eau à partir de la température et de l’ensoleillement, du coefficient d’extinction et de la biomasse algale, exprimée en chlorophylle active. La mesure du coefficient d’extinction étant difficile à réaliser in situ d’une manière extensive, il est indispensable d’avoir recours à une relation le reliant aux variables qui le contrôlent , telles que les MES et la chlorophylle. Une série de mesures du coefficient d’extinction en différents points du réseau hydrographique de la Seine et dans l’estuaire a été effectuée en parallèle avec des analyses de la chlorophylle et des MES et a conduit à formuler une relation du type : K (m-1) = 0,32 + 0,03 x MES inorg + 0,03 chla La dynamique particulière de l’estuaire rend nécessaire l’estimation d’une valeur des MES tenant compte de tous les cycles influençant la production primaire et les MES (cycle journalier, cycle de marée, cycle lunaire). La production primaire a été calculée en appliquant une valeur de MES moyenne calculée sur une période de 28 jours dans la couche superficielle de la colonne d’eau (Brion, comm. pers.). Excepté en septembre 1995, les valeurs de production primaire mesurées sur les quatre campagnes sont élevées à l’amont de Rouen et diminuent jusqu’à l’aval de l’estuaire où elles sont faibles. La production primaire nette phytoplanctonique moyenne calculée dans l’estuaire de la Seine est de 13 677,6 kJ.m-2.an-1. Les relevés de macrophythobenthos (2) ont été effectué de façon continue, tout le long de l’estran afin de calculer pour chacun des horizons, une valeur moyenne de la biomasse (Cosson, J., Thouin, F., 1978). Ainsi, les différents horizons de l’estran ont été découpés en bandes parallèles dans lesquelles les mesures ont été effectuées de part et d’autre du transect (ligne directrice définie), de telle façon que les surfaces étudiées soient supérieures à l’aire minimale, ceci afin de tenir compte de toutes les espèces présentes, y compris les moins fréquentes. Environ 500 relevés ont été effectués ; les valeurs de biomasse utilisées correspondent pour chaque horizon de l’estran à une moyenne calculée à partir de plusieurs surfaces de 1 m². Le nombre de ces surfaces à été adapté à la largeur de l’estran au niveau du transect considéré. Page 86 La biomasse est mesurée pour chacun des grands groupes systématiques : Chlorophycées, Rhodophycées et Phéophycées ; d’abord exprimée en grammes de matière sèche par mètre carré, nous l’avons convertie en kilo joules par mètre carré ce qui nous donne 1 760,3 kJ.m-2. La production primaire macrophytobenthique est estimée, à partir du rapport P/B moyen connu pour le phytobenthos (P/B = 2,87) (De Jonge, 1992 ; Wilson et Parkes, 1998). Elle est équivalente à 5 065,8 kJ.m-2.an-1. Ces valeurs de production primaire sont utilisées en tant qu’entrée (‘’input’’) dans le système au niveau de ces deux compartiments. La respiration dans la colonne d’eau est ajoutée à celle du sédiment car c’est une zone turbide et, dans l’absolu, il n’est pas possible de séparer ces deux éléments ; de plus nous travaillons à partir de valeurs de production nette (PN = PB – R). 4.1.1.2. Le Zooplancton La communauté mésozooplanctonique (3) de l’estuaire de la Seine est répartie spatialement selon la salinité en deux principales zones estuariennes dont la structure faunistique est caractéristique : -une zone mésohaline (10-20 P.S.U.), dominée par les copépodes Acartia clausi et Temora longicornis, avec des densités et des biomasses relativement peu élevées. -une zone oligohaline (0,5-10 P.S.U.), caractérisée par la dominance des copépodes Eurytemora affinis, avec des densités et des biomasses très élevées, notamment au printemps (Mai). La part du zooplancton dans la zone oligohaline n’est pas prise en compte au niveau du réseau trophique de l’estuaire de la Seine car cette zone décrit la partie Tancarville jusqu’à Rouen et nous ne nous intéressons dans notre étude qu’à la partie embouchure et au chenal jusqu’à Tancarville. Quatre campagnes saisonnières d’échantillonnage planctonique ont été menées (Mouny, P., Dauvin, J.C., 1996) depuis novembre 1993 jusqu’à septembre 1995 (novembre 1993, mai 1994, février et septembre 1995). Deux types d’échantillonnage ont été effectués à chaque campagne : -une radiale longitudinale, pour étudier la composition des populations estuariennes le long du gradient de salinité, la remontée de l’estuaire a été faite en suivant le flot des eaux extérieures vers les eaux du fleuve donc en période de déplacement des isohalines vers l’amont. -un cycle de 24 heures afin de suivre les effets de l’advection tidale pendant deux cycles complets de marée ( deux basses mers et deux pleines mers) et d’étudier les rythmes nycthéméraux éventuels. Le mésozooplancton a été récolté à l’aide d’un filet WP2 de maille de 200 µm traîné deux minutes contre le courant à raison d’un trait en sub-surface et d’un trait oblique échantillonnant toute la Page 87 colonne d’eau. Cette procédure a été adoptée pour toutes les stations des radiales et une fois par heure pendant les cycles de 24 heures. Les prélèvements sont ensuite filtrés sur un tamis de maille de 200 µm. Le comptage des individus se fait jusqu’à ce que l’on ait un volume suffisant pour dénombrer 100 individus de chaque espèce principale, nombre considéré comme suffisant dans le cas du dénombrement des organismes planctoniques (méthode de Frontier, 1972). Cette méthode est fiable pour les espèces abondantes mais ne permet pas une bonne estimation des espèces rares. Les individus sont alors déterminés dans la mesure du possible puis comptés ; les abondances sont exprimées en individu par mètre cube ensuite converties en individu par mètre carré pour notre étude. Les densités varient énormément au cours des années étudiées ; la densité moyenne de la zone mésohaline est de 2 178 ind.m-3 ou 19 031 ind.m-2. A partir des densités des espèces principales représentées dans l’estuaire de la Seine et de leurs poids moyens individuels respectifs (Wang, Z., Dauvin, J.C., 1994), nous avons déterminé la biomasse du mésozooplancton par la relation (1) : (1) B = d ×W où B est la biomasse en kJ.m-2, d est la densité en ind.m-2 et W est le poids moyen individuel en équivalent kJ. La biomasse moyenne mésozooplanctonique équivalente est de 1,8 kJ.m-2. Le taux d’ingestion chez le zooplancton dépend à la fois du poids moyen et de la température. Heip et al (1995) ont noté un taux de consommation allant de 0,08 jusqu’à 4 fois leur poids moyen par jour, avec pour majorité d’individu une valeur de 2 fois leur poids par jour ; convertie à l’année, cela nous donne une consommation de 1 347,4 kJ.m-2.an-1. Gifford and Dagg (1988) ont trouvé qu’entre 80 % et 95 % de leur consommation est sous forme de chlorophylle. Nous retenons pour les calculs la plus faible valeur (80 %) en tenant compte du fait de l’importante Matière Organique dans le sédiment de l’estuaire de la Seine correspondant au reste de leur alimentation. Ainsi, le mésozooplancton consomme 1 077,9 kJ.m-2.an-1 de phytoplancton et 269,5 kJ.m-2.an-1 de matière organique particulaire. Le taux moyen d’assimilation est de 60 % de la consommation totale selon Barthel (1983) ; ce qui permet à l'aide de l’équation (2) de Crisp (1971) d’obtenir la perte due aux fèces : (2) F =C−A Page 88 où F sont les fèces en kJ.m-2.an-1, C est la consommation en kJ.m-2.an-1, et A est l’assimilation en kJ.m2 .an-1. Les fèces constituent donc 40 % de la consommation soit 539 kJ.m-2.an-1. La production zooplanctonique est estimée à l’aide de la relation (3) de Schwinghammer et al., (1986). Elle utilise une régression à partir des valeurs énergétiques de la biomasse d’une espèce et de la biomasse moyenne d’un individu. −0 , 304 ×B (3) P = 0,525 × W où P est la production en kJ.m-2.an-1, B est la biomasse moyenne par espèce en kJ.m-2, et W est le poids moyen individuel en équivalent kJ. Elle est ainsi équivalente à 15,8 kJ.m-².an-1. La respiration annuelle zooplanctonique est calculée à partir de la production grâce à l’équation (4) de Schwinghammer et al. (1986) : (4) Log 10 R = 0,367 + 0.993 × Log 10 ( P ) où R est la respiration en kJ.m-2.an-1 et P est la production en kJ.m-2.an-1. La respiration du zooplancton est ainsi de 36,3 kJ.m-2.an-1. 4.1.1.3. La macrofaune benthique La méthode d’échantillonnage utilisée est celle habituellement utilisée en milieu intertidal meuble (Beukema et Desprez, 1986, Ducrotoy et al., 1989). Elle consiste à prélever du sédiment à différentes stations, plusieurs radiales ont ainsi été exploitées à différents endroits de la baie afin d’évaluer un maximum de secteurs. La biomasse est évaluée à partir de ces échantillons d’espèces prélevés en 1996 et triés en laboratoire. Elle est exprimée pour chaque individu en grammes de matière sèche libre de cendres. La biomasse moyenne des macroinvertébrés benthiques au sein de l’estuaire de la Seine comprenant les suspensivores (4), les déposivores (5) et prédateurs (6) est ainsi de 290,2 kJ.m-2. Ce compartiment est composé en majorité par les déposivores avec 201,3 kJ.m-2 (soit 70 % de la biomasse du benthos), qui représentent bien trois fois la biomasse des suspensivores avec 59,1 kJ.m-2 (20 %) ; celle des prédateurs atteint avec 29,8 kJ.m-2, 10 % de la biomasse totale des macroinvertébrés de l’estuaire. Page 89 En théorie, la production demande un suivi régulier et un échantillonnage au minimum saisonnier. Dans cette étude, l’échantillonnage concernant la macrofaune est effectué ponctuellement, c’est pourquoi nous utilisons la méthode de Schwinghammer et al., (1986) pour estimer la production moyenne de l’estuaire. La production benthique au niveau de l’estuaire de la Seine est estimée à partir de la relation (3) à 91,9 kJ.m-2.an-1. Le rapport P/B calculé en Baie de Somme en 1998 était de 1,4 signe d’une population jeune ; dans l’estuaire de la Seine il est de 0,3. La consommation est calculée à partir de l’assimilation. Selon Trevallion (1971) et Wilson (1995), l’assimilation serait comprise entre 10 et 15 % de la consommation. Le calcul de l’assimilation vient de l’équation (5) d’après Wilson et Parkes (1998) : (5) A = R × 100 RA où A est l’assimilation en kJ.m-2.an-1, R est la respiration en kJ.m-2.an-1, et le paramètre RA représente l’énergie assimilée utilisée pour la respiration en %. Les valeurs reportées pour ce paramètre RA chez les macroinvertébrés, vont de 57 % (Salzwedel, 1980) à 89 % (Mohlenberg and Kiorboe, 1981) avec une moyenne de 70 % (Davis and Wilson 1985) que nous utilisons dans cette étude. Nous considérons que 15 % de l’énergie consommée est assimilée soit A = 0,15 × C (Wilson and Parkes, 1998). La consommation de la macrofaune benthique est alors calculée et représente 1993,2 kJ.m-2.an-1. A partir de cette valeur nous calculons la part de fèces grâce à la relation (2) de Crisp (1971), à 1 694,3 kJ.m-2.an-1. Avec la macrofaune benthique se pose le problème du type trophique. Nous distinguons au sein de ce compartiment les suspensivores (4), les déposivores (5) et les prédateurs (6). Les relations entre ces types trophiques et leur source d’alimentation, même si parfois elles ne sont pas toujours évidentes, sont obtenues en considérant que les suspensivores vont se nourrir de phytoplancton et de matière en suspension de façon non sélective (Fiala-Médioni, A., 1981 ; BarkerJorgensen, 1990 ; Wilson et Parkes, 1998) ; les déposivores de la fraction organique comprise dans le sédiment et de microphytobenthos ; enfin les prédateurs, de suspensivores et de déposivores. La consommation est alors considérée comme proportionnelle à la quantité de nourriture présente dans l’estuaire. A titre d’exemple, la consommation des suspensivores (4) est de 288,7 kJ.m-2.an-1 ; en considérant que ce compartiment se nourrit de MES et de phytoplancton de façon non sélective, on évalue à 6,1 kJ.m-2.an-1 la consommation phytoplanctonique et à 282,6 kJ.m-2.an-1 la consommation au niveau du compartiment matière organique. Page 90 Nos calculs sont basés sur l’hypothèse que les espèces benthiques ne sont pas sélectives dans leur régime trophique (Wilson et Parkes, 1998). L’importance du contenu en MOP dans cet écosystème explique la forte consommation au niveau de ce compartiment. La respiration annuelle benthique calculée par la relation (4) de Schwinghammer et al. (1986) est équivalente à 209,3 kJ.m-2.an-1 pour l’ensemble de l’estuaire, dont une contribution importante des déposivores avec 151,5 kJ.m-2.an-1, par rapport à 30,3 kJ.m-2.an-1 pour le compartiment des suspensivores et 27,5 kJ.m-2.an-1 chez les prédateurs. 4.1.1.4. Les poissons Deux campagnes de pêches expérimentales en mars et septembre 1997 ont été effectuées dans le chenal de la Seine et dans la Fosse Sud de l’estuaire ; les traits de chalut effectués recouvrant trois zones de salinité : - la zone oligohaline comportant une station à l’aval du pont de Tancarville, - la zone polyhaline comportant une station à l’aval de Honfleur, - la zone euhaline située à l’embouchure de l’estuaire, comportant la station dans la fosse Sud. Lors des deux campagnes, faites à bord du chalutier ‘Ville de Honfleur’, deux traits d’environ 25 minutes ont été effectué à chaque station par des coefficients de marée de morte eau, sauf en mars à Honfleur, où un seul trait de 41 mn a été effectué. Le matériel utilisé a été un chalut à panneaux à crevette de taille de maille 20 mm étirées, et de 9 m d’ouverture. Les biomasses des principales espèces de poissons (7) sont données en grammes de poids frais par 1000 mètre carré (Bessinetton et al., 1998), ensuite converties en grammes de poids secs par mètre carré puis en kilo joules par mètre carré. Vingt espèces de poissons ont été déterminé dont des Godes (Trisopterus luscus), des Gobies (Pomatoschistus microps), des Soles (Solea vulgaris), des Flets (Platichthys flesus), des Bars (Dicentrarchus labrax) et des Plies (Pleuronectes platessa) en majorité. La biomasse moyenne totale de l’estuaire est de 4,3 kJ.m-². La biomasse maximale est celle de la Morue (0,98 kJ.m-2), du Gode (0,88 kJ.m-2) et du Flet (0,62 kJ.m-2) ; les autres sont inférieures à 0,4 kJ.m-2. La production, comme chez les invertébrés, est fonction du poids moyen individuel (Jobling, 1994). On calcule dans un premier temps le taux de croissance spécifique (G) grâce à la relation (6) de Jobling (1994) : Page 91 b (6) G = a × W où G est le taux de croissance spécifique en %.j-1, W est le poids moyen individuel en kJ, a est une constante, corrigée à T=10° C et égale à 4,74 et b est un coefficient de pondération égal à –0,35. On obtient la production par espèce par la relation (7) : (7) P = B × G × 3,65 où P est la production en kJ.m-2.an-1, B est la biomasse moyenne de l’espèce en kJ.m-2 et G est le taux de croissance spécifique en %.j-1. La production ichtyologique de l’estuaire de la Seine est alors estimée à 14,8 kJ.m-2.an-1. La consommation au niveau de ce compartiment est calculée en utilisant une fonction allométrique de Jobling (8) (1994) : b (8) f (W ) = a × W où f (W) est une fonction allométrique représentant la nourriture consommée en kJ.ind-1.j-1, W est le poids moyen individuel en kJ, et les deux constantes sont a = 0,11 et b = 0,75. Jobling (1994), donne un éventail d’efficacité d’absorption selon la variété de nourriture et les espèces de poissons. Pour toutes les espèces de poissons, essentiellement carnivores, il note une efficacité d’absorption de 70 à 85 % (nourriture de type oligochètes) et 80 à 88 % (nourriture de type crustacés). Nous prenons une valeur moyenne de 80 % (Wilson et Parkes, 1998) ce qui donne un taux de production de fèces équivalent à 20 % de la consommation (Crisp, 1971). La consommation et les fèces des poissons sont respectivement de 38,7 kJ.m-2.an-1 ; et 7,7 kJ.m-2.an1 . La respiration est estimée pour une température moyenne de 10 °C utilisant l’équation (9) (Jobling, 1982) : (9) Log 10 M = 0,624 × Log10 (W ) − 0,695 où W est le poids moyen en g et M est le taux de consommation d’oxygène en mg O2.ind-1.h-1. Page 92 Ce calcul de respiration ne prend pas en compte l’activité de l’espèce. C’est pourquoi Jobling (1982) suggère que sur des espèces en condition naturelle on peut rajouter 70 % de la valeur initiale à cette dernière et ainsi avoir une estimation de la respiration plus correcte. Ainsi, selon l’équation (10) : (10) R = 1,7 × M où R est la Respiration corrigée, en kJ.m-2.an-1 et M est le Taux de consommation d’oxygène en kJ.m2 .an-1. La respiration des poissons est ainsi évaluée à 9 kJ.m-2.an-1 au sein de l’estuaire de la Seine. 4.1.1.5. Les Oiseaux Au niveau de l’estuaire de la Seine nichent de nombreuses espèces d’oiseaux. L’avifaune qui y réside est composée de 4 famille prédominantes : les Anatidés, les Limicoles, les Laridés et les Sternidés. Nous avons utilisé le décompte à marée basse de l’avifaune sur 4 mois de l’année 1999 (données Le Havre auteur ?), où 26 espèces ont été repéré (les espèces très peu nombreuses et présentes qu’un seul mois n’ont pas été prise en compte). A partir de ces données, nous avons estimé une densité moyenne des espèces (ind.m-2) en ramenant ces chiffres à la surface de l’estuaire. Les poids moyens individuels de chaque espèces déterminés (Sueur et Triplet, 1999 et Duquet et al., 1998), nous avons calculé la biomasse moyenne de chaque espèce d’oiseau répertorié. Le compartiment des oiseaux (8) représente une biomasse de 12,1 kJ.m-2. Le calcul de la production par espèce vient de la relation (11) de Humphreys (1979) : (11) P = 0,79 × R − 1,055 où P est la production en Log10 cal.m-2.an-1 et R est la respiration en Log10 cal.m-2.an-1. Le calcul de la production par espèce (Humphreys, 1979) nous donne une valeur équivalente à 1,2 kJ.m-2.an-1 pour l’ensemble de notre zone. L’assimilation a été déterminée de la même façon que la respiration après une correction faisant intervenir le temps de résidence, à partir de l’équation (12) de Lasiesky et Dawson (1967) : Page 93 (12) Log 10 ( M ) = Log 10 78,3 + 0,723 × Log 10 (W ) où W est le poids moyen individuel en g et M est l’assimilation en kcal.oiseaux-1.jour-1. L’assimilation est calculée et corrigée pour chaque espèce ; elle est égale à 54,9 kJ.m-2.an-1 pour l’ensemble de la population. Les espèces sont ensuite classées selon leur régime trophique : Carnivores ou Herbivores et l’efficacité d’assimilation est déterminée. Cette valeur est estimée à 80 % pour les espèces carnivores (Whittow et Rahn, 1984), le cas de la majorité des oiseaux et à 40 % pour les herbivores (Grodzinski et al. 1975). La consommation est définie ici comme étant le rapport de l’assimilation sur l’efficacité d’assimilation ; elle est équivalente à 73,3 kJ.m-2.an-1. La valeur des fèces est alors déterminée par différence grâce à la relation de Crisp (1971) soit 18,4 kJ.m-2.an-1. La respiration est calculée pour chaque espèce à partir de la relation (13) de Kendeigh et al. (1977) qui utilise une régression pour les oiseaux autre que les passereaux : 0 , 7347 (13) M = 0,5244 × W où M est la respiration en kcal.ind-1.jour-1 et W est le poids moyen individuel en g de chaque espèce d’oiseau. Une valeur estimée est donnée après une correction en fonction du temps et du % d’oiseaux résidant et non résidant en baie annuellement de la même façon que l’assimilation. La respiration obtenue au sein de l’estuaire de la Seine est de 58,5 kJ.m-2.an-1. 4.1.1.6. La Matière Organique Particulaire Le calcul du contenu en carbone de ce compartiment (9) se déroule en deux étapes ; il faut connaître le carbone organique contenu dans le sédiment puis celui contenu au niveau de la matière en suspension. - Sédiment : Le contenu en carbone organique (C) dans le sédiment a été déterminé à 15,62 % soit 15,62 mgC.g-1 de sédiment (Duhamel, Desprez, 1993). Un coefficient de conversion à partir de la densité du sédiment égale à 2,8 g.cm-3 (Wilson et Parkes, 1998) a été utilisé pour obtenir une valeur de 43 736 gC.m-3. Page 94 La surface de l’estuaire est de 35 839 340 m². On estime que seul le premier centimètre de sédiment contient du C consommable par les organismes vivants (Wilson et Parkes, 1998) ; on obtient alors un volume de sédiment de 358 393,4 m3. Le contenu en C est transposé au volume de la baie totale soit 15,6.109 gC, ramené ensuite au m2 pour obtenir la biomasse du sédiment égale à 18 299,1 kJ.m-2. - MES : A cette valeur, nous rajoutons celle de C contenu dans la Matière en Suspension (MES). Les prélèvements ont été effectué à partir de radiales en fonction de la salinité et de points fixes lors de campagnes en février, mai et septembre 1995 (Motamed, B., Texier, H., 1996). Les prélèvements aux points fixes sont effectués à la surface et près du fond avec une bouteille Niskin. Le contenu de carbone dans la matière en suspension est estimé par perte au feu en filtrant un volume d’eau sur des filtres (Whatman GF/F et GF/C), préalablement calcinés à 450 °C et pesés, utilisés pour séparer les phases dissoutes et particulaires. La matière en suspension sur les filtres est séchée à 50 °C pendant 48 heures. Le carbone dissous (organique et inorganique) est analysé par oxydation catalytique à haute température (680 °C) sur ‘TOC 5000’. Le carbone organique particulaire (COP) est analysé par oxydation sulfochromique puis dosé par colorimétrie. Des échantillons ont été pris en différents points de façon à estimer le contenu en matière organique des sédiments de l’ensemble de l’estuaire. Le COP représente ainsi en moyenne 3,4 % du contenu de la MES, calculé à 259,5 mg.l-1 ; ce qui correspond à 8,2 mg.l-1 ou après conversion à 2 997,8 kJ.m-2. Le COD représente en moyenne 2,4 mg.l-1, soit 873,8 kJ.m-2. L’ensemble COP et COD représente le contenu en C de la Matière en Suspension (MES) soit 3 871,6 kJ.m-2 . L’addition de ces deux valeurs nous donne le contenu en carbone organique total du compartiment détritique soit 22 170,7 kJ.m-2 de l’estuaire de la Seine. Les entrées au niveau de ce compartiment sont de deux sortes : l’apport des rivières et les apports marins. Au niveau de cet écosystème, l’apport marin est estimé à 10 % de l’ensemble des importations (Lafitte) ; c’est avec ce rapport que nous calculerons les entrées marines. Ainsi, l’entrée particulaire fluviale correspond à une moyenne de MES de 5 à 220 mg.l-1( Dupont et al., 1994). Le contenu en Carbone organique (CO), estimé à 37 % de la matière organique particulaire Page 95 par perte au feu (Rybarczyk et al., 1992) est utilisé. On obtient alors 1,85 à 81,4 mg.l-1 de CO ; soit en moyenne 41,6 mg.l-1 et après conversion, 15 217,6 kJ.m-2.an-1. A cette valeur on ajoute 10 % du total venant des apports marins, soit de 1 690,8 kJ.m-2.an-1, ce qui donne au total, des importations de 16 908,4 kJ.m-2.an-1. La consommation d’oxygène de ce compartiment implique non seulement celle du sédiment mais aussi celle de la colonne d’eau. -La respiration au niveau de la MES est calculée à partir de la Demande Biologique en Oxygène (DBO) estimée à 5,5 mg.l-1 au niveau de l’estuaire, soit 46 236,9 kJ.m-2.an-1. -La respiration au niveau du sédiment est donnée à partir de l’équation (14) de Rybarczyk et al., (1995) : ( b ,t ) (14) y = a × e où y représente la consommation d’oxygène en ml.h-1.cm-2 pour le sédiment et t est la température en °C. Les valeurs ont été calculées à partir de l’équation (15) pour le sédiment (en ml.m-2.h-1) (Rybarczyk et al. 1995) : 0 ,1⋅t (15) QO2 Sed = 0,6 × e où t est la température en °C ; on prend une moyenne entre 11°C et 18 °C. On obtient une quantité d’oxygène consommée égale à 297,3 kJ.m-2.an-1 pour 11 °C, et 598,7 kJ.m2 .an-1 pour 18 °C ; soit une moyenne de 448 kJ.m-2.an-1 pour l’ensemble du sédiment de l’estuaire. En additionnant ces deux valeurs on obtient une respiration totale de 46 684,8 kJ.m-2.an-1 pour l’ensemble du compartiment détritique. Les différents flux d’énergie au sein d’un réseau trophique (figure 1) sont intéressant à analyser car ils nous apportent d’importantes informations sur la structure dynamique du système et sur son fonctionnement. Page 96 5. Conclusions Nous avons mis en évidence un important déséquilibre entre les individus de Cerastoderma edule de Baie de Seine et ceux de Baie de Somme, en défaveur de la Baie de Seine. Il apparaît également que la zone intertidale est soumise à un changement de type trophique dominant entre l'été, où il est essentiellement suspensivore, et l'hiver où il est déposivore. Un tel schéma serait applicable à la zone subtidale, mais l'alternance pourrait être assurée par une seule espèce Owenia fusiformis à la fois suspensivore et/ou déposivore de surface. Les teneurs en cadmium dans ces espèces fait apparaître une prépondérance des bivalve dans les processus de bioaccumulation et soulignent une contamination importante de la coque. Les calculs de flux et de transfert dans le réseau trophique précisent la part de chaque espèce benthique dans la bioaccumulation. C'est ainsi qu'une coque apporte 10 fois plus de cadmium/Kcal que Nereis diversicolor. Un modèle de bioaccumulation, à l'aide de ces résultats et des résultats de l'équipe "ichtyofaune" est en cours d'élaboration. Le réseau trophique de l’estuaire de la Seine est en cours d’analyse selon la méthode employée sur la Baie de Somme (publication soumise à Estuarine and Coastal and Shelf Science) et il comprendra l’intégration du réseau trophique pélagique de la zone mésohaline. Page 97 Biomasse en kJ.m-2 Flux en kJ.m-2.an-1 p Zooplancton 1,8 269,5 1077,9 n 13677,6 539 u 36,3 Oiseaux 12,1 Phytoplancton 478,9 14,9 6,1 18,5 q o Suspensivores 59,1 Producteurs Primaires benthiques 1760,3 5065.8 58,5 50,9 0,2 43,3 7,5 245,4 7,8 30.3 59,5 s r Déposivores 201,3 Prédateurs 29,8 202,5 3,9 282,6 1226,2 151,5 222,7 t 27,5 Poissons 4,3 v 1399,3 7,7 M.O.P. 22170,7 16908,4 26,7 Echange 46684,8 Respiration 2259,5 Fèces Figure 8 : Réseau trophique de l’estuaire de la Seine structuré en 9 compartiments. Page 98 9 0,14 0,12 0,10 0,08 0,06 0,04 0,02 0,00 ind. Kcal/m 05.10.98 Abra Kcal/m²/a 16.03.98 Abra g/m²/a 16.04.98 Abra 0,250 0,200 0,150 0,100 0,050 0,000 ind. (pse) Kcal/m² 05.10.98 Owenia fusiformis 16.04.98 Owenia fusiformis Kcal/m²/an g/m²/an 16.03.98 Owenia fusiformis 0,400 0,350 0,300 0,250 0,200 0,150 0,100 0,050 0,000 ind. (pse) Kcal/m² 05.10.98 Pectinaria koreni 16.04.98 Pectinaria koreni Kcal/m²/an g/m²/an 16.03.98 Pectinaria koreni Page 99 0,80 0,70 0,60 0,50 0,40 0,30 0,20 0,10 0,00 ind. Kcal/m 10.01.99 Cerastoderma Kcal/m²/a g/m²/a 27.03.99 Cerastoderma ind. Kcal/m 10.01.99 Macoma Kcal/m²/a g/m²/a 27.03.99 Macoma ind. Kcal/m 10.01.99 Nereis Kcal/m²/a g/m²/a 27.03.99 Nereis 0,80 0,70 0,60 0,50 0,40 0,30 0,20 0,10 0,00 0,80 0,70 0,60 0,50 0,40 0,30 0,20 0,10 0,00 Page 100 60,000 50,000 40,000 30,000 20,000 10,000 0,000 Protéines Lipides 05.10.98 Abra alba Glucides 16.03.98 Abra alba Glycogène 16.04.98 Abra alba 60,000 50,000 40,000 30,000 20,000 10,000 0,000 Protéines Lipides 05.10.98 Owenia fusiformis 16.04.98 Owenia fusiformis Glucides Glycogène 16.03.98 Owenia fusiformis 60,000 50,000 40,000 30,000 20,000 10,000 0,000 Protéines Lipides 05.10.98 Pectinaria koreni 16.04.98 Pectinaria koreni Glucides Glycogène 16.03.98 Pectinaria koreni Page 101 60,000 50,000 40,000 30,000 20,000 10,000 0,000 Protéines Lipides Glucides 10.01.99 Cerastoderma edule Glycogène 27.03.99 Cerastoderma edule 60,000 50,000 40,000 30,000 20,000 10,000 0,000 Protéines Lipides Glucides 10.01.99 Macoma 27.03.99 Macoma b lthi b lthi Glycogène 60,00 50,00 40,00 30,00 20,00 10,00 0,00 Protéine Lipide 10.01.99 Nereis Glucide Glycogèn 27.03.99 Nereis Page 102 3,000 2,500 2,000 1,500 1,000 0,500 0,000 Consommation Assimilation 05.10.98 Abra alba Respiration 16.03.98 Abra alba Fécés 16.04.98 Abra alba 3,500 3,000 2,500 2,000 1,500 1,000 0,500 0,000 Consommation Assimilation 05.10.98 Owenia fusiformis Respiration 16.03.98 Owenia fusiformis Fécés 16.04.98 Owenia fusiformis 4,000 3,500 3,000 2,500 2,000 1,500 1,000 0,500 0,000 Consommation Assimilation 05.10.98 Pectinaria koreni Respiration 16.03.98 Pectinaria koreni Page 103 Fécés 16.04.98 Pectinaria koreni 5,000 4,500 4,000 3,500 3,000 2,500 2,000 1,500 1,000 0,500 0,000 Consommation Assimilation 10.01.99 Cerastoderma edule Respiration Fécés 27.03.99 Cerastoderma edule 4,000 3,500 3,000 2,500 2,000 1,500 1,000 0,500 0,000 Consommation Assimilation 10.01.99 Macoma balthica Respiration Fécés 27.03.99 Macoma balthica 4,000 3,500 3,000 2,500 2,000 1,500 1,000 0,500 0,000 Consommation Assimilation 10.01.99 Nereis diversicolor Respiration Fécés 27.03.99 Nereis diversicolor Page 104