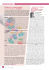La difficile recherche de traces
Transcription
La difficile recherche de traces
POINT CHAUD RECHERCHE La difficile recherche de traces Dans la recherche des causes de la maladie de Parkinson, l’hypothèse s’impose de plus en plus au sein des communautés de chercheurs : la maladie pourrait trouver son origine dans l’appareil digestif et les protéines jouer un rôle particulier. Une revue de Jörg Rothweiler. « Le Parkinson naît-il dans l’estomac ? » C’est sous ce titre que nous avons mentionné, au mois de juin 2010 (PARKINSON n° 98, p. 14) une découverte des chercheurs de l’Université de Technologie de Dresde. Ces derniers avaient réussi à simuler la progression du Parkinson chez l’animal à l’aide de roténone, un pesticide administré par l’intermédiaire d’une sonde gastrique à des souris, qui ont ensuite présenté des symptômes similaires à ceux de la maladie. Comme l’ont démontré des analyses de tissus, l’intoxication a déclenché chez les rongeurs la formation d’agrégats de protéine alphasynucléine, et ce le long d’une ligne de neurones connectés par des synapses reliant le système nerveux entéral de l’intestin à la substance noire en passant par la moelle épinière – exactement de la même manière que chez les patients parkinsoniens. Avec cette découverte, les chercheurs dresdois ont confirmé l’hypothèse des neuroanatomistes, qui postulent une diffusion systématique des processus pathologiques du Parkinson et d’autres maladies neurologiques progressives. L’opinion des neuroanatomistes est confortée Le Prof. Dr Heiko Braak est l’un d’entre eux. Depuis près de quatre décennies, ce chercheur dans le domaine cérébral recherche dans les tissus de défunts des indices de migration des effets pathogènes des troubles neurologiques le long des tissus nerveux entre le tube gastro-intestinal et le cerveau. Grâce à des analyses précises des cerveaux des défunts, il a élaboré pour le Parkinson, mais également pour la maladie d’Alzheimer, les dits stades de Braak. Ces derniers classifient les altérations pathologiques qui se déroulent au cours de l’évolution des différentes maladies (dans le cas du Parkinson, la répartition des agrégats d’alpha-synucléine) en stades de la maladie. Par ailleurs, M. Braak a recherché dans les cerveaux de très jeunes individus qui semblaient « en bonne santé » au moment de leur décès les premières altérations neurodégénératives identifiables, c’est-à-dire des marqueurs pour le diagnostic précoce. Il a démontré que les premières altérations sont souvent déjà décelables bien avant que les patients ne présentent les premiers symptômes. Particulièrement flagrant, le cas d’un enfant de six ans 2 6 PA R K I N S O N 109 décédé d’un empoisonnement du sang dans le cerveau duquel M. Braak a indubitablement décelé des altérations de type Alzheimer et la protéine tau mal « repliée » en cas d’Alzheimer, et donc pathogène. Le Parkinson n’est pas seulement une maladie cérébrale Les recherches de M. Braak ont en outre prouvé que la pathologie parkinsonienne va bien au-delà de la mort des neurones dopaminergiques dans la substance noire. Il est vrai que la carence en dopamine est responsable des symptômes moteurs de la maladie. Toutefois, en cas de Parkinson, d’autres parties du système nerveux sont également endommagées – ce qui explique la complexité de la maladie et la multitude de symptômes non moteurs. M. Braak présume par ailleurs que le Parkinson trouve son origine dans le système nerveux du tube gastro-intestinal. En effet, il a déterminé par ses analyses que les agrégats de l’alpha-synucléine typiques du Parkinson (baptisés corps de Lewy) sont déjà identifiables à un stade très précoce de la maladie dans les cellules nerveuses de l’estomac. La présomption de M. Braak est confortée par les conclusions des chercheurs de Dresde. Ils sont également d’avis que le Parkinson est déclenché par un initiateur externe pénétrant dans le système nerveux par le tube gastro-intestinal, dans le cas étudié la roténone, qui provoque des altérations pathologiques dans les tissus nerveux de l’estomac et met en branle un processus qui progresse pendant des années le long du système nerveux vers le cerveau et, une fois arrivé à destination, déclenche les premiers symptômes moteurs identifiables. De nouveaux résultats étayent les théories avancées Sur la base de l’idée de la migration de la maladie le long des voies nerveuses, les scientifiques dresdois ont peaufiné leur méthode et leur analyse dans les expériences sur des souris avec le pesticide roténone. Avec succès, comme en attestent les derniers résultats qui viennent d’être présentés dans la publication spécialisée Nature Scientific Reports. Ainsi, le groupe de chercheurs de Francisco Pan-Montojo, qui officie dans la clinique universitaire Carl Gustav Photo : Wolfram Scheible Carus à Dresde, sait à présent que l’intoxication des souris à la roténone renforce la sécrétion d’alphasynucléine des neurones du tube gastro-intestinal des animaux, ce qui provoque la formation des agrégats de protéines pathologiques qui migrent ensuite le long des voies nerveuses jusqu’au cerveau. Quand les chercheurs ont sectionné les voies nerveuses décisives de la région gastro-intestinale, et ainsi empêché la poursuite de la migration des agrégats, la lésion du mésencéphale n’a pas eu lieu et les souris n’ont pas développé de symptômes parkinsoniens, ou seulement très légèrement. Un autre soutien pour les théories de Braak et des chercheurs dresdois est venu de Marbourg. En effet, les scientifiques de la clinique neurologique de l’Université de Marbourg ont démontré à l’aide de vidéos IRM en temps réel que chez les patients parkinsoniens, la contraction gastrique est plus faible que chez les sujets sains dès les stades très précoces. L’estomac, une porte ouverte Mais pour quelle raison l’estomac serait-il justement la voie d’accès pour l’initiateur d’un trouble neurologique ? Les chercheurs ont aussi une réponse à cette question : dans les tissus nerveux du tube gastro-intestinal, quelques appendices de neurones (les axones) traversent la couche musculaire de la muqueuse gastrique pour atteindre les tissus conjonctifs, où ils terminent leur course entre les glandes gastriques tubulaires – c’est-à-dire à quelques millièmes de millimètres seulement de la surface interne de l’estomac. La muqueuse gastrique étant toujours lésée ou affectée par des maladies, l’initiateur peut pénétrer relativement faci- lement dans les cellules nerveuses et lentement se frayer un passage vers le cerveau par l’intermédiaire des liaisons synaptiques des neurones. Par ailleurs, le fait qu’il ait – une fois dégluti ou introduit dans la gorge et le pharynx par le nez – beaucoup de temps dans l’estomac pour mener à bien son attaque fatale tourne à son avantage. En effet, le contenu de l’estomac n’est pas évacué dans l’intestin en continu, mais par portions, de temps en temps. La recherche du facteur déclenchant Jusqu’ici, tout est clair. Mais quel est cet initiateur ? Un poison comme le pesticide utilisé par les chercheurs dresdois, la roténone ? Un virus ? Ou peutêtre un agent infectieux à base de protéine comme dans le cas de la maladie de la vache folle (ESB) – un prion ? Du reste, c’est le Prof. Dr méd. Stanley Prusiner, de l’Université de Californie à San Francisco qui avait émis l’hypothèse de son existence au début des années 1980. À l’époque, il a été moqué et traité d’hérétique par ses collègues. En 1997, il a reçu le prix Nobel de médecine. Pour trahir la fin de l’histoire : personne ne croit à un virus. Les chercheurs de Dresde pensent que la roténone peut déclencher dans les neurones de l’estomac un mauvais repliement de l’alpha-synucléine, ce qui conduit à la formation de corps de Lewy. On sait que de telles altérations de la conformation des protéines (en cas d’Alzheimer, de la protéine tau, en cas de Parkinson de l’alpha-synucléine) peuvent être induites par l’environnement et favorisées par des facteurs génétiques. L’hypothèse des Dresdois coïncide avec les autres résultats de recherche. Ainsi, l’on sait que la Un véritable pionnier de la recherche sur le cerveau : le Professeur Dr Heiko Braak (75), chercheur invité au centre de recherche clinique de l’Université d’Ulm, a développé dans le cadre de plusieurs décennies de travail et à l’aide de milliers d’examens anatomiques un système permettant de classifier en stades les altérations cérébrales en cas d’Alzheimer et de Parkinson. Il en est quasiment sûr : le Parkinson trouve son origine dans le système nerveux du tube gastro-intestinal, où des processus métaboliques pathologiques ou des protéines mal repliées qui deviennent elles-mêmes infectieuses jouent un rôle essentiel. PA R K I N S O N 109 2 7 POINT CHAUD RECHERCHE roténone perturbe la respiration cellulaire mitochondriale et donc endommage les mitochondries (de minuscules organites de la cellule qui font office de centrales énergétiques). Dans ce contexte, les chercheurs de l’Université de Tübingen ont découvert il y a environ trois ans que les protéines PINK1 et Parkin étaient responsables de l’évacuation des mitochondries endommagées en dehors des cellules. Si l’élimination échoue dans les neurones dopaminergiques de la substance noire, ceux-ci meurent – et une maladie de Parkinson se développe (cf. PARKINSON, n° 97, p. 11). M. Braak présume que l’initiateur est un processus métabolique pathologique ou une protéine défectueuse qui devient elle-même infectieuse. Il est donc d’accord avec des chercheurs tels que le Prof. Mathias Jucker, de l’Institut Hertie de recherche clinique sur le cerveau de l’Université de Tübingen. Ce dernier pense même que les déclencheurs sont les protéines elles-mêmes : celles qui se multiplient et se répandent de façon similaire comme les prions, qui peuvent provoquer des maladies telles que la maladie de Creutzfeldt-Jakob, l’insomnie fatale familiale et le kuru (une maladie qui s’est déclarée au XXe siècle sous forme d’épidémie dans la tribu des Fore en Papouasie-Nouvelle-Guinée, déclenchée par l’endocannibalisme, c’est-à-dire la consommation de chair de parents décédés). Point commun entre toutes les maladies à prions : les protéines deviennent pathogènes de par l’altération de leur structure secondaire, provoquent les mêmes altérations dans les protéines voisines (reproduction) et s’amoncellent en agrégats qui ont des effets nocifs sur les cellules. Malheureusement, les maladies à prions sont transmissibles, et dans certains cas (comme l’ESB) d’une espèce à l’autre, des bovins à l’humain. Sources : Pour rédiger son article, l’auteur s’est appuyé sur les contenus des sources suivantes : www.bio-pro. de, le portail Internet de la biotechnologie et des sciences du vivant de BIOPRO Baden-Württemberg GmbH ; le magazine de la Société Allemande de Neurologie DGN 2012 ; Bild der Wissenschaft, y compris éditions spéciales ; Deutsches Ärzteblatt ; Ärztezeitung ; sites Internet de différentes universités et cliniques universitaires. 2 8 PA R K I N S O N 109 Tirer les leçons des maladies à prions Cette crainte est infondée en cas de Parkinson. Comme d’autres maladies dégénératives, le Parkinson est considéré (jusqu’à présent) comme non infectieux. Toutefois, les résultats de recherche des dernières années alimentent l’hypothèse selon laquelle l’action des protéines pertinentes pour la pathogenèse de telles maladies est similaire à celle des prions. Ainsi, le Prof. Mathias Jucker a pu démontrer que des souris en bonne santé présentent des altérations cérébrales de type Alzheimer quand on leur injecte dans l’abdomen une protéine pathogène issue du cerveau d’animaux affectés. Des alpha-synucléinopathies ont également pu être inoculées à des animaux sains. Cependant, et c’est rassurant, contrairement à l’ESB, aucune transmission n’a été possible en administrant le complexe pathogène de protéines par la bouche, le nez, les yeux ou directement dans le sang. Le Professeur Jucker ne souhaite pas pour autant exclure que les dépôts de protéines pathogènes puissent être générés par des substances présentes tout à fait normalement à la périphérie de l’organisme humain. Comment un mauvais repliement peut-il se transmettre d’une protéine à une autre ? Le Prof. Dr méd. Claudio Soto, neurologue de l’Université d’Houston, au Texas, l’explique : une protéine mal repliée devient souvent plus immobile, ce qui rend plus plausible un mauvais repliement analogue des molécules voisines. Les molécules se serrent les unes contre les autres. Quand une masse critique est atteinte, la fixation de nouvelles molécules s’accélère en cascade et des agrégats insolubles se forment. Toutefois, ils sont mobiles. C’est ce qu’a découvert le Prof. Dr méd. Virgina Lee de l’Université de Philadelphie. Ainsi, chez l’animal les agrégats d’alphasynucléine se trouvent d’abord dans les axones neuronaux. Ils peuvent être assimilés par les neurones des souris saines et migrer le long du neurone et de la fente synaptique vers les cellules voisines. Ils sont ainsi en mesure de progresser de la périphérie jusqu’au cerveau. De toute évidence, les protéines mal repliées, qui peuvent déclencher des troubles neurologiques tels que le Parkinson, peuvent également provoquer un mauvais repliement des protéines correctement formées. En outre, les transmissions par le biais des cellules et (seulement dans des conditions de laboratoire) d’animal à animal sont possible. Les protéines sont décisives Les protéines semblent donc essentielles pour déterminer si quelqu’un sera atteint du Parkinson un jour. En effet, ces liaisons chimiques (présentes par milliers dans chaque cellule de notre organisme et actives à chaque instant pour des tâches spécifiques) déterminent si des processus vitaux extrêmement complexes se déroulent bien ou prennent une direction totalement erronée. Le fait que la fonction des protéines soit également décisive pour l’apparition de maladies n’étonne pas le Prof. Dr Dr hc Michael Przybylski de l’Université de Constance. Ce chercheur sur les protéines pense que si les gènes étaient les seuls responsables, le mystère d’Alzheimer et du Parkinson serait élucidé depuis longtemps. Bien sûr, les gènes jouent un rôle essentiel, explique-t-il. Cependant, ils ne peuvent pas expliquer à eux seuls pourquoi une maladie telle que le Parkinson ou Alzheimer se déclare la plupart du temps avec l’âge. De plus, M. Przybylski renvoie au fait que les chenilles et les papillons ont certes un génome identique, mais en définitive, c’est l’œuvre de la protéine qui leur confère des caractéristiques aussi différentes. De la même manière, seule l’analyse du « protéome », c’est-à-dire de l’ensemble des protéines, pourrait fournir les indications critiques pour la recherche des causes. M. Przybylski s’applique lui-même depuis des années à dévoiler les secrets des protéines. Il a déjà de nombreuses découvertes à son actif. Vous trouverez davantage d’informations à ce propos en page 30 et 31. Les profilers du Parkinson Un neurologue d’Ulm et un chimiste de Constance cherchent des protéines grâce auxquelles il serait possible de prédire une démence en cas de Parkinson. Les deux scientifiques ont peut-être fait une découverte bien plus importante. Judith Rauch*. * Judith Rauch est journaliste. Elle a rédigé le présent article pour la revue spécialisée « Bild der Wissenschaft plus ». 3 0 PA R K I N S O N 109 Lorsqu’on aborde le sujet de la maladie de Parkinson avec le Prof. Dr Dr hc. Michael Przybylski, chimiste à Constance, il devient très vite formel : « Comment apparaissent ces célèbres agrégats de protéines qui se forment dans le cerveau ?», demande-t-il. « Comment naissent-ils sur le plan chimique ? » En effet, le modèle est le même, que le trouble cérébral s’appelle Parkinson, Alzheimer ou Creutzfeldt-Jakob : des protéines s’agglutinent alors qu’elles ne sont pas censées le faire. Elles forment des agrégats composés de 10 000 à 100 000 molécules identiques ou similaires. Les proportions de ces formations deviennent si massives qu’elles envahissent des réseaux entiers de neurones. De plus en plus de fonctions cessent ; la mémoire est également affectée. Par chance, pas toujours : dans le cadre du Parkinson, qui se caractérise d’abord par des troubles moteurs ou des douleurs, « seuls » 30 % des patients risquent la démence pendant l’évolution de la maladie. D’où viennent ces différences ? Jusqu’à présent, la recherche sur le Parkinson partait tacitement du principe que tous les patients parkinsoniens présentaient plus ou moins les mêmes types de dépôts dans le cerveau : les corps de Lewy, baptisés ainsi d’après le nom du neurologue Friedrich Lewy (1885–1950), expulsé d’Allemagne vers les ÉtatsUnis par les nazis. Ils se composent principalement d’une petite protéine habituellement soluble, l’alpha-synucléine, constituée de 140 acides aminés. De bons et de mauvais agrégats Mais vraisemblablement, la situation n’est pas aussi simple. « Le lien entre la démence et le dépôt est imprécis et grossier », déclare le Professeur Przybylski. Cette découverte est récente. Lors de l’analyse des agrégats typiques du Parkinson, deux groupes de recherche ont distingué deux types : ceux qui sont très toxiques pour les nerfs et les autres, dont la nocivité est moindre. « Nous devons donc supposer qu’il existe des bons et des mauvais agrégats », simplifie M. Przybylski. Ce qui intéresse à présent vivement le chimiste : « Comment sont-ils précisément composés ? » Le chercheur de protéines a déjà une hypothèse : les mauvais agrégats pourraient bien ne pas se composer d’alpha-synucléine intacte, mais d’un morceau, d’un fragment de la molécule. Le schéma serait similaire à celui de la maladie d’Alzheimer, qui présente deux formes d’évolution : une grave et une moins grave. Dans Photos : Wolfram Scheible pour Bild der Wissenschaft le cas grave, la molécule responsable, la bêta-amyloïde, possède deux acides aminés de plus que la forme légère. Le responsable est une mutation génétique qui provoque une coupure de la molécule précurseur au mauvais endroit. En cas de Parkinson, il semble que le « méchant » soit aussi un produit de décomposition : l’alpha-synucléine est rompue en son milieu. « La séquence qui contient les acides aminés 72 à 140 est le fragment décisif », explique M. Przybylski. Il peut l’affirmer avec une grande certitude. En effet, en 2010 une thèse de troisième cycle et une thèse de Master ont vu le jour entre les murs de son institut. À l’aide d’une méthode de mesure particulière très moderne, la spectroscopie de masse à mobilité ionique, la doctorante Camelia Vlad a débusqué le candidat dans le complexe de protéines des cellules du cerveau de souris génétiquement modifiées qui développent des symptômes du Parkinson à la place des humains. Elle a pour ainsi dire trouvé « l’aiguille dans la meule de foin », comme M. Przybylski aime à le comparer. Quant à l’étudiante en Master Kathrin Lindner, elle a synthétisé chimiquement un gène du fragment et veillé à ce qu’il soit déchiffré dans des cellules bactériennes. Dans ce système artificiel également, il s’est avéré que la séquence s’agglutinait plus rapidement que l’alpha-synucléine intacte. Son responsable, le Professeur Przybylski, a déjà tiré les conséquences de sa découverte. Il développe en collaboration avec l’entreprise Boehringer Ingelheim une substance inhibitrice susceptible d’empêcher la désagrégation de l’alpha-synucléine. Une demande de brevet a déjà été déposée. Si cette substance inhibitrice permettait de développer un médicament antiparkinsonien efficace et bien toléré, il s’agirait d’une « véritable révolution », comme le fait remarquer Michael Przybylski non sans fierté. À Constance, un neurologue est responsable des recherches : Markus Otto, professeur et chef de laboratoire à la clinique universitaire d’Ulm. La Baden-Württemberg Stiftung, qui soutient le duo de détectives depuis 2007, répond également présent. La proposition de projet ne mentionnait aucunement un nouveau médicament antiparkinsonien. L’objectif était formulé bien plus modestement : « Identifier des marqueurs neurochimiques permettant un diagnostic précoce de la démence parkinsonienne, afin d’administrer à ces patients un traitement répondant à leurs besoins spécifiques. » Tandis que son partenaire de Constance gagnait du terrain sur les détails moléculaires de l’apparition du Parkinson, M. Otto donnait une suite cohérente à l’approche diagnostique : à l’aide d’une batterie de méthodes d’examen protéo- miques, il a recherché les différences dans la fluidité du liquide céphalorachidien des patients parkinsoniens déments et non déments. « Protéomique » est l’une des formules magiques des sciences biologiques modernes. Une seule cellule peut contenir dans différentes proportions plus de 100 000 protéines différentes, qui exécutent leurs tâches spécifiques. Les méthodes d’analyse qui permettent non seulement d’identifier les différentes protéines, mais également d’en définir la quantité, ont été extrêmement perfectionnées ces dernières années. Triple offensive contre les « protéines parkinsoniennes » L’électrophorèse sur gel est encore utilisée (à Ulm également) : les protéines sont séparées en fonction de leur taille et de leur charge sur une surface recouverte de gel de 25 centimètres sur 20. Elles forment des taches sur lesquelles se regroupent les protéines dont les propriétés sont similaires. Deuxième arme : les processus de séparation immunologiques, qui recourent aux anticorps, ont également fait leurs preuves pour « trouver l’aiguille dans la meule de foin ». À cette fin, Markus Otto collabore volontiers avec ses collègues de l’Institut MaxPlanck de médecine expérimentale de Göttingen, autour du Dr Olaf Jahn, et avec le chimiste Michael Przybylski en ce qui concerne « l’analyse protéomique des affinités ». Troisième arme : les procédés de spectroscopie de masse, qui supposent l’utilisation d’un appareil de Boehringer Ingelheim. Le procédé iTRAQ (Isobaric Tags for Related and Absolute Quantitation) permet également de séparer les protéines de poids moléculaire très proche en les fixant à différentes étiquettes chimiques (tags). Difficile à croire : un état d’excitation euphorique règne également à Ulm. La triple offensive contre les protéines des patients parkinsoniens avec et sans démence a révélé un candidat altéré en cas de démence. M. Otto se refuse à tout commentaire quant à l’identité de cette « protéine X ». Il révèle seulement qu’il s’agit d’une molécule de protéine relativement petite, susceptible d’exister sous une « isoforme » altérée. En d’autres termes, elle est repliée différemment que chez les sujets sains ou chez les parkinsoniens qui ne souffrent pas de démence. D’après M. Otto, en identifiant le facteur X il n’a pas seulement trouvé le marqueur recherché pour le diagnostic précoce d’une démence parkinsonienne. « Nous avons également des indices d’un mécanisme qui se déroule différemment en cas de maladie de Parkinson. » Le neurologue n’a pas peur des défis. « En laboratoire, on doit oser les ratages », dit-il. Au moment de la demande, rien ne laissait croire que le projet onéreux de protéomique donnerait des résultats tangibles. À présent, il semble que son partenaire Przybylski et lui n’aient rien raté, mais bel et bien réussi deux coups en un de manière imprévue. Le Professeur Dr Markus Otto (à gauche sur la photo) est professeur de neurologie et responsable du service de consultation externe de l’école supérieure de neurologie, clinique universitaire d’Ulm. Ce spécialiste de la « protéomique » recherche par diverses méthodes d’analyse les biomarqueurs pour le diagnostic différentiel et précoce de différentes maladies neurologiques telles que le Parkinson, la maladie d’Alzheimer et la sclérose latérale amyotrophique (SLA). Le Professeur Dr Dr h.c. Michael Przybylski (à droite sur la photo, avec un modèle de protéine) développe dans le laboratoire de chimie analytique et d’analyse structurale des biopolymères de l’Université de Constance de nouvelles méthodes pour les applications biomédicales. À l’aide de spectromètres de masse haute définition, il recherche les protéines responsables de maladies telles qu’Alzheimer ou Parkinson. Grâce à « l’analyse protéomique des affinités » développée dans son laboratoire, il identifie ces protéines plus rapidement qu’auparavant – et propose des approches thérapeutiques. PA R K I N S O N 109 3 1