fonctions tubulaires des polycystines 1 et 2
Transcription
fonctions tubulaires des polycystines 1 et 2
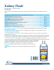
FONCTIONS TUBULAIRES DES POLYCYSTINES 1 ET 2 par D. JOLY*, A. HUMMEL*, A. RUELLO*, N. PATEY** et B. KNEBELMANN* La polykystose rénale autosomique dominante (PKRAD) est une affection héréditaire monogénique fréquente. Il s’agit d’une maladie systémique, susceptible d’affecter de nombreux organes. L’anomalie constante et caractéristique est le développement kystique de certains segments de néphrons, aboutissant à l’âge adulte à la formation de gros reins polykystiques. Les propriétés de l’épithélium kystique sont singulières, avec notamment un indice de prolifération plus élevé, une moindre différenciation, des anomalies de sécrétion et de polarité. La quasitotalité des cas de PKRAD sont dus à des mutations des gènes PKD1 et PKD2. Les produits de ces gènes, les polycystines-1 et -2, ont fait l’objet de nombreuses études expérimentales au cours des dernières années : structure, expression, localisation subcellulaire, partenaires protéiques, invalidation et surexpression notamment. Dans cette revue, nous verrons ce que ces travaux nous ont appris des propriétés biochimiques des polycystines. Nous évoquerons aussi le rôle des polycystines dans la tubulogenèse et la kystogenèse à la lumière de l’identification récente de leur première véritable fonction biologique au sein de l’épithélium tubulaire rénal : transmission de la mécanosensibilité dans les cils primaires. La polycystine-1 est une grande protéine glycosylée de 4 302 acides aminés et environ 500 kDa [1, 2], ancrée à la membrane cellulaire [3, 4]. Elle comporte un vaste domaine extracellulaire (environ 3 000 acides aminés), où plusieurs motifs protéiques sont juxtaposés [5] : deux domaines LRR riches en leucine (Leucine Rich Repeat) encadrés par deux régions riches en cystéine, un domaine WSC, un domaine lectine C-like, un domaine LDL-A (Low Density Lipoprotein-A), 16 copies d’un domaine unique PKD immunoglobuline-like, et un domaine REJ (receptor for egg jelly, apparenté au récepteur de l’oursin de mer, qui lie le * INSERM U 507, Service de Néphrologie. ** Service d’Anatomie pathologique, Hôpital NeckerEnfants Malades et Université Paris V, Paris. FLAMMARION MÉDECINE-SCIENCES — ACTUALITÉS NÉPHROLOGIQUES 2003 32 D. JOLY ET COLL. spermatozoïde à la gelée périphérique) [6]. La plupart de ces domaines, connus pour médier des interactions protéine-protéine ou protéine-hydrates de carbone, pourraient lier la polycystine-1 à un ou des ligand(s) de la matrice extracellulaire ou présent(s) à la surface d’autres cellules. À proximité de la membrane cellulaire, il existe un domaine GPS, qui est un site de clivage potentiel. Suivent 9 à 11 domaines transmembranaires. Entre les deux premiers, il existe un domaine PLAT (polycystin-1, lipo-oxygénase and α toxin) [7, 8] qui pourrait être impliqué dans l’interaction avec d’autres protéines intracellulaires. La partie C terminale intracytoplasmique de la polycystine-1, relativement courte (225 acides aminés), comprend un domaine coil-coiled (spirale hélicoïdale de type alpha) impliqué dans les interactions protéine-protéine [9], un domaine PEST qui serait impliqué dans la dégradation de la polycystine, et enfin plusieurs sites potentiels de tyrosinephosphorylation, serinephosphorylation, et de fixation pour des kinases [10, 11]. La polycystine-2 a la structure d’une protéine membranaire de 968 acides aminés, comprenant deux extrémités intracytoplasmiques et six domaines transmembranaires, qui partagent un fort degré d’homologie avec les 6 derniers domaines transmembranaires de la polycystine-1, mais aussi avec des canaux calcium ou sodium voltage dépendant (VAC) et des sous-unités de canaux récepteurs transitoires de potentiels (TRP chanels) [12]. La polycystine-2 comporte aussi un motif C-terminal intracytoplasmique de fixation du calcium appelé EF hand (fig. 1). Ces prédictions de structure ont permis de jeter les bases des toutes premières hypothèses fonctionnelles, largement confirmées par la suite : (i) la polycystine-1 serait le médiateur d’interactions cellule-matrice extracellulaire et d’interactions cellulecellule ; (ii) les polycystines pourraient traduire des signaux ; (iii) la polycystine-2 pourrait être un canal calcique. Aucune homologie structurale n’a cependant permis d’entrevoir immédiatement l’implication des polycystines dans les fonctions ciliaires. POLYCYSTINE-1 ET INTERACTIONS CELLULE-MATRICE EXTRACELLULAIRE Après avoir adhéré à la matrice extracellulaire (MEC) via la ligation d’intégrines, les cellules épithéliales forment des plaques d’adhésion focales, véritables complexes adhésifs multiprotéiques. In vitro, dans des conditions expérimentales favorisant les interactions cellule-MEC (tests d’adhésion au collagène I, cultures cellulaires non confluentes), la polycystine-1 est associée aux « protéines classiques » des plaques d’adhésion focales [13, 14]. Ces associations à la polycystine-1, démontrées par immunohistochimie et par co-immunoprécipitation, impliquent l’intégrine α2β1, des protéines de liaison au cytosquelette actinique (taline, vinculine, tensine, alpha-actinine), des protéines adaptatrices (p130Cas et paxilline), et des kinases (FAK-focal adhésion kinase-, pp60c-src). Ces résultats suggèrent que la polycystine-1 pourrait, en prenant part aux plaques d’adhésion focales, contribuer à la régulation des interactions entre MEC, membrane cellulaire et cytosquelette actinique, et à la signalisation FAK-dépendante. Ceci a été en grande partie confirmé in vivo lors des stades précoces du développement rénal humain normal [11], c’est-à-dire dans un contexte où la mise en jeu des interactions cellules-MEC semble revêtir une grande importance fonctionnelle [15]. D’autres β-caténine β-caténine TCF/LEF-1 Noyau FAK, pp60c-src PLAT GPS AP-1 NH2 Flux Urinaire milieu intracellulaire TRPC1 POLYCYSTINE-2 réticulum endoplasmique Ca++ membrane plasmatique Cystine milieu extracellulaire EF CD2AP HAX-1 COOH Ca++ cdk2 STAT1 JAK2 Coiled-coil Polaris Polycystine-2 Polycystine-1 (cis) Cycle : arrêt en GO/G1 p21 Gα Gβ Gγ Rac-1 Cdc42 POLYCYSTINE-1 domaines PKD C lectine LDL-A WSC LRR Cil primaire 1 ET 2 Interactions cellule-matrice FIG. 1. — Polycystines-1 et -2 : structure, localisation, partenaires protéiques prouvés ou probables (surlignés en noir) et voies de signalisation. Se référer au texte pour les détails. Desmosomes • desmoplakines • vimentine, desmine • cytokératines • filaments intermédiaires Polycystine-1 (trans) Jonctions adhérentes • E-cadhérine • caténines paxilline, p130 cas vinculine taline α-tensine REJ collagène I, laminine ? Région riche en cystéine S7 Adhésions focales Intégrine α2β1 Interactions cellule-cellule RG NH2 FONCTIONS TUBULAIRES DES POLYCYSTINES 33 34 D. JOLY ET COLL. résultats obtenus in vitro montrent plus directement qu’au moins deux domaines de la polycystine-1 sont susceptibles d’interagir avec des protéines de la MEC. Le domaine lectine C-like de la polycystine-1 (acides aminés 403-532) adhère fortement à des matrices riches en hydrates de carbone ainsi qu’aux collagènes de type I, II, et IV, ces adhésions nécessitant la présence de Ca2+ [16]. Les protéines de fusion LRR adhèrent pour leur part au collagène I, à la fibronectine, aux laminines, et réduisent de façon dose-dépendante la prolifération de cellules tubulaires en culture [17], suggérant le rôle fonctionnel de l’interaction entre domaines LRR de la polycystine-1 et matrice extracellulaire. L’inactivation de certains gènes impliqués dans les interactions cellule-MEC, comme la tensine ou Rho, induit une polykystose rénale [18, 19]. Au cours de la PKRAD, la perturbation des relations entre polycystine-1 et MEC pourrait théoriquement contribuer à la kystogenèse, mais ceci reste à prouver formellement. Lorsque les cellules tubulaires expriment une polycystine-1 tronquée, ni l’assemblage des plaques ni l’adhésion cellules-MEC ne sont globalement compromis [13]. Bien au contraire, l’adhésion entre épithélium kystique et MEC périkystique pourrait être renforcée par la surexpression du couple intégrine α2β1-collagene I [13, 20, 21], et par l’expression aberrante du couple α6β4-laminine 5 [22]. En revanche, l’expression d’une polycystine-1 tronquée s’accompagne d’un défaut de recrutement de FAK au sein des plaques d’adhésion focales, laissant présager d’un déficit de la signalisation par FAK en aval [11, 13]. POLYCYSTINE-1 ET INTERACTIONS CELLULE-CELLULE Une fois le développement rénal terminé, l’expression in vivo de la polycystine-1 n’est plus décelable aux points d’adhésions focales développés lors des interactions cellule-matrice, mais elle apparaît en revanche au sein des membranes latérales lors des interactions cellule-cellule [11, 23, 24]. Cette modification d’expression de la polycystine-1 est d’ailleurs observable lorsque les cultures cellulaires deviennent confluentes [11, 25, 26]. Au sein des ces membranes latérales, la polycystine-1 a été retrouvée dans plusieurs structures d’adhésion intercellulaire : jonctions serrées, et surtout jonctions adhérentes et desmosomes. Les jonctions adhérentes, décelables dans les membranes cellulaires latérales en dessous des jonctions serrées, sont assurées par des liaisons homophiles intercellulaires E-cadhérine/E-cadhérine et par l’association, via les α, β et γ-caténines, au cytosquelette actinique. En cultures de cellules tubulaires rénales confluentes, la polycystine-1 est associée au complexe E-cadhérine/β et γ-caténines, l’association étant renforcée par une concentration élevée de Ca2+ dans le milieu et par les inhibiteurs de la tyrosine phosphorylation [14]. La présence de la polycystine-1 au sein des jonctions adhérentes a été confirmée dans les cellules épithéliales pancréatiques HPAC et in vivo dans le rein fœtal humain normal [27]. Au sein des cellules tubulaires PKRAD, et donc en l’absence probable d’un complexe polycystine fonctionnel, la E-cadhérine n’est plus présente au sein de la membrane cellulaire latérale, mais semble séquestrée dans un compartiment intracellulaire [28]. Le défaut d’expression de la E-cadhérine ne semble avoir aucune conséquence sur l’adhésion des cellules, mais il perturbe en revanche le trafic intracellulaire des protides et lipides, du fait d’un retard majeur de leur transport FONCTIONS TUBULAIRES DES POLYCYSTINES 1 ET 2 35 vésiculaire depuis l’appareil de Golgi vers les membranes cellulaires basolatérales [28]. Cette anomalie d’exocytose pourrait être responsable de la classique mislocalisation apicale de certaines protéines au cours de la PKRAD, telles que EGFrécepteur ou encore la Na-K-ATPase [29]. La polycystine-1 semble être aussi associée aux desmosomes [30, 31], qui sont des structures d’adhésion intercellulaire distinctes des jonctions adhérentes, sachant toutefois que des structures hybrides existent, en particulier dans l’endothélium. Les desmosomes associent les cellules par des liaisons homophiles entre cadhérines desmosomales, lesquelles sont reliées au cytosquelette filamenteux intermédiaire via les plakoglobines, plakophillines et desmoplakines. Outre sa colocalisation avec les desmoplakines I et II, la polycystine-1 est fortement associée via sa partie C-terminale (motif coiled-coil) à plusieurs protéines des filaments intermédiaires (vimentine, desmine, cytokératines K8 et K18), ces résultats étant en partie confirmés in vivo [31]. La polycystine-1 ne semble pas indispensable à l’assemblage des desmosomes, mais pourrait en revanche jouer un rôle structural de renforcement des jonctions latérales, en particulier dans l’endothélium [30]. La mise en évidence d’une interaction homophile polycystine-1/polycystine-1 dans l’adhésion intercellulaire est plus récente. Des tests d’adhésion in vitro ont montré que les domaines PKD Ig-like II à XVI de la polycystine-1 sont capables de développer des interactions homophiles calcium-indépendantes. Cette propriété est théoriquement compatible avec des intéractions en cis (entre polycystines-1 sur la même membrane cellulaire) et/ou des intéractions en trans (entre polycystines-1 opposées lors de contacts intercellulaires). Les interactions en trans semblent avoir une réalité fonctionnelle dans l’adhésion intercellulaire, car les anticorps dirigés contre les domaines PKD de la polycystine-1 induisent la dissociation des cellules MDCK en culture [26]. La modification des interactions cellule-cellule secondairement aux mutations de la polycystine-1 pourrait constituer une étape importante de la kystogenèse, car outre leur rôle structural évident, les jonctions adhérentes et les desmosomes sont impliqués dans de très nombreuses voies de signalisation [32]. POLYCYSTINES ET FLUX URINAIRE : LA FONCTION CILIAIRE C’est grâce aux souris, aux nématodes, et aux algues vertes unicellulaires que l’on a compris que les cils cellulaires, structures jusqu’alors peu étudiées en néphrologie, étaient étroitement associés à la biologie de la polykystose rénale [33]. Les souris orpk, inv et cpk ont à la fois une polykystose rénale et des anomalies ciliaires. La disruption du gène orpk chez la souris (par le transgène Tg737 ou par invalidation spécifique) induit une polykystose récessive, mais aussi d’un défaut de l’axe gauche-droite attribué à l’absence de cils sur les cellules du nœud ventral [34, 35]. Le gène orpk code pour la polaris, protéine normalement présente dans les cils primaires et indispensable à leur assemblage [36]. Chez les souris inv/inv, la réexpression de la protéine, dénommée inversine et localisée aux cils primaires, corrige les anomalies de l’axe gauche-droite mais aussi le phénotype kystique [37, 38]. Les souris cpk développent une polykystose récessive ; la protéine, dénommée cystine, est localisée dans les cils [39]. Enfin dans l’un des modèles d’inactivation 36 D. JOLY ET COLL. du gène PKD2 chez la souris, un situs inversus et une dextrocardie ont été observés, évoquant une anomalie des fonctions ciliaires [40]. Chez le nématode C. elegans, les protéines lov-1, PKD2, et OSM-5 (homologues des gènes humains PKD1, PKD2 et polaris) sont colocalisées dans les neurones sensoriels [41] ; les mutations de ces protéines, qui agissent de façon non redondante dans une voie effectrice commune [42], compromettent la reproduction du vers mâle en affectant la structure ou la fonction sensorielle des cils [42, 43]. Plus directement, trois équipes ont démontré la présence de polycystine-2 [44] ou des polycystine-1, polycystine-2, polaris et cystine au sein des cils primaires des cellules épithéliales rénales en culture [45, 46]. On peut s’étonner que cette localisation si particulière des polycystines n’ait pas été décelée plus tôt. Cependant, les cils ne sont pas aisément visualisés par la microscopie optique [47], et leur mise en évidence in vitro requiert des conditions de culture particulières, avec notamment une polarisation cellulaire complète [45]. Un ou deux cils sont décelables à la surface de la plupart des cellules eucaryotes. Longs de 2 à 10 µm et d’un diamètre de 0,25 µm, ils font protrusion dans la lumière de tous les segments tubulaires [48]. Contrairement à ce qui est observé dans certains organismes inférieurs, les cils rénaux chez l’homme n’ont pas la capacité de propulser l’urine, d’où leur dénomination de cils primaires [49]. Leurs fonctions dans la lumière tubulaire pourraient être de faciliter la réabsorption des solutés, de concentrer des récepteurs membranaires pour les présenter à des ligands urinaires, ou encore de réagir comme rhéostat mécanosensoriel au flux urinaire. Cette dernière fonction a récemment été démontrée grâce à deux études remarquables. En réponse à un flux liquidien latéral, les cils se courbent tandis que le calcium intracellulaire augmente à partir de sources extracellulaires et de stocks intracellulaires [50] ; lorsque la polycystine-1 est mutée, ou lorsqu’on utilise des anticorps bloquants dirigés contre des domaines extracellulaires de la polycystine-1 ou de la polycystine-2, l’influx cellulaire calcique est aboli [46]. Ceci laisse penser que les cils sont capables de transmettre aux cellules tubulaires des signaux concernant le flux tubulaire [47]. La sensibilité de la polycystine-1 à l’inclinaison ciliaire pourrait être gouvernée par les interactions homophiles cis entre les domaines PKD évoquées plus haut [26], et/ou par le clivage extracellulaire de la polycystine-1, récemment démontré [51]. Dans la majorité des modèles murins de polykystose, les premiers kystes rénaux ne sont décelables qu’après 15,5 jours de gestation, soit après l’apparition d’une filtration glomérulaire. Cette observation est compatible avec l’hypothèse selon laquelle les mutations des polycystines pourraient induire la kystogenèse en compromettant la signalisation ciliaire du flux urinaire [52]. POLYCYSTINES ET TRANSDUCTION DU SIGNAL Les mutations de PKD1 et PKD2 ayant des conséquences cliniques quasiidentiques, l’hypothèse d’un « complexe polycystine » a été très logiquement formée. Plusieurs études ont depuis confirmé l’existence d’une interaction physique polycystine-1/polycystine-2, ainsi que la coopération fonctionnelle entre ces deux molécules dans le cadre de l’influx calcique et de plusieurs voies de signalisation intracellulaires. FONCTIONS TUBULAIRES DES POLYCYSTINES 1 ET 2 37 Interaction polycystine-1/polycystine-2 Le domaine coiled-coil de la polycystine-1 interagit in vitro avec la partie carboxyterminale de la polycystine-2 [53-55]. De fait, l’existence in vivo d’un complexe natif polycystine-1/polycystine-2 a été récemment confirmée [56]. Alors que la polycystine-1 est localisée à la membrane plasmatique, la polycystine-2 endogène semble pouvoir être localisée à la fois à la membrane plasmatique et aux membranes du réticulum endoplasmique [57, 58], cette dualité n’empêche en rien l’interaction physique entre les deux molécules [56, 59, 60]. La polycystine-2 est plus volontiers localisée à la membrane plasmatique lorsque la polycystine-1 est surexprimée, lorsqu’on utilise des molécules chaperones ou des modulateurs du protéasome [57, 61] ; cette localisation devient exclusive même lorsque le domaine de rétention au réticulum endoplasmique de la polycystine-2 est muté [25, 58]. Un des enjeux de la recherche actuelle est de mieux comprendre comment la polycystine-2 est transloquée du réticulum endoplasmique à la membrane plasmatique. Il est théoriquement possible que (i) les fonctions du complexe polycystine soient régulées par la localisation subcellulaire de la polycystine-2 et/ou le degré d’association polycystine-1/polycystine-2 ; (ii) les polycystines-1 et 2 aient des fonctions autonomes en dehors de leur association. Il a par exemple été suggéré que la polycystine-2, par son association à des éléments du cytosquelette d’actine tels que CD2AP et HAX-1 [62, 63], pourrait avoir un rôle structural propre. Activité canal ionique des polycystines L’hypothèse selon laquelle la polycystine-2 formerait en se dimérisant un canal ionique membranaire était initialement basée sur son homologie structurale avec des canaux VAC (calcium ou sodium voltage dépendants) et TRP (récepteurs transitoires de potentiels). Les premiers résultats probants démontrant in vitro une fonction de canal cation non sélectif n’ont cependant pas été obtenus avec la polycystine-2, mais avec une protéine à 50 p. 100 identique, la polycystine-L [64]. Par la suite, la fonction canal cation non sélective calcium-sensible de la polycystine-2 a été démontrée à partir de la protéine purifiée [65], de la protéine exprimée par des oocystes de Xenope [61], et enfin par la protéine exprimée par le réticulum endoplasmique de cellules épithéliales LLC-PK1 [59]. Les travaux précédents suggéraient que l’activité canal cation de la polycystine-2 s’exerçait indépendamment de la polycystine-1. D’autres équipes ont cependant observé que l’activité canal cation de la polycystine-2 nécessitait la coopération de la polycystine-1, au sein des oocystes de Xenope et dans les cellules CHO [57, 66] ; de plus, lorsque les cils primaires de cellules embryonnaires rénales soumis à un flux liquidien « physiologique », les polycystines-1 et -2 sont indispensables à la transmission de l’influx calcique [46], renforçant l’hypothèse d’un complexe fonctionnel polycystine. L’influx calcique secondaire à l’inclinaison ciliaire nécessite à la fois la présence de calcium extracellulaire et de récepteurs intracellulaires à la ryanodine ; l’augmentation du calcium intracytosolique pourrait donc se faire à partir du milieu extracellulaire puis à partir des stocks du réticulum endoplasmique [46]. Il a été suggéré que d’autres voies d’influx du calcium pourraient s’associer au complexe polycystine, comme par exemple le canal TRPC1 [67], mais la valeur fonctionnelle de cette association est inconnue à ce jour. Les conséquences de l’augmentation 38 D. JOLY ET COLL. du calcium sur la transcription des gènes et le trafic protéique intracellulaire sont très nombreuses. Récemment, un cas de polykystose humaine a été attribué à une mutation de la polycystine-2 dont le seul effet décelable était de rendre le canal calcique inopérant. Cette observation exceptionnelle suggère que les anomalies de la signalisation calcique polycystine-dépendantes pourraient suffire à induire la kystogenèse [59]. Voie des protéines G De façon globale, les protéines G régulent de nombreux programmes de signalisation cellulaire, tous potentiellement impliqués dans la kystogenèse (activité des canaux ioniques, prolifération, différenciation, polarisation cellulaire…). La partie C-terminale cytosolique de la polycystine-1 contient une séquence très conservée de 20 acides aminés, capable de lier et d’activer les protéines G hétérotrimériques : activation de la sous unité Gα et relargage des sous-unités Gβ et Gγ [68, 69]. La fonction de « récepteur-activateur » de la polycystine-1 visà-vis des protéines G hétérotrimériques est considérablement réduite par l’interaction physique polycystine-2/polycystine-1 [69], suggérant que polycystine-2 et protéines G entrent en compétition pour se lier à la polycystine-1. L’interaction entre polycystine-1 et RGS7 pourrait jouer un rôle modulateur supplémentaire. RGS7 est une protéine « régulatrice des protéines G », qui accélère l’activité GTPasique intrinsèque et limite l’action de certaines sous unités G alpha ; en retenant RGS7 près de la membrane, la polycystine-1 diminue sa dégradation par le protéasome [70]. À ce jour, deux études soulignent le rôle fonctionnel de l’interaction polycystine-1-protéines G. La première montre que l’activation de canaux ioniques hétérologues Ca2+ et K+ est modulée par le relargage polycystine-1 dépendant des sous-unités Gβ et Gγ [69]. La seconde rapporte la transactivation du promoteur du gène AP-1 par l’expression du domaine C-terminal de PKD1 à la surface de cellules embryonnaires rénales humaines 293T ; cette transactivation est dépendante de deux kinases (PKCα et JNK) mais aussi de deux petites protéines G de la famille Rho, Rac-1 et Cdc42 [71]. L’étude de ces voies de signalisation est théoriquement prometteuse. Les protéines Rho régulent l’organisation du cytosquelette d’actine et influencent la forme, la motilité et l’adhésion cellulaires ; en aval, une des nombreuses cibles des protéines G, le gène AP-1, est impliqué dans la régulation de la différenciation, la prolifération et l’apoptose. AP-1 est non seulement activé par la polycystine-1 (voie PKCα/JNK), mais aussi par la polycystine-2, avec une voie de signalisation différente (voie PKCε/MAP kinase p38) [72]. Cependant, on ignore encore si les mutations des polycystines ont un effet relevant in vivo sur la signalisation par les protéines G et/ou les fonctions du gène AP-1, et comment ces anomalies contribuent à la kystogenèse. Voie Wnt/β-caténine La β-caténine est une protéine multifonctionnelle ; outre son implication structurale dans les jonctions adhérentes dans le cadre de liaisons avec E-cadhérine et actine (cf. plus haut), la β-caténine sous forme soluble peut être transloquée dans le noyau, s’associer aux facteurs de transcription TCF/LEF, et moduler FONCTIONS TUBULAIRES DES POLYCYSTINES 1 ET 2 39 l’expression de gènes cibles [73]. Le niveau de β-caténine soluble est régulé par le complexe moléculaire APC/axine/GSK3β, qui lie la β-caténine, la phosphoryle et assure ainsi sa dégradation par le protéasome. L’activation de la voie Wnt inhibe GSK3β et stabilise la β-caténine, qui s’accumule dans le cytoplasme et le noyau. Plusieurs observations ont impliqué la β-caténine dans la tubulogenèse normale ou pathologique. La stabilisation expérimentale du complexe β-caténine/APC empêche la libération de β-caténine libre active, ce qui bloque la tubulogenèse in vitro les cellules MDCK [74]. La demi-vie de la β-caténine soluble est augmentée dans les lignées de souris cpk dans les cellules ADPKD, et sa surexpression chez la souris induit la formation de kystes rénaux [75]. La surexpression de c-myc, une de ces cibles nucléaires de la β-caténine, induit elle aussi un phénotype rénal kystique [76]. Nous avons vu que la polycystine-1 était colocalisée avec la β-caténine au sein des jonctions adhérentes dans les cellules épithéliales normales ; la surexpression transitoire de la partie C-terminale de la polycystine-1 stabilise la β-caténine soluble endogène en la protégeant du protéasome, et stimule la transcription d’un gène cible de β-caténine-TCF/LEF1, le gène siamois [77]. Ces résultats, en partie confirmés in vivo chez le zebrafish, suggèrent que la polycystine-1 a la capacité de renforcer la voie de signalisation Wnt durant le développement rénal [77]. Plusieurs membres de la famille Wnt sont impliqués dans la morphogenèse rénale [78]. Un des gènes cibles de la voie Wnt pourrait d’ailleurs être le gène PKD1 luimême [79]. Voie JAK-STAT Une des caractéristiques de l’épithélium kystique est son taux de prolifération excessif [80-82]. In vitro, la surexpression de la polycystine-1 inhibe la prolifération cellulaire [83] ; des résultats récents démontrent que cet effet pourrait être dû à l’impact des polycystines sur le cycle cellulaire. En effet, la polycystine-1 active, uniquement en coopération avec la polycystine-2, la voie JAK/STAT, aboutissant à l’activation de p21 (waf1), qui est l’inhibiteur de la cycline-dépendante kinase Cdk2 ; en l’absence de Cdk2, les cellules ne peuvent progresser dans le cycle cellulaire et restent bloquées en phase GO/G1 [84]. Ces résultats sont corroborés par le fait qu’in vivo, il existe un déficit d’expression de p21 (waf1) au cours des polykystoses murine [84] et humaine [85]. POLYCYSTINES ET TUBULOGENÈSE Les cellules rénales canines MDCK cultivées en gel 3D collagénique forment des kystes, spontanément ou après stimulation par HGF ; au cours de cette kystogenèse, la polycystine-1 a curieusement une expression réduite de 50 p. 100 et une localisation cytoplasmique aberrante [86]. Au contraire, les cellules MDCK surexprimant la polycystine-1 complète ont une croissance réduite, une résistance à l’apoptose augmentée, et forment spontanément des tubules [83]. Dans les cellules rénales humaines IMCD, la transfection d’une portion C-terminale de la polycystine-1 induit la motilité, la morphogenèse branchée et l’apparition de tubules ; cet effet est indépendant de toute interaction polycystine-1-ligands extracellulaires, 40 D. JOLY ET COLL. indépendant de l’axe HGF-ERK, et met en jeu un axe original, faisant intervenir la polycystine-2 et la protéine kinase C-α [87]. Dans autre modèle in vitro proche de la tubulogenèse (formation de dômes par les cellules pancréatiques SU.86.86), l’expression nucléique et protéique de la polycystine-1 est spontanément augmentée. Ces expériences suggèrent essentiellement que la polycystine-1 induit un axe morphogénétique spécifique, et que son expression est régulée au cours du développement tubulaire normal ou pathologique. La régulation de l’expression de la polycystine-1 lors de la tubulogenèse a été confirmée in vivo [24, 88-92]. Au cours du développement rénal humain, la polycystine-1 est indécelable au sein du blastème et des néphrons immatures, et apparaît initialement dans les tubes proximaux différenciés ; son expression diminue ensuite tout au long de la vie fœtale pour être quasi-indétectable à l’âge adulte [88]. La polycystine-2 est exprimée plus précocement et diffusément au cours de la néphrogenèse, suggérant que les polycystines pourraient avoir des partenaires protéiques et des fonctions au moins partiellement différents durant la néphrogenèse [88, 93]. D’autres groupes ont rapporté des profils d’expression spatiotemporelle polycystine-1/polycystine-2 comparables durant la vie fœtale [89], avec à l’âge adulte une expression rénale nettement réduite et confinée aux segments distaux du néphron [4, 13, 94, 95]. Récemment, deux groupes ont rapporté la réexpression tubulaire diffuse et intense de la polycystine-2 chez le rat adulte après induction de lésions tubulaires expérimentales, observation compatible avec un rôle actif des polycystines durant la tubulogenèse réparatrice [96, 97]. POLYCYSTINES ET KYSTOGENÈSE Initiation de la kystogenèse : la théorie du double-hit Les microdissections effectuées sur des reins polykystiques à des stades précoces ont montré que les kystes ne se développent que dans moins de 10 p. 100 des néphrons, avec un développement initialement focal quasi sacculaire, aux dépens de n’importe lequel des segments tubulaires [98]. Ces constatations sont compatibles avec la théorie du « double-hit » : alors que toutes les cellules sont initialement porteuses du même matériel génétique (et en particulier du même événement mutationnel « germinal », la mutation PKD parentale), seule une fraction d’entre elles subissent un deuxième événement moléculaire « somatique », induisant la kystogenèse. En accord avec cette théorie, il a été a montré que les cellules dérivées d’un kyste rénal ou hépatique résultent le plus souvent de l’expansion monoclonale d’une cellule porteuse d’une double mutation PKD1 ou PKD2 [99-103]. Compte tenu du grand nombre de kystes apparaissant au cours de la vie, la fréquence du second événement somatique (délétion ou mutation ponctuelle) peut sembler anormalement élevée. Parmi les explications à ce phénomène, citons le fort taux d’événements secondaires somatiques au sein des cellules rénales [104], ou encore la présence d’une séquence polypyrimidine particulièrement longue (2,5 kB) au sein de l’intron 21 du gène PKD1, conférant à la région une instabilité propice à l’apparition de lésions de l’ADN au cours de la mitose. Il semble donc probable que la double inactivation de PKD1 ou de PKD2, procurant à une cellule tubulaire FONCTIONS TUBULAIRES DES POLYCYSTINES 1 ET 2 41 un avantage de croissance et favorisant son expansion clonale, soit l’événement moléculaire initiateur de la kystogenèse. Les modèles murins d’invalidation des gènes PKD1 et PKD2 ont renforcé l’hypothèse du « double hit ». Les souris hétérozygotes PKD1+/– (délétion de l’exon 34) naissent normales mais développent à un âge avancé des kystes rénaux et hépatiques, pour lesquels les marquages par anticorps anti-Pkd1 sont négatifs [105]. Les souris homozygotes PKD1–/– meurent in utero ou en période néonatale avec une polykystose rénale massive [106]. Les souris PKD2+/– (disruption ciblée dans l’exon 1) développent un faible nombre de kystes tandis que les souris Pkd2–/– décèdent in utero [107]. À ce jour toutefois, en attendant la mise au point d’un knock-out conditionnel PKD1, le modèle murin le plus proche de la polykystose rénale dominante humaine reste la souris hétérozygote PKD2WS25/–, qui porte un allèle sain WS25 « instable » car prédisposé à former après recombinaison somatique un allèle nul. Les souris PKD2WS25/– sont viables et développent des kystes à mesure que les recombinaisons somatiques de WS25 aboutissant à l’allèle nul se produisent [107]. Dans tous les cas, les marquages kystiques par les anticorps anti-PKD2 sont négatifs, ce qui suggère que la perte totale de la protéine est nécessaire à la kystogenèse. Cependant, la monoclonalité des cellules de la paroi d’un kyste est inconstante, et le « double-hit » ne semble pas être le seul mécanisme génétique sous-jacent à la formation des kystes. On sait par exemple qu’il existe dans certains kystes des mutations « trans-hétérozygotes », touchant un des deux gènes PKD en germinal et l’autre en somatique [108, 109]. Le phénotype des souris trans-hétérozygotes PKD1+/−/PKD2+/− est plus sévère que l’addition des phénotypes hétérozygotes PKD1+/−/PKD2+/− , suggérant que réduction de la dose de polycystine en deçà d’un seuil critique, ou « haplo-insuffisance », pourrait contribuer à la formation de certains kystes [110]. Enfin, bien qu’ils n’aient jamais été prouvés, deux autres mécanismes moléculaires de la kystogenèse sont théoriquement possibles : polycystine mutante inhibant la polycystine normale (effet dominant négatif), ou ayant une activité biologique augmentée/nouvelle (effet dominant « gain de fonction »). Progression des kystes : la théorie du stop-signal Les souris ayant une invalidation homozygote des polycystines-1 ou -2 ont un développement tubulaire macroscopiquement normal jusqu’à 15,5 jours de gestation, date à laquelle apparaissent simultanément le débit de filtration glomérulaire et les premiers kystes rénaux. Cette double observation suggère que les polycystines ne sont pas indispensables aux phases initiales de la néphrogenèse ; elle suggère aussi que l’apparition du flux urinaire transmet aux cellules tubulaires l’ordre d’interrompre leur développement et de se différencier complètement, aboutissant en situation normale au parfait calibrage du diamètre tubulaire. Au sein des cils rénaux, les polycystines sont les structures de choix pour transmettre aux cellules les informations d’un tel « stop signal » mécanosensoriel. Incapables de percevoir le signal ciliaire, les cellules pourraient devenir hyperprolifératives, dédifférenciées, et entammer un remodelage tubulaire aberrant aboutissant au kyste. Si l’absence de « stop signal » contribue effectivement à la progression des kystes, les agents pharmacologiques améliorant les fonctions ciliaires [111] ou mimant l’activation du complexe polycystine pourraient ouvrir des voies thérapeutiques décisives. 42 D. JOLY ET COLL. CONCLUSION La première grande fonction biologique des polycystines vient probablement d’être découverte : au sein des cils primaires des cellules épithéliales rénales, le complexe polycystine réagit au flux liquidien en augmentant l’influx calcique local [46]. Si cette fonction contrôle effectivement le diamètre et la différenciation tubulaires, toute anomalie ciliaire anatomique et/ou fonctionnelle pourrait induire la kystogenèse non seulement rénale, mais aussi hépatique et pancréatique. Les autres localisations subcellulaires et voies de transduction du signal évoquées dans cette revue ont été identifiées dans des conditions moins physiologiques : ont-elle une réalité biologique ? Si c’est la cas, de nouveaux ligands du complexe polycystine et de nouvelles fonctions restent à découvrir. BIBLIOGRAPHIE 1. The polycystic kidney disease 1 gene encodes a 14 kb transcript and lies within a duplicated region on chromosome 16. The European Polycystic Kidney Disease Consortium. Cell, 1994, 77, 881-894. 2. SANDFORD R, SGOTTO B, APARICIO S et al. Comparative analysis of the polycystic kidney disease 1 (PKD1) gene reveals an integral membrane glycoprotein with multiple evolutionary conserved domains. Hum Mol Genet, 1997, 6, 1483-1489. 3. GENG L, SEGAL Y, PEISSEL B et al. Identification and localization of polycystin, the PKD1 gene product. J Clin Invest, 1996, 98, 2674-2682. 4. IBRAGHIMOV-BESKROVNAYA O, DACKOWSKI WR, FOGGENSTEINER L et al. Polycystin : in vitro synthesis, in vivo tissue expression, and subcellular localization identifies a large membraneassociated protein. Proc Natl Acad Sci USA, 1997, 94, 6397-6402. 5. HUGHES J, WARD CJ, PERAL B et al. The polycystic kidney disease 1 (PKD1) gene encodes a novel protein with multiple cell recognition domains. Nat Genet, 1995, 10, 151-160. 6. MOY GW, MENDOZA LM, SCHULZ JR et al. The sea urchin sperm receptor for egg jelly is a modular protein with extensive homology to the human polycystic kidney disease protein, PKD1. J Cell Biol, 1996, 133, 809-817. 7. PONTING CP, HOFMANN K, BORK P. A latrophilin/CL-1-like GPS domain in polycystin-1. Curr Biol 1999, 9, R585-588. 8. BATEMAN A, SANDFORD R. The PLAT domain : a new piece in the PKD1 puzzle. Curr Biol 1999, 9, R588-590. 9. LUPAS A. Coiled coils : new structures and new functions. Trends Biochem Sci, 1996, 21, 375-382. 10. LI HP, GENG L, BURROW CR et al. Identification of phosphorylation sites in the PKD1-encoded protein C-terminal domain. Biochem Biophys Res Commun 1999, 259, 356-363. 11. WILSON PD. Polycystin : new aspects of structure, function, and regulation. J Am Soc Nephrol, 2001, 12, 834-845. 12. MOCHIZUKI T, WU G, HAYASHI T et al. PKD2, a gene for polycystic kidney disease that encodes an integral membrane protein. Science, 1996, 272, 1339-1342. 13. WILSON PD, GENG L, Li X, BURROW CR. The PKD1 gene product, polycystin-1, is a tyrosinephosphorylated protein that colocalizes with alpha2beta1-integrin in focal clusters in adherent renal epithelia. Lab Invest, 1999, 79, 1311-1323. 14. GENG L, BURROW CR, LI H et al. Modification of the composition of polycystin-1 multiprotein complexes by calcium and tyrosine phosphorylation. Biochim Biophys Acta, 2000, 1535, 21-35. 15. ZENT R, BUSH KT, POHL ML et al. Involvement of laminin binding integrins and laminin-5 in branching morphogenesis of the ureteric bud during kidney development. Dev Biol, 2001, 238, 289-302. 16. WESTON BS, BAGNERIS C, PRICE RG et al. The polycystin-1 C-type lectin domain binds carbohydrate in a calcium-dependent manner, and interacts with extracellular matrix proteins in vitro. Biochim Biophys Acta, 2001, 1536, 161-176. FONCTIONS TUBULAIRES DES POLYCYSTINES 1 ET 2 43 17. MALHAS AN, ABUKNESHA RA, PRICE RG. Interaction of the leucine-rich repeats of polycystin-1 with extracellular matrix proteins : possible role in cell proliferation. J Am Soc Nephrol, 2002, 13, 19-26. 18. LO SH, YU QC, DEGENSTEIN L et al. Progressive kidney degeneration in mice lacking tensin. J Cell Biol 1997, 136, 1349-1361. 19. TOGAWA A, MIYOSHI J, ISHIZAKI H et al. Progressive impairment of kidneys and reproductive organs in mice lacking Rho GDIalpha. Oncogene, 1999, 18, 5373-5380. 20. VAN ADELSBERG J. Murine polycystic kidney epithelial cell lines have increased integrin-mediated adhesion to collagen. Am J Physiol, 1994, 267, F1082-1093. 21. DAIKHA-DAHMANE F, NARCY F, DOMMERGUES M et al. Distribution of alpha-integrin subunits in fetal polycystic kidney diseases. Pediatr Nephrol, 1997, 11, 267-273. 22. JOLY D, HUMMEL A, RUELLO A et al. Laminin 5 and β4 integrin contribution to autosomal dominant polycystic kidney disease proliferation. J Am Soc Nephrol, 2002, 13, IIIA. 23. FOGGENSTEINER L, BEVAN AP, THOMAS R et al. Cellular and subcellular distribution of polycystin-2, the protein product of the PKD2 gene. J Am Soc Nephrol, 2000, 11, 814-827. 24. VAN ADELSBERG J, CHAMBERLAIN S, D’AGATI V. Polycystin expression is temporally and spatially regulated during renal development. Am J Physiol, 1997, 272, F602-609. 25. BOLETTA A, QIAN F, ONUCHIC LF et al. Biochemical characterization of bona fide polycystin-1 in vitro and in vivo. Am J Kidney Dis, 2001, 38, 1421-1429. 26. IBRAGHIMOV-BESKROVNAYA O, BUKANOV NO, DONOHUE LC et al. Strong homophilic interactions of the Ig-like domains of polycystin-1, the protein product of an autosomal dominant polycystic kidney disease gene, PKD1. Hum Mol Genet, 2000, 9, 1641-1649. 27. HUAN Y, VAN ADELSBERG J. Polycystin-1, the PKD1 gene product, is in a complex containing E-cadherin and the catenins. J Clin Invest, 1999, 104, 1459-1468. 28. CHARRON AJ, NAKAMURA S, BACALLAO R et al. Compromised cytoarchitecture and polarized trafficking in autosomal dominant polycystic kidney disease cells. J Cell Biol, 2000, 149, 111-124. 29. WILSON PD. Epithelial cell polarity and disease. Am J Physiol, 1997, 272, F434-442. 30. SCHEFFERS MS, VAN DER BENT P, PRINS F et al. Polycystin-1, the product of the polycystic kidney disease 1 gene, co-localizes with desmosomes in MDCK cells. Hum Mol Genet, 2000, 9, 2743-2750. 31. XU GM, SIKANETA T, SULLIVAN BM et al. Polycystin-1 interacts with intermediate filaments. J Biol Chem, 2001, 276, 46544-46552. 32. GREEN KJ, GAUDRY CA. Are desmosomes more than tethers for intermediate filaments ? Nat Rev Mol Cell Biol, 2000, 1, 208-216. 33. CALVET JP. Cilia in PKD-letting it all hang out. J Am Soc Nephrol, 2002, 13, 2614-2616. 34. MURCIA NS, RICHARDS WG, YODER BK et al. The Oak Ridge Polycystic Kidney (orpk) disease gene is required for left-right axis determination. Development, 2000, 127, 2347-2355. 35. PAZOUR GJ, DICKERT BL, VUCICA Y et al. Chlamydomonas IFT88 and its mouse homologue, polycystic kidney disease gene tg737, are required for assembly of cilia and flagella [In Process Citation]. J Cell Biol, 2000, 151, 709-718. 36. TAULMAN PD, HAYCRAFT CJ, BALKOVETZ DF et al. Polaris, a protein involved in left-right axis patterning, localizes to basal bodies and cilia. Mol Biol Cell, 2001, 12, 589-599. 37. MOCHIZUKI T, SAIJOH Y, TSUCHIYA K et al. Cloning of inv, a gene that controls left/right asymmetry and kidney development. Nature, 1998, 395, 177-181. 38. MORGAN D, ELEY L, SAYER J et al. Expression analyses and interaction with the anaphase promoting complex protein Apc2 suggest a role for inversin in primary cilia and involvement in the cell cycle. Hum Mol Genet, 2002, 11, 3345-3350. 39. HOU X, MRUG M, YODER BK et al. Cystin, a novel cilia-associated protein, is disrupted in the cpk mouse model of polycystic kidney disease. J Clin Invest, 2002, 109, 533-540. 40. PENNEKAMP P, KARCHER C, FISCHER A et al. The ion channel polycystin-2 is required for leftright axis determination in mice. Curr Biol, 2002, 12, 938-943. 41. BARR MM, STERNBERG PW. A polycystic kidney-disease gene homologue required for male mating behaviour in C. elegans. Nature, 1999, 401, 386-389. 42. BARR MM, DEMODENA J, BRAUN D et al. The Caenorhabditis elegans autosomal dominant polycystic kidney disease gene homologs lov-1 and pkd-2 act in the same pathway. Curr Biol, 2001, 11, 1341-1346. 43. HAYCRAFT CJ, SWOBODA P, TAULMAN PD et al. The C. elegans homolog of the murine cystic kidney disease gene Tg737 functions in a ciliogenic pathway and is disrupted in osm-5 mutant worms. Development, 2001, 128, 1493-1505. 44. PAZOUR GJ, SAN AGUSTIN JT, FOLLIT JA et al. Polycystin-2 localizes to kidney cilia and the ciliary level is elevated in orpk mice with polycystic kidney disease. Curr Biol, 2002, 12, R378-380. 44 D. JOLY ET COLL. 45. YODER BK, HOU X, GUAY-WOODFORD LM. The polycystic kidney disease proteins, polycystin-1, polycystin-2, polaris, and cystin, are co-localized in renal cilia. J Am Soc Nephrol, 2002, 13, 2508-2516. 46. NAULI SM, ALENGHAT FJ, LUO Y et al. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nat Genet, 2003, 83, 123-135. 47. SCHWARTZ EA, LEONARD ML, BIZIOS R et al. Analysis and modeling of the primary cilium bending response to fluid shear. Am J Physiol, 1997, 272, F132-138. 48. WHEATLEY DN. Primary cilia in normal and pathological tissues. Pathobiology, 1995, 63, 222238. 49. ROTH KE, RIEDER CL, BOWSER SS. Flexible-substratum technique for viewing cells from the side : some in vivo properties of primary (9+0) cilia in cultured kidney epithelia. J Cell Sci, 1988, 89 (Pt 4), 457-466. 50. PRAETORIUS HA, SPRING KR. Bending the MDCK cell primary cilium increases intracellular calcium. J Membr Biol, 2001, 184, 71-79. 51. QIAN F, BOLETTA A, BHUNIA AK et al. Cleavage of polycystin-1 requires the receptor for egg jelly domain and is disrupted by human autosomal-dominant polycystic kidney disease 1-associated mutations. Proc Natl Acad Sci USA, 2002, 99, 16981-16986. 52. IGARASHI P, SOMLO S. Genetics and pathogenesis of polycystic kidney disease. J Am Soc Nephrol, 2002, 13, 2384-2398. 53. QIAN F, GERMINO FJ, CAI Y et al. PKD1 interacts with PKD2 through a probable coiled-coil domain. Nat Genet, 1997, 16, 179-183. 54. HANAOKA K, GUGGINO WB. cAMP regulates cell proliferation and cyst formation in autosomal polycystic kidney disease cells. J Am Soc Nephrol, 2000, 11, 1179-1187. 55. TSIOKAS L, KIM E, ARNOULD T et al. Homo- and heterodimeric interactions between the gene products of PKD1 and PKD2. Proc Natl Acad Sci USA, 1997, 94, 6965-6970. 56. NEWBY LJ, STREETS AJ, ZHAO Y et al. Identification, characterization, and localization of a novel kidney polycystin-1-polycystin-2 complex. J Biol Chem, 2002, 277, 20763-20773. 57. HANAOKA K, QIAN F, BOLETTA A et al. Co-assembly of polycystin-1 and -2 produces unique cation-permeable currents. Nature, 2000, 408, 990-994. 58. CAI Y, MAEDA Y, CEDZICH A et al. Identification and characterization of polycystin-2, the PKD2 gene product. J Biol Chem, 1999, 274, 28557-28565. 59. KOULEN P, CAI Y, GENG L et al. Polycystin-2 is an intracellular calcium release channel. Nat Cell Biol, 2002, 4, 191-197. 60. SCHEFFERS MS, LE H, VAN DER BENT P et al. Distinct subcellular expression of endogenous polycystin-2 in the plasma membrane and Golgi apparatus of MDCK cells. Hum Mol Genet, 2002, 11, 59-67. 61. VASSILEV PM, GUO L, CHEN XZ et al. Polycystin-2 is a novel cation channel implicated in defective intracellular Ca2+ homeostasis in polycystic kidney disease. Biochem Biophys Res Commun, 2001, 282, 341-350. 62. LEHTONEN S, ORA A, OLKKONEN VM et al. In vivo interaction of the adapter protein CD2-associated protein with the type 2 polycystic kidney disease protein, polycystin-2 [In Process Citation]. J Biol Chem 2000, 275, 32888-32893. 63. GALLAGHER AR, CEDZICH A, GRETZ N et al. The polycystic kidney disease protein PKD2 interacts with Hax-1, a protein associated with the actin cytoskeleton. Proc Natl Acad Sci USA, 2000, 97, 4017-4022. 64. CHEN XZ, VASSILEV PM, BASORA N et al. Polycystin-L is a calcium-regulated cation channel permeable to calcium ions. Nature 1999, 401, 383-386. 65. GONZALEZ-PERRET S, KIM K, IBARRA C et al. Polycystin-2, the protein mutated in autosomal dominant polycystic kidney disease (ADPKD), is a Ca2+-permeable nonselective cation channel. Proc Natl Acad Sci USA, 2001, 98, 1182-1187. 66. VANDORPE DH, CHERNOVA MN, JIANG L et al. The cytoplasmic carboxy-terminal fragment of polycystin-1 (PKD1) regulates a Ca2+-permeable cation channel. J Biol Chem, 2001, 276, 4093101. 67. TSIOKAS L, ARNOULD T, ZHU C et al. Specific association of the gene product of PKD2 with the TRPC1 channel. Proc Natl Acad Sci USA, 1999, 96, 3934-3939. 68. PARNELL SC, MAGENHEIMER BS, MASER RL et al. The polycystic kidney disease-1 protein, polycystin-1, binds and activates heterotrimeric G-proteins in vitro. Biochem Biophys Res Commun, 1998, 251, 625-631. 69. DELMAS P, NOMURA H, LI X et al. Constitutive activation of G-proteins by polycystin-1 is antagonized by polycystin-2. J Biol Chem, 2002, 277, 11276-11283. FONCTIONS TUBULAIRES DES POLYCYSTINES 1 ET 2 45 70. KIM E, ARNOULD T, SELLIN L et al. Interaction between RGS7 and polycystin. Proc Natl Acad Sci USA, 1999, 96, 6371-6376. 71. ARNOULD T, KIM E, TSIOKAS L et al. The polycystic kidney disease 1 gene product mediates protein kinase C alpha-dependent and c-Jun N-terminal kinase-dependent activation of the transcription factor AP-1. J Biol Chem, 1998, 273, 6013-6018. 72. ARNOULD T, SELLIN L, BENZING T et al. Cellular activation triggered by the autosomal dominant polycystic kidney disease gene product PKD2. Mol Cell Biol, 1999, 19, 3423-3434. 73. ROOSE J, CLEVERS H. TCF transcription factors : molecular switches in carcinogenesis. Biochim Biophys Acta, 1999, 1424, M23-M37. 74. POLLACK AL, BARTH AI, ALTSCHULER Y et al. Dynamics of beta-catenin interactions with APC protein regulate epithelial tubulogenesis. J Cell Biol, 1997, 137, 1651-1662. 75. TRUDEL M, BARISONI L, LANOIX J et al. Polycystic kidney disease in SBM transgenic mice : role of c-myc in disease induction and progression. Am J Pathol, 1998, 152, 219-229. 76. ROMAGNOLO B, BERREBI D, SAADI-KEDDOUCCI S et al. Intestinal dysplasia and adenoma in transgenic mice after overexpression of an activated beta-catenin. Cancer Res, 1999, 59, 38753879. 77. KIM E, ARNOULD T, SELLIN LK et al. The polycystic kidney disease 1 gene product modulates Wnt signaling. J Biol Chem, 1999, 274, 4947-4953. 78. LIPSCHUTZ JH. Molecular development of the kidney : a review of the results of gene disruption studies. Am J Kidney Dis, 1998, 31, 383-397. 79. RODOVA M, ISLAM MR, MASER RL et al. The polycystic kidney disease-1 promoter is a target of the beta-catenin/T-cell factor pathway. J Biol Chem, 2002, 277, 29577-29583. 80. GRANTHAM JJ. 1992 Homer Smith Award. Fluid secretion, cellular proliferation, and the pathogenesis of renal epithelial cysts. J Am Soc Nephrol, 1993, 3, 1841-1857. 81. GRANTHAM JJ. Polycystic kidney disease : neoplasia in disguise. Am J Kidney Dis, 1990, 15, 110-116. 82. NADASDY T, LASZIK Z, LAJOIE G et al. Proliferative activity of cyst epithelium in human renal cystic diseases. J Am Soc Nephrol, 1995, 5, 1462-1468. 83. BOLETTA A, QIAN F, ONUCHIC LF et al. Polycystin-1, the gene product of PKD1, induces resistance to apoptosis and spontaneous tubulogenesis in MDCK cells. Mol Cell, 2000, 6, 1267-1273. 84. BHUNIA AK, PIONTEK K, BOLETTA A et al. PKD1 induces p21 (waf1) and regulation of the cell cycle via direct activation of the JAK-STAT signaling pathway in a process requiring PKD2. Cell, 2002, 109, 157-168. 85. HUMMEL A, DARWISH H, JOLY D et al. Prolifération cellulaire dans la PKRAD : dégradation accrue de la P21 par le protéasome. Société Française de Néphrologie, Tunis, 2002 (abstract). 86. BUKANOV ON, HUSSON H, DACKOWSKI WR et al. Functional polycystin-1 expression is developmentally regulated during epithelial morphogenesis in vitro : downregulation and loss of membrane localization during cystogenesis. Hum Mol Genet, 2002, 11, 923-936. 87. NICKEL C, BENZING T, SELLIN L et al. The polycystin-1 C-terminal fragment triggers branching morphogenesis and migration of tubular kidney epithelial cells. J Clin Invest, 2002, 109, 481-489. 88. CHAUVET V, QIAN F, BOUTE N et al. Expression of PKD1 and PKD2 transcripts and proteins in human embryo and during normal kidney development. Am J Pathol, 2002, 160, 973-983. 89. ONG AC, WARD CJ, BUTLER RJ et al. Coordinate expression of the autosomal dominant polycystic kidney disease proteins, polycystin-2 and polycystin-1, in normal and cystic tissue. Am J Pathol, 1999, 154, 1721-1729. 90. WARD CJ, TURLEY H, ONG AC et al. Polycystin, the polycystic kidney disease 1 protein, is expressed by epithelial cells in fetal, adult, and polycystic kidney. Proc Natl Acad Sci USA, 1996, 93, 1524-1528. 91. NAUTA J, GOEDBLOED MA, VAN DEN OUWELAND AM et al. Immunological detection of polycystin-1 in human kidney. Histochem Cell Biol, 2000, 113, 303-311. 92. GRIFFIN MD, TORRES VE, GRANDE JP et al. Immunolocalization of polycystin in human tissues and cultured cells. Proc Assoc Am Physicians, 1996, 108, 185-197. 93. MARKOWITZ GS, CAI Y, LI L et al. Polycystin-2 expression is developmentally regulated. Am J Physiol 1999, 277, F17-F25. 94. PALSSON R, SHARMA CP, KIM K et al. Characterization and cell distribution of polycystin, the product of autosomal dominant polycystic kidney disease gene 1. Mol Med, 1996, 2, 702-711. 95. GENG L, SEGAL Y, PAVLOVA A et al. Distribution and developmentally regulated expression of murine polycystin. Am J Physiol, 1997, 272, F451-F459. 96. ZHAO Y, HAYLOR JL, ONG AC. Polycystin-2 expression is increased following experimental ischaemic renal injury. Nephrol Dial Transplant, 2002, 17, 2138-2144. 46 D. JOLY ET COLL. 97. OBERMULLER N, CAI Y, KRANZLIN B et al. Altered expression pattern of polycystin-2 in acute and chronic renal tubular diseases. J Am Soc Nephrol, 2002, 13, 1855-1864. 98. BAERT L. Hereditary polycystic kidney disease (adult form) : a microdissection study of two cases at an early stage of the disease. Kidney Int, 1978, 13, 519-525. 99. QIAN F, WATNICK TJ, ONUCHIC LF et al. The molecular basis of focal cyst formation in human autosomal dominant polycystic kidney disease type I. Cell, 1996, 87, 979-987. 100. BRASIER JL, HENSKE EP. Loss of the polycystic kidney disease (PKD1) region of chromosome 16p13 in renal cyst cells supports a loss-of-function model for cyst pathogenesis. J Clin Invest, 1997, 99, 194-199. 101. KOPTIDES M, CONSTANTINIDES R, KYRIAKIDES G et al. Loss of heterozygosity in polycystic kidney disease with a missense mutation in the repeated region of PKD1. Hum Genet, 1998, 103, 709717. 102. WATNICK TJ, TORRES VE, GANDOLPH MA et al. Somatic mutation in individual liver cysts supports a two-hit model of cystogenesis in autosomal dominant polycystic kidney disease. Mol Cell, 1998, 2, 247-251. 103. PEI Y, WATNICK T, HE N et al. Somatic PKD2 mutations in individual kidney and liver cysts support a « two-hit » model of cystogenesis in type 2 autosomal dominant polycystic kidney disease. J Am Soc Nephrol, 1999, 10, 1524-1529. 104. COLGIN LM, HACKMANN AF, EMOND MJ et al. The unexpected landscape of in vivo somatic mutation in a human epithelial cell lineage. Proc Natl Acad Sci USA, 2002, 99, 1437-1442. 105. LU W, FAN X, BASORA N et al. Late onset of renal and hepatic cysts in Pkd1-targeted heterozygotes. Nat Genet, 1999, 21, 160-161. 106. LU W, PEISSEL B, BABAKHANLOU H et al. Perinatal lethality with kidney and pancreas defects in mice with a targetted Pkd1 mutation. Nat Genet, 1997, 17, 179-181. 107. WU G, MARKOWITZ GS, LI L et al. Cardiac defects and renal failure in mice with targeted mutations in Pkd2. Nat Genet, 2000, 24, 75-78. 108. KOPTIDES M, MEAN R, DEMETRIOU K et al. Genetic evidence for a trans-heterozygous model for cystogenesis in autosomal dominant polycystic kidney disease. Hum Mol Genet, 2000, 9, 447452. 109. WATNICK T, HE N, WANG K et al. Mutations of PKD1 in ADPKD2 cysts suggest a pathogenic effect of trans-heterozygous mutations [In Process Citation]. Nat Genet, 2000, 25, 143-144. 110. WU G, TIAN X, NISHIMURA S et al. Trans-heterozygous Pkd1 and Pkd2 mutations modify expression of polycystic kidney disease. Hum Mol Genet, 2002, 11, 1845-1854. 111. WOO DD, MIAO SY, PELAYO JC et al. Taxol inhibits progression of congenital polycystic kidney disease. Nature, 1994, 368, 750-753.