1S Réactions d`oxydoréduction DM : Oxydoréduction
Transcription
1S Réactions d`oxydoréduction DM : Oxydoréduction
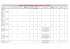
Chimie I : 1S Réactions d’oxydoréduction DM : Oxydoréduction CORRECTION Dans cet exercice nous allons voir qu’il ne faut jamais utiliser l’eau de Javel avec des détartrants contenant des espèces chimiques acides, comme le vinaigre ou l’acide chlorhydrique. L’eau de javel est une solution aqueuse d’hypochlorite de sodium de formule (Na+(aq) + ClO-(aq)). 1. Rappeler la formule chimique d’une solution aqueuse d’acide chlorhydrique. La solution d’acide chlorhydrique est une solution ionique constituée par des anions chlorure Cl- et des cations hydrogène H+. Sa formule chimique chimique est : (H+(aq) + Cl-(aq)) 2. Ecrire les demi-équations électroniques des deux couples suivants : ClO-/Cl2 et Cl2/ClCouple ClO-/Cl2 : 2 ClO- + 4 H+ + 2 e- = Cl2 + 2 H2O Couple Cl2/Cl- : Cl2 + 2 e- = 2 Cl- 3. Ecrire l’équation de la réaction entre les ions chlorure et hypochlorite. Pour écrire l’équation d’une réaction d’oxydoréduction, il suffit d’additionner les deux demi-équations électroniques, mais disposées de façon à ce que les deux réactifs soient placés à gauche du signe égal et en veillant à ce que le nombre d’électrons cédés par le réducteur soit égal au nombre d’électrons captés par l’oxydant. 2 ClO- + 4 H+ + 2 e- = Cl2 + 2 H2O 2 Cl- = Cl2 + 2 e2 ClO- + 4 H+ + 2 ClSoit après simplification : 2 ClO-(aq) + 4 H+(aq) + 2 Cl-(aq) Cl2 + 2 H2O + Cl2 2 Cl2(g) + 2 H2O 4. Préciser le nom et la formule du gaz toxique qui se dégage. Cette transformation chimique produit un gaz toxique : le dichlore de formule Cl2 5. En déduire pourquoi il ne faut jamais utiliser d’eau de Javel avec une solution d’acide chlorhydrique. D’après ce qui précède, on voit que les ions hypochlorites ClO- contenus dans l‘eau de Javel réagissent avec les ions chlorures Cl- de la solution d’acide chlorhydrique, en produisant un dégagement gazeux toxique de dichlore Cl2. Par inadvertance, la totalité d’un berlingot de 250 mL d’eau de Javel contenant une quantité de matière d’ions hypochlorite nClO- = 0,41 mol a été mélangée avec un détartrant à base d’acide chlorhydrique dans une pièce de volume V = 3,5 m3. 6. Etablir le tableau d’avancement relatif à la transformation chimique précédente. On considèrera que les ions H+(aq) et Cl-(aq) ont été introduits en excès. Tableau d’avancement de la transformation chimique : Equation : Etat initial (mol) Au cours de la transformation (mol) Etat final (mol) 2 ClO-(aq) + 4 H+(aq) + 2 Cl-(aq) nClO- Excès Excès 2 Cl2(g) + 2 H2O 0 Excès nClO-- 2x Excès Excès 2x Excès nClO-- 2xm Excès Excès 2xm Excès 7. Calculer la quantité de matière n du gaz toxique produite. D’après le tableau d’avancement la quantité de matière n de dichlore produite est : n = 2xm D’après l’énoncé les ions chlorures Cl- ont été introduits en excès, l’ion hypochlorite ClO- est alors le réactif limitant, sa quantité de matière dans l’état final est nulle, d’où : nClO- - 2xm = 0 2xm = nClOApplication numérique : n = 2xm = 0,41 mol 8. En déduire le volume V de gaz toxique dégagé à 20°C et à pression atmosphérique normale. On sait que : V n = V = n x Vm Vm Application numérique : V = 0,41 x 24,0 = 9,8 L 9. Quelle est alors la concentration C exprimée en ppm en gaz toxique dans la pièce ? Conclure. D’après l’énoncé la concentration en ppm est le nombre de mL de dichlore par m3 d’air. Le volume de dichlore dans la pièce est : V = 9,2 L = 9,2.103 mL Le volume de la pièce est : Vpièce = 3,5 m3 La concentration en ppm de dichlore dans la pièce est : C = Application numérique : C = 9,8.103 = 2,6.103 ppm 3,5 V Vpièce Conclusion : Cette concentration est supérieure à 1000 ppm. Il y a risque de mort par suffocation en peu de temps. Données : Volume molaire à 20°C et à pression atmosphérique normale : Vm = 24,0 L.mol-1 ppm (parties par million) : nombre de mL d’une espèce chimique dans un volume de 1 m3 Effet du gaz toxique en fonction de la concentration exprimée en ppm Concentration du gaz en ppm 0,08 1à3 5 à 15 10 30 40 à 60 › 1000 Effets Limite de détection olfactive. Irritation des membranes muqueuses après une heure d’exposition. Irritation modérée des voies respiratoires supérieures. Danger immédiat pour la vie et la santé après 10 minutes d’exposition. Douleurs immédiates à la poitrine, vomissements et toux. Œdème pulmonaire et mort possible. Mort par suffocation en quelques minutes.