corrigé exam 2007-2008
Transcription
corrigé exam 2007-2008
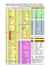
M1 BE, BV, BBSG 17 Décembre 2007 BIOLOGIE MOLECULAIRE EUCARYOTE (Sans document ni calculette ; durée 2h) Librement inspiré de Wang et al. CELL, 105, 851–862, 2001 et Cao et al. MOL CEL BIOL, 25, 364–376, 2005. Le but du travail présenté est de comprendre le réseau de régulation qui contrôle l’expression des gènes spécifiques des cellules des muscles lisses (Smooth Muscle Cells) qui constituent les vaisseaux sanguins, pendant le développement cardiovasculaire et dans les pathologies associées (comme par ex. l’artériosclérose). Le gène SM22α est utilisé comme modèle pour caractériser les interactions entre les séquences cis- régulatrices et les facteurs de transcription responsables de l’expression spécifique des gènes au cours de la différenciation des muscles lisses. La fonction précise de la protéine SM22 (22kDa) est mal connue, elle semble jouer un rôle dans l’organisation du cytosqelette et contribuer à la morphologie des muscles lisses. L’activité du promoteur de SM22α, aussi bien chez la souris que chez l’homme, dépend de 2 éléments cis régulateurs contenant des motifs appelés boites CArG [CC (A/T)6 GG, near and far], également présentes dans le promoteur du gène c-fos . Sequences of the CArG boxes and flanking regions of the SM22 CArG and c-fos CArG Each CArG element contains the 10-nucleotides CArG box and 15 nucleotides of flanking sequence; SRF (Serum Response Factor) est un facteur transcriptionnel ubiquitaire capable d’activer de nombreux gènes impliqués dans la réponse aux facteurs de croissance et la prolifération cellulaire, mais également dans la différenciation musculaire. Functional domains of SRF MADS is the homodimerization and DNA binding domain Par ailleurs, la Myocardine est un facteur de transcription exprimé dans les muscles lisses et cardiaques qui a été impliqué dans la dynamique de la chromatine. Functional domains of myocardin NTD/RPEL domain has been shown to regulate nuclear import. The SAP domain is required for activation of a subset of SRF target genes. ++, basic region; Q, glutamine-rich region; LZ, leucine zipper. 1 Afin de déterminer le rôle de la myocardine et son mode d’action dans l’expression spécifique des gènes des SMC, on réalise les expériences décrites sur ce document. Lisez le sujet jusqu’au bout et répondez aux questions de façon brève, précise et synthétique I (noté/10) 1°) A (A) Gel mobility shift assays of SRF binding to different CArG boxes 32 P-labeled oligonucleotide probes corresponding to the indicated CArG elements were used as probes in gel mobility shift assays with in vitro translated SRF. (B) Gel mobility shift assays were performed with a 32P-labeled oligonucleotide probe for SM22 CArGnear and in vitro translation products of FLAG-tagged myocardin in the presence and absence of SRF. Antibodies against SRF and the FLAG-epitope were included, as indicated. B 2 D C E (C) Gel mobility shift assays were performed as in (B) with an SRF deletion mutant (SRF 100–300) lacking the amino and carboxyl termini. (D) Gel mobility shift assays were performed as in (B) with wild-type and indicated mutant forms of FLAG-tagged myocardin in the presence and absence of SRF. (E) Schematic diagrams of myocardin mutants and results of gel mobility shift assays 3 Quelles sont les 4 conclusions que vous pouvez déduire de ces premières expériences ? /4 1) SRF se lie plus fortement à l’élément CArG du promoteur du gène c-fos qu’à celui de SM22 2) La myocardine seule ne se lie pas à l’élément CArG de SM22 mais peut se lier en présence de SRF (formation d’un complexe ternaire CArG ; SRF ; Myoc) 3) Le core domaine MADS de SRF est suffisant pour sa liaison à l’élément CArG et pour la formation du complexe ternaire donc pour recruter Myoc 4) Les domaines ++ et Q de la myocardine sont nécessaires à la formation de ce complexe 2°) Coimmunoprecipitation of myocardin and SRF from transiently transfected COS cells. COS cells were transiently transfected with expression vectors encoding FLAG-tagged myocardin (wt and deletion mutant proteins) and hemagglutinin (HA)tagged SRF (wt and deletion mutant proteins). Immunoprecipitates with anti-HA (SFR) were separated by SDS-PAGE and sequentially immunoblotted with antiFLAG antibody (myocardin) (top panel). The same blot was then reprobed with anti-HA antibody to determine the presence of HA-tagged SRF (bottom panel). One-twentieth of the cell extract was directly immunoblotted with anti-FLAG antibody to detect the presence of FLAG-tagged myocardin (middle panel). Que signifient les résultats de cette expérience ? /2 SRF et myocardine co-immunoprécipitent ; ces deux facteurs forment un complexe in vivo, en absence d’ADN cible; Interaction entre la région N-ter de myocardine et le MADS domaine de SRF, ces deux domaines étant nécessaires et suffisants 4 3°) A (A) Analysis of the effects of CArG box mutations on activation of the SM22 promoter by myocardin and SRF. COS cells were transiently transfected with a luciferase reporter linked to wild type and indicated mutant forms of the SM22 promoter and expression vectors for myocardin and SRF. Values are expressed as luciferase activity of each construct compared to the wild-type construct, which was assigned a value of 100. Value in parentheses indicate the fold-increase in activity in the presence of myocardin expression plasmid compared to the level of activity with reporter alone. SRF is expressed endogenously in COS cells B (B) Activation of SM22 promoter by SRF and Myocardin. COS cells were transiently transfected with the SM22-luciferase reporter and the indicated amounts (in ng) of myocardin and SRF expression plasmids. 5 C (C) Transcriptional Activity of Myocardin. COS cells were transiently transfected with expression vectors encoding the indicated regions of myocardin fused to the DNA binding domain of GAL4 (1–147) and the pL8G5-luciferase reporter, which contains binding sites for the GAL4 DNA binding domain. Luciferase activity is expressed as fold-increase above that with the GAL4 expression plasmid without a cDNA insert. D SM22-luceferase reporter 6 (D) Deletion mapping of the domains of myocardin required for activation of the SM22 promoter. COS cells were transiently transfected with the SM22-luciferase reporter and wild-type or mutant forms of myocardin expression plasmids . The viral co-activator protein VP16 was fused to the carboxy-terminal deletion mutants C∆585 and C∆381. All myocardin deletions contained a FLAG epitope at the amino terminus and their expression was confirmed by Western blot. Quelles sont les caractéristiques fonctionnelles de la myocardine ? /4 Ne pas détailler les résultats des expériences mais argumenter vos réponses. Dans les cellules Cos, la myocardine est un puissant activateur transcriptionnel du promoteur SM22 (plus de 1000 fois, alors que l’activation par SRF n’est que de 10 fois) ; cette activation est dépendante des sites CArG (en particulier CArG near) qui sont les sites de liaison de SRF. La myocardine se lie à la séquence CArG seulement en présence du facteur SRF et les mutants de la myocardine qui ne peuvent pas interagir avec SRF ne peuvent pas activer la transcription . La myocardine active donc la transcription via son association avec SRF ; les domaines ++ et Q sont responsables de la spécificité de la myocardine sur les promoteurs contenant des boites CArG ; le domaine d’activation est la région c-ter (TAD) mais dans la protéine complète, ce domaine est masqué par la région N-ter La quantité relative de myocardine et de SRF (ratio) est critique pour l’activation transcriptionnelle du promoteur SM22 7 II (/10) Remarkably, forced expression of myocardin in fibroblasts is sufficient to activate the smooth muscle differentiation program. The ability of myocardin to activate smooth muscle genes that are otherwise silent in nonmuscle cells suggests that myocardin is able to convert smooth muscle genes from a repressed to a transcriptionally active state. How? Previous studies have suggested the involvement of chromatin acetylation-deacetylation in the control of smooth muscle gene expression. Among the best-characterized histone acetyltransferases (HATs) is p300. The gene-activating function of HATs is antagonized by the activity of histone deacetylases (HDACs) 1°) /3 (A) Fibroblasts cells were transiently transfected with a FLAG-tagged myocardin expression vector (+) or a control vector (-), and ChIP assays were performed with primers for sequences associated with the genes for SM α-actin, SM22, and GAPDH (control). The amount of DNA in each sample (input) is shown at the left. Immunoprecipitations were performed without primary antibody (no Ab) as a control and with anti-FLAG antibody and anti-acetyl histone H3 antibody, as indicated. (B) Fibroblasts cells were transiently transfected with expression vectors encoding myocardin (0.1 µg), p300 (0.5 and 1µg), or HDAC5 (0.2 and 0.5 µg), as indicated, and SM22 protein expression was detected by immunostaining. Values are expressed as the relative number of positive cells compared to the number in cultures transfected with myocardin alone, which was assigned a value of 100. Quel est le but de l’expérience A ? /1.5 Déterminer si la myocardine a un effet sur l’état d’acétylation de l’ histone H3 associée à la chromatine présente au niveau du promoteur des gènes des muscles lisses SM α-actin et SM22. 8 Donnez la conclusion de ces deux expériences /1.5 L’activation par la myocardine de l’expression des gènes endogènes spécifiquement exprimés dans les muscles lisses (activité myogénique) passe par une acétylation des histones sur les promoteurs correspondant. Cette activité est augmentée par p300 alors que p300 seul n’a pas d’effet donc la myocardine doit recruter le coactivateur p300. 2°) A B (A) COS cells were transiently transfected with expression vectors encoding myocardin (0.1 µg) and p300 (0.5 and 1 µg) and the SM22- luciferase reporter. (B) COS cells were transiently transfected with expression vectors encoding myocardin and HDAC5 or HDAC1 (0.1, 0.2, and 0.5µg) and the SM22- luciferase reporter. 3°) A 9 (A) COS cells were transiently transfected with expression vectors encoding SRF, hemagglutinin (HA)-tagged p300, FLAG-tagged myocardin, and Myc-tagged HDAC5. FLAG-tagged myocardin was immunoprecipitated (IP) from cell lysates with a monoclonal anti-FLAG antibody, and coimmunoprecipitating p300 was detected by immunoblotting (IB) with an anti-HA antibody (top part). The membrane was then stripped and reprobed with anti-Myc antibody (second part from the top). Cell extracts were probed with antibodies against HA, FLAG, and Myc to detect p300, myocardin, and HDAC5, respectively (bottom three parts). B (B) COS cells were transiently transfected with expression vectors encoding FLAG-tagged myocardin deletion mutant proteins and hemagglutinin (HA)-tagged p300. Myocardin proteins were immunoprecipitated from cell lysates with a monoclonal anti-FLAG antibody, and coimmunoprecipitating HA-tagged p300 was detected by immunoblotting (IB) with a polyclonal antiHA antibody. C (C) COS cells were transiently transfected with expression vectors encoding FLAG-tagged myocardin deletion mutants and Myc-tagged HDAC5. Myc-tagged proteins were immunoprecipitated 10 from cell lysates with a polyclonal anti-Myc antibody, and coimmunoprecipitating myocardin was detected by immunoblotting (IB) with a monoclonal anti-FLAG antibody . Quelles sont les conclusions que vous pouvez déduire des expériences montrées au 2°) et 3°) ? /4 Dans les cellules Cos, la myocardine et p300 agissent en synergie et de manière dosedépendante pour activer la luciférase liée au promoteur SM22 alors que HDAC5 supprime cette l’activation et de manière spécifique puisque HDAC1 n’a pas d’effet. p300 et HDAC5 coimmunoprécipitent tous les 2 avec la myocardine Le domaine TAD de myocardine est nécessaire et suffisant pour recruter p300 alors que le recrutement de HDAC5 se fait par le domaine N-ter de myocardine (aa 1-348) 4°) B A C UAS- Luciferase D 11 (A-C) COS cells were transiently transfected with expression vectors encoding GAL4 DNA binding domain -myocardin fusion protein, a UAS-luciferase reporter and 1µg of p300 (A) or 0.1 and 0.5 µg of HDAC5 (B), or treated with 0.1 µM TSA after transfection and harvested 48 h later for determination of luciferase activity. (D) COS cells were transiently transfected with expression vectors encoding myocardin, p300, and the SM22-luciferase reporter. Cells were treated with 0.1 µM TSA after transfection and harvested 48 h later for determination of luciferase activity. TSA is an HDAC inhibitor. Que signifient ces résultats ? TSA augmente l’activité transcriptionnelle de myocardine fusionnée au domaine de liaison à l’ADN de Gal4 sur le raporteur UAS- luciférase, ainsi que l’expression du promoteur SM22 en présence de myocardine, à un taux équivalent à celui de myocardine+p300 ; la présence de TSA n’augmente pas l’activité myocardine+p300 Ces résultats suggèrent que la fonction primaire de p300 sur la myocardine est de supprimer l’effet répressif de HDAC5 A partir de l’ensemble des résultats, discutez en quelques phrases ce que vous avez compris du mode d’action de la myocardine. /3 La myocardine est recruté sur les séquences CArG des promoteurs des gènes SMCs via SRF . Elle active la transcription de ces gènes par son domaine TAD, au niveau duquel est recruté l’HAT p300. Le domaine TAD fusionné au GAL4 DNA-binding domain, est 50 fois plus actif que la protéine entière suggèrant la présence d’un facteur inhibiteur associé à la partie Nter, qui doit être HDAC5 . L’activité transcriptionnelle de myocardine doit dépendre d’un équilibre entre l’effet stimulateur de p300 (dans les SMCs) et l’effet répressif de HDAC5. L’activation médiée par p300 doit être utilisée seulement quand les gènes cibles doivent être activés et ceci se produit par suppression de HDAC5. 12