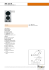Formule de Chimie
Transcription
Formule de Chimie
Formule de Chimie Nom Formule Remarque Thermodynamique Entropie de position S= R.n.ln(V2/V1) énergie et entropie ∆E= 0= Q+W Q= R.T.ln(V2/V1) S= Q/T 3ième principe S= Cp/T ∆T S= ∫ Cp/T dT + ∆Htrans/Ttrans Energie Libre ∆G= ∆H-T∆S ∆G°= ∑n∆G f produit - ∑n∆Gf réactif= ∆H°-T∆S° ∆G= 0 => ∆H=T∆S ∆G>O pas de réaction Loi de Tronton ∆S°vap = ∆H°vap/Tvap≈ 87J/mol K Pour quasi tous les composés Etat Standart ∆G= ∆G°+ R.T.ln(Q) ∆G°=-R.T.ln K éq Si Q= Kéq => ∆G=0 ∆G<0 réaction spontanée ∆G=0 équilibre Equilibre Chimique Equilibre Kc= [C]^c,[D]^d / [A]^a [B]^b Kp= PC^c,PD^d/PA^a,PB^b= Kc/RT Kéq= exp ∆S°/R exp -∆H°/RT= exp ∆G°/RT aA + bB → cC + dD Si K<1 => ∆G>0 réaction vers la gauche Si K>1 => ∆G<0 réaction vers la droite Equilibre et thermo Clausius K= exp ∆S/RT exp -∆H/RT K1 K2= K3 ln (K1/K2)= -∆H/R (1/T1-1/T2) Si T≠ 298,15 K Si on additionne les réactions donnant K1 et K2 Cinétique Vitesse ∆[A]/ ∆T La vitesse des réactifs diminue avec le temps La vitesse des produits augmente avec le temps Vitesse différentielle v= k [A]^m [B]^n avec k dépend de la réaction considérée, de la t°, présence d'un catalyseur. m et n sont des entiers positifs le plus souvent. Suivant l'ordre global: m + n , les unités de k changent Vitesse intégration ordre 0 ordre 1 ordre 2 Equation d'Arrhenius [A]= [A 0] - akT ln [A]= ln [A0] - akT 1/[A]= 1/[A 0] + akt a= coef stoechiométrique, k= cf plus haut, T= la t° en K K= A exp -Ea/RT ln K= ln A - Ea/RT ln K1/K2= -Ea/R (1/T1-1/T2) Réaction Chimique Solubilité Ks= [C]^c [D]^d ions complexes K= Kf , Ks Influence du pH K= Ks/Ka Réaction Acido Basique Ka= [A-][H+]/[HA] Kb= [BH][OH-]/[B-] aA + bB → cC + dD Toujours chercher les concentrations finales Les constantes sont disponibles dans les tables Si Ka>1, acide fort et si Ka<1, acide faible Si Kb>1, base forte et si Kb<1, base faible Kω pH pOH Kω= 10^-14= Ka Kb pH= -Log[H3O+] pOH= -Log[OH-] Acide ou base forte [H3O+]= ( Ca + √(Ca²+4.10^-14) )/2 [OH-]= ( Cb + √(Cb²+4,10^-14) )/2 Si pH>7, solution basique et si pH<7, solution acide Acide ou base faible Ka= [A-][H3O+]/[AHO 3] => [H 3O+]= √(Ka Ca) Acide et base faible [H3O+]=Ka Ca/Cb ou [OH-]= Kb Cb/Ca C'est une solution tampon Tampon Ka= [H3O+] Cb/Ca ou Kb= [OH-] Ca/Cb Ka et Kb <10^-3 Si on considère l'eau [H3O+]= Ka ( (Ca - [H 3O+] + [OH-])/(Cb + [H 3O+]-[OH-])) Ca et Cb >> Ka et Kb Electro Chimie Oxydant = preneur d'e- baisse de l'étage d'oxydation => il se réduit (réduction) ( cathode placé à droite) Réducteur = donneur d'e- augmentation de l'étage d'oxydation => il s'oxyde (oxydation) (anode placé à gauche) Equation de base E°= E cathode - E anode ∆V= Travail/Charge = Electron/Coulomb W élec= n F ∆E n= nombres de moles F= constante de Faraday (96485 C) ∆E= différence de potentiel Energie maximum possible ∆G°= -nF∆E Si ∆E<0 réaction non spontanée Si ∆E>0 réaction spontanée Si ∆E=0 réaction à l'équilibre (la pile est plate) G= -RT ln(Keq)= -nFE E= RT ln(Keq) / nF K= exp nFE/RT E= E° - RT/nF ln(Q) Pile de concentration ∆E= Ed - Eg = 0 - RT/nF ln( [ ] g/[ ] d) pH= E°/0,0592 Electrolyse Q= I t Q= nF I= Q/t Si E°= RT/nF ln(Q), la pile est déchargée. I= intensité Q= charge t= temps