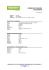Sels ioniques à anions alcalins, à anion e
Transcription
Sels ioniques à anions alcalins, à anion e
BULLETIN DE L’UNION DES PHYSICIENS 1381 Sels ioniques à anions alcalins, à anion e - : Mauvaises copies d’élèves ? sans aucun doute… réalités chimiques pourtant !! par Jean SALA PALA Université de Bretagne Occidentale - 29285 Brest Cedex [email protected] RÉSUMÉ Le degré d’oxydation + 1 qu’adoptent les alcalins dans leurs dérivés est un fait tellement habituel, et tellement facile à justifier sur la base de la configuration électronique, que l’existence d’anions alcalins peut paraître, a priori, totalement exclue. Il n’en est rien et s’il est clair que les anions monoatomiques proviennent, pour leur énorme majorité, des non-métaux, plusieurs métaux, les alcalins y compris, peuvent également donner des anions monoatomiques. Les dérivés qui les contiennent sont, comme tous les sels ioniques, caractérisés par un empilement plus ou moins compact d’espèces chargées bien définies. Cet article explicite l’histoire de ces dérivés et résume leurs principales propriétés. Il aborde un domaine connexe, plus surprenant encore, celui des électrures, c’est-à-dire des solides où tous les anions sont des électrons. 1. LES PRINCIPES DE SYNTHÈSE Si la stabilité des anions alcalins en phase gazeuse est connue depuis longtemps, cette propriété n’est cependant pas à la base de la synthèse des dérivés dont il est question ici. La préparation de ces dérivés s’effectue en solution et illustre de manière remarquable l’importance considérable que peuvent avoir les phénomènes de complexation [1]. La stratégie consiste en effet à mettre en présence, dans un solvant approprié, le métal alcalin M et une entité organique C choisie pour son fort pouvoir complexant vis-à-vis du cation alcalin M +. Celui-ci est complexé selon l’équation-bilan : M + + C + MC+ (1) Ce cation alcalin est généré dans le solvant selon l’équilibre : M (s) + M + + e(2) Il est clair que, toutes choses égales par ailleurs, plus C présente un pouvoir complexant élevé pour le cation M +, plus l’équilibre (1) est déplacé vers la droite... et plus l’équilibre (2) se déplace également vers la droite pour essayer de s’opposer à la diminution de la concentration des ions M +. Enfin, un autre équilibre, (3), faisant intervenir Vol. 95 - Octobre 2001 Jean SALA PALA 1382 BULLETIN DE L’UNION l’électron formé par (2), existe aussi dans la solution : M (s) + e- + M - DES PHYSICIENS (3) La coexistence de ces trois équilibres permet, selon les valeurs numériques respectives de leurs constantes, de préparer des solutions contenant à la fois le cation complexé MC+ et, soit l’anion M -, soit l’anion e-, soit un mélange des deux. Plusieurs conditions sont bien évidemment nécessaires pour que le processus soit réellement opérationnel. En particulier : – il faut que le solvant utilisé et aussi l’entité complexante C soient stables vis-à-vis de la réduction pour ne pas réagir eux-mêmes avec le métal M très réducteur ; – d’une manière plus générale, il faut que soit exclue du milieu réactionnel, tout au long du processus, toute substance susceptible d’être réduite, et notamment bien entendu le dioxygène et l’eau ; – il est indispensable que le cation M + soit fortement piégé par le système pour empêcher, autant que faire se peut, la décomplexation sur le plan cinétique puisque cette dernière reconduirait à la formation du métal alcalin par réaction de rétrodismutation avec l’anion alcalin. Il faut donc, pour parvenir à de telles synthèses, qu’à des choix judicieux de réactifs et de solvant viennent s’ajouter du matériel de synthèse approprié et une habileté certaine du manipulateur. Ceci est d’autant plus vrai que, dans certains cas, en particulier ceux des électrures, s’ajoute la contrainte supplémentaire de devoir travailler à basse température (de l’ordre de – 40 °C) non seulement durant la synthèse, mais aussi durant le stockage et la réalisation des mesures physiques, compte tenu d’une instabilité thermique évidente du produit. 2. LE CHOIX DES ENTITÉS COMPLEXANTES Deux familles ont particulièrement retenu l’attention des chercheurs : les éthers-couronnes (cf. figure 1) et les cryptands (cf. figure 2), essentiellement construits, les uns et les autres, par assemblage d’entités OCH2CH2O. Ces ligands et leurs complexes ont été très étudiés depuis la fin des années 60 par diverses équipes et notamment celles de J.-M. LEHN et d’un des deux autres lauréats qui ont partagé avec lui le prix Nobel de chimie en 1987, C. J. PEDERSEN [2-4]. Dans un excellent article publié dans ce bulletin, A. GORGUES [5] en avait réalisé en 1977 une rapide présentation et mis en évidence diverses applications en chimie organique ; celles mentionnées ici relèvent de la chimie inorganique mais dans les deux cas le principe est le même, l’existence de l’anion est favorisée par la complexation du cation qui lui est associé. 2.1. Les éthers-couronnes [3, 4] Ce sont des polyéthers de type macrocyclique où les atomes d’oxygène sont séparés les uns des autres par des groupes CH2CH2 (cf. figure 1). Lorsqu’on leur propose un Titre de l’articleions alcalins, à anion e–... BUP no 837 BULLETIN DE L’UNION DES PHYSICIENS 1383 cation alcalin en les mettant en présence en solution avec un sel de l’alcalin considéré, ces entités ont la propriété de former des complexes stables. Cette propriété, tout à fait inhabituelle pour ce qui concerne les cations alcalins, résulte de la position qu’occupent les atomes d’oxygène, tous « braqués » vers l’intérieur en direction de l’atome métallique, le reste du ligand formant comme une couronne autour du cation... d’où leur nom. Chaque éther-couronne se caractérise par une taille de cœur spécifique de telle sorte que chaque cation alcalin possède, en principe, un éther-couronne sensiblement plus adapté que les autres pour le stabiliser. Si cela se confirme en phase gazeuse, les phénomènes sont cependant plus complexes en solution. Chaque éther-couronne se caractérise par deux nombres, n, celui d’atomes du noyau macrocyclique et m, celui d’atomes d’oxygène du noyau ; il se note de manière abrégée n-couronne-m ou en plus court encore nCm. Celui représenté figure 1 est donc le 18C6. Le 12C4, le 15C5 et le 21C7 sont d’autres éléments de cette classe. a b Figure 1 : Deux exemples d’éther couronne. (a) Le 18C6 (dix-huit atomes dans le noyau macrocyclique dont six d’oxygène). (b) Le dibenzo-18C6. 2.2. Les cryptands [2, 3] Ces entités organiques, comme celle de formule N(CH2CH2OCH2CH2OCH2CH2 )3N, sont en réalité des polyoxadiamines bicycliques (cf. figure 2a page ci-après). Mises en solution en présence d’un sel alcalin approprié, ces entités forment une véritable cage tridimensionnelle autour du cation métallique (cf. figure 2b page ci-après). Chacun de ces ligands présente, notamment vis-à-vis du cation alcalin le plus adapté à sa taille, un pouvoir complexant très fort... qui a valu du reste à cette famille le nom non équivoque de cryptands pour bien indiquer son aptitude à ne pas relâcher facilement l’espèce piégée... comme une crypte conserve les reliques qui y ont été placées. Les dérivés métalliques ainsi obtenus à partir des cryptands, appelés cryptates, sont en réalité des complexes d’inclusion (cf. figure 2b page ci-après). Pour les distinguer des complexes classiques, certains auteurs ont suggéré d’utiliser le symbole mathématique de l’inclusion, 1, d’autres, plus modernes encore, le symbole @. Ainsi, pour indiquer qu’un cation K + est complexé par le cryptand de la figure 2a, on écrirait 7 K + 1 222 A ou 7 K + @ 222 A, mais à notre connaissance aucune de ces écritures, qui aurait le mérite de souligner le caractère spécifique de la complexation, n’a encore été reconnue de manière officielle. Vol. 95 - Octobre 2001 Jean SALA PALA 1384 BULLETIN DE L’UNION DES PHYSICIENS a b Figure 2 : Un exemple de cryptand et de cryptate. (a) Vue schématique d’un [2]cryptand (le 2 précise que l’entité organique comprend deux macrocycles). Pour différencier les éléments de cette famille, on utilise une notation abrégée faisant intervenir trois nombres, chacun d’eux représentant le nombre d’atomes d’oxygène contenu dans chacun des ponts N…N ; celui représenté est donc le C222. Pour dénommer cette famille, certains préfèrent parler de « ligands en ballon de rugby » compte tenu de leur forme générale et de la présence des ponts polyéthers entre les atomes d’azote qui en rappellent les coutures... et même si le texte original les qualifiait de « football ligands » par référence au ballon ovale du football américain !! (b) Vue schématique du cryptate 7 M + C222 A. Il est évident que, dans cette structure [2]cryptand, plus les chaînes carbonées sont longues et plus grande est la taille de cœur. Il y a donc pour chaque cation métallique un cryptand plus adapté que les autres c’est-à-dire donnant un complexe plus stable que les autres. Les mesures de constantes de formation des cryptates (cf. tableau 1) mettent clairement en évidence que les stabilités maximales sont obtenues pour 7 Li+ C211A, 7 Na+ C221A, 7 K + C222 A, 7 Rb+ C222 A et 7 Cs+ C222 A [6]. Ces valeurs de constantes optimales sont de plusieurs ordre de grandeur supérieures à celles correspondant aux autres types de ligands organiques, y compris les ligands naturels ; ainsi, par exemple, 7 K + C222 A est environ 104 fois plus stable que le complexe 7 K + valinomycineA... ce qui est considérable car la valinomicyne est le polypeptide cyclique intervenant dans le transport du potassium dans l’organisme au travers des membranes des cellules !! Cryptant C211 C221 C222 C322 Li+ 7,6 4,2 1,8 < 2,0 Na+ 6,1 8,8 7,2 4,6 K+ 2,3 7,5 9,8 7,0 Rb+ 1,9 5,8 8,4 7,3 Tableau 1 : Constantes de stabilité des cryptates des alcalins (mesures à 25 °C dans des mélanges 95/5 méthanol/eau) [6]. Les valeurs indiquées dans ce tableau correspondent à log K f 1, K f 1 étant la constante de l’équilibre de formation du complexe 1 : 1 : M + + Cnmp + M + Cnmp K f 1 = 7 M + Cnmp A / 7 M + A 7 Cnmp A Pour chaque alcalin, la valeur correspondant au cryptate le plus stable est indiquée en gras. Titre de l’articleions alcalins, à anion e–... BUP no 837 BULLETIN DE L’UNION DES PHYSICIENS 1385 3. LES DÉRIVÉS À ANIONS ALCALINS La première caractérisation à l’état solide et sans aucune équivoque d’un sel contenant l’anion sodium date de 1974 [7]. A l’inverse de ce qui se passe dans l’ammoniac liquide, le sodium est, en absence de tout agent complexant, quasiment insoluble dans un solvant comme l’éthylamine C2H5NH2 (solubilité inférieure à 10- 6 mol.L- 1). Cependant, l’ajout à ce solvant du cryptant C222 conduit, en présence d’un excès de sodium, à des solutions dont la solubilité totale en sodium est aussi élevée que 0, 4 mol.L- 1. Les études ont vite montré que les espèces majoritaires que contenait alors la solution d’éthylamine étaient l’anion Na- et le cation Na+ C222 formé d’un cation sodium piégé à l’intérieur de l’entité organique. Lorsqu’une telle solution est refroidie par de la neige carbonique, un solide cristallin de couleur dorée précipite. Quand on réalise ce refroidissement de manière très progressive, on peut obtenir ce précipité sous forme de monocristaux apparaissant sous forme de plaquettes fines. Ces cristaux sont stables sous vide pendant plusieurs jours à température ambiante [7]. Différentes propriétés chimiques ou physico-chimiques de ces plaquettes correspondent bien à celles attendues pour le dérivé à anion alcalin 7 Na+ C222 A Na- [7] : ♦ Leur analyse élémentaire s’accorde bien avec une composition globale de type Na2 7 C222 A ; ♦ Leur réaction avec l’eau conduit à un dégagement de dihydrogène de 0,95 ± 0,03 mole de gaz par mole de dérivé, valeur en très bon accord avec l’équation-bilan (4). Na- + 2 H2O " Na+ + H2 + 2 OH(4) ♦ Le dosage par une solution de H3O+ d’un échantillon décomposé par l’eau selon (4) nécessite 3,98 ± 0,05 mole d’ions H3O+ par mole de produit, en accord avec une première neutralisation correspondant aux deux fonctions bases fortes suivie d’une double protonation de la molécule organique de l’espèce 7 Na+ C222 A sur les deux atomes d’azote comme déjà observé pour 7 Na+ C222 A Cl -. Mais, comme bien souvent, c’est l’apport de la diffraction des rayons X qui s’est révélé déterminant [8]. ♦ D’une part, cette étude a bien mis en évidence une espèce sodium « cryptée » par la molécule organique. Le sodium, situé à l’intérieur de la cage (cf. figure 3), possède une coordinence huit assurée par les six atomes d’oxygène (Na-O 257 pm) et les deux atomes d’azote (Na-N 272 pm) ; ces longueurs de liaison, très proches de celles trouvées dans le dérivé 7 Na+ C222 A I - (Na-O 258 pm ; Na-N 275 pm) mettent clairement en relief que cette espèce sodium est bien le cation Na+... et indiquent, par extrapolation, que les deux électrons de valence de l’ensemble des deux atomes de sodium de départ sont donc localisés à l’extérieur de 7 Na+ C222 A. ♦ D’autre part, pour l’autre espèce sodium, celle située à l’extérieur de la cage, l’étude Vol. 95 - Octobre 2001 Jean SALA PALA 1386 BULLETIN DE L’UNION DES PHYSICIENS structurale a fait apparaître qu’elle se trouvait à des distances relativement longues des atomes de la cage (Na…N 554 pm ; Na…O 572 pm). Un examen attentif a permis de constater que ces distances interatomiques étaient de même ordre de grandeur que celles faisant intervenir l’anion I - dans le dérivé 7 Na+ C222 A I - (I…N 539 pm ; I…O 522 pm). Ainsi, l’espèce sodium située hors de la cage possède un comportement relativement proche de celui de l’anion I - dans son placement par rapport aux autres atomes. Ce comportement indique bien la présence de sodium à l’état d’anion Na -. En définitive, la structure, qui s’appuie sur une maille hexagonale, est une structure ionique clairement constituée de cations sodium complexés 7 Na+ C222 A et d’anions Na-, la plus courte distance Na+ Na - étant de 706 pm (cf. figure 4). Il est très important de noter aussi que l’étude attentive des positions anioniques conduit à attribuer à l’anion sodium un rayon ionique élevé... légèrement plus élevé même que celui de l’ion iodure. Cette idée, difficile à admettre pour qui est familiarisé au cation sodium et à son faible rayon ionique de l’ordre de 100 pm, a été rapidement confirmée par diverses estimations théoriques des rayons ioniques des espèces Na - et I - ; si des petits écarts existent selon l’approche réalisée (de 220 à 230 pm pour Na -, de 210 à 220 pm pour I -), chacune d’elles conduit à une valeur légèrement plus élevée pour le premier que pour le second. Figure 3 : Le natrure 7 Na+ C222 A Na -. Représentation schématique de la coordinence 8 du cation sodium dans le cryptate, coordinence clairement caractérisée par une étude par diffraction des rayons X [8]. Figure 4 : Le natrure 7 Na+ C222 A Na -. Représentation schématique de la structure cristalline (maille hexagonale telle que a = b = 883 pm et c = 2926 pm ; groupe d’espace R32). Les cations 7 Na+ C222 A, symbolisés par les grosses sphères blanches, occupent les sommets et les positions 1/3, 2/3, 1/3 et 2/3, 1/3, 2/3. Les anions Na -, symbolisés par les petites sphères noires, occupent les milieux des quatre arêtes verticales (z = 1/2) et les positions 2/3, 1/3, 1/6 et 1/3, 2/3, 5/6. Chaque maille contient trois cations et trois anions. Chaque ion possède six ions voisins de charge opposée. Titre de l’articleions alcalins, à anion e–... BUP no 837 BULLETIN DE L’UNION DES PHYSICIENS 1387 Les mesures physiques réalisées sur ce dérivé n’ont pas révélé un comportement exceptionnel. Le dérivé est diamagnétique, en plein accord avec les configurations électroniques externes 3s2 de l’anion et 2s2 2p6 du cation. Pour ce qui est de sa conductibilité électrique, et bien que l’éclat quasi-métallique de 7 Na+ C222 A Na - suggérait qu’il puisse être conducteur, les mesures de conductivité électrique réalisées sur des poudres compactées ont rapidement mis en évidence qu’il n’en était rien. La variation de la résistance en fonction de la température traduit un comportement de semi-conducteur intrinsèque avec un écart de l’ordre de 2,4-2,5 eV entre la bande de valence issue des deux électrons 3s des anions sodium et la bande de conduction. Pour ce qui est de la nomenclature, de tels composés à anions alcalins se caractérisent bien évidemment par la terminaison ure, spécifique des anions monoatomiques. Pour ceux dérivés du sodium, a été retenu le nom de natrures, dérivé de la racine « natrium ». Pour les autres alcalins, on parlera de lithures, potassures, rubidures, césures et françures. Enfin, on notera avec intérêt qu’il n’a pas été officiellement attribué à cette famille de dérivés un terme générique, du type alcalure ou alcure, en dépit de ce qui peut être lu dans certains articles. Depuis ces tous premiers travaux sur les dérivés à anions sodium, différents composés de ce type ont été synthétisés et plusieurs d’entre eux également caractérisés par diffraction de rayons X. Le comportement des autres alcalins s’est révélé malgré tout plus délicat que celui du sodium en ce sens qu’ils donnent des dérivés moins stables et que les synthèses sont rendues plus difficiles encore par la tendance à former des électrures (cf. ci-dessous). Des résultats intéressants ont malgré tout pu être obtenus. On citera en particulier : ♦ La préparation et la caractérisation de dérivés faisant intervenir deux alcalins différents, comme ceux de stœchiométrie NaM (15C5)2 et NaM (18C6) avec M = K ou Rb. Des études très spécifiques (RMN 23Na à l’angle magique pour la première famille, RPE pour la seconde) ont clairement mis en évidence que tous ces dérivés étaient des natrures, c’est-à-dire des dérivés de formule 8 M + (nCm)2 B Na -, et non des potassures ou des rubidures. ♦ La préparation et l’étude structurale de césures comme 7 Cs+ C222 A Cs - et 8 Cs+ (18C6)2 B Cs [9]. Dans le second, le cation Cs+ est coordonné aux douze atomes d’oxygène de l’ensemble des deux éthers couronnes (Cs-O de 311 à 352 pm). On retiendra aussi de ces déterminations structurales que la position de l’anion et ses distances interatomiques avec les autres atomes ont conduit à attribuer à l’anion Cs - un rayon ionique de l’ordre de 350 pm. De toute évidence, Cs - est l’ion monoatomique le plus volumineux, occupant un volume environ quatre fois plus élevé que l’anion iodure I -. 4. LES ELECTRURES [10] Le dernier dérivé présenté ci-dessus, 8 Cs+ (18C6)2 B Cs -, correspond bien évidemment à Vol. 95 - Octobre 2001 Jean SALA PALA 1388 BULLETIN DE L’UNION DES PHYSICIENS une stœchiométrie de type Cs (18C6). Par un processus expérimental différent, a été obtenue en 1983 une autre phase cristalline présentant la même stœchiométrie mais des propriétés se différenciant très sensiblement de celles de la première [11]. En particulier, le signal observé en RMN 13C pour les atomes de carbone de la cage organique se trouve déplacé d’une grandeur anormalement élevée qui traduit la présence dans le solide d’une espèce paramagnétique. D’autres mesures, en particulier celles de susceptibilité magnétique, sont en accord avec la présence dans le solide d’électrons localement piégés et non appariés, c’est-à-dire avec une formule de type 7 Cs+ (18C6) A e correspondant à un électrure, ou encore un sel où tous les anions sont des électrons. La première caractérisation structurale d’un électrure par diffraction des rayons X date de 1986 [12a]. Ce dérivé, de formule 8 Cs+ (18C6)2 B e -, est isostructural au natrure 8 Cs+ (18C6)2 B Na - [12b] (cf. figure 5). Dans les deux cas, le cation Cs+ se trouve pris en sandwich entre deux entités organiques 18C6, c’est-à-dire possède une coordinence 12 assurée par douze atomes d’oxygène. Cette isostructuralité entre les deux dérivés est réellement très surprenante en ce sens qu’elle concerne deux dérivés dont l’un, le natrure, présente des anions volumineux, ce qui est très loin d’être le cas de l’autre, l’électrure, puisque la taille de l’électron est de plusieurs ordres de grandeur inférieure à celle du plus petit des anions classiques ! Pour être complet, il faut indiquer que la résolution de la structure cristalline de l’électrure ne permet pas de détecter avec certitude la présence de l’électron sur le site anionique, même si celle-ci ne fait guère de doute. Ceci est imputable à la technique elle-même. En effet, la diffraction des rayons X est bien plus adaptée à la localisation d’atomes comportant un nombre élevé d’électrons (atomes dits « lourds ») qu’à celle des espèces en ayant peu puisque, toutes choses égales par ailleurs, la contribution de chaque atome à l’intensité diffractée est proportionnelle au carré Z 2 de son numéro atomique. Figure 5 : L’électrure 9 Cs+ (18C6)2 C e -. Représentation schématique de la structure cristalline du natrure 9 Cs+ (18C6)2 C Na -, isostructural à l’électrure (maille monoclinique telle que : ♦ a = 1307 pm, b = 1584 pm, c = 1736 pm et b = 92,3° pour l’électrure ; ♦ a = 1358 pm, b = 1568 pm, c = 1743 pm et b = 93,2° pour le natrure ; dans les deux cas, groupe d’espace C2/c). Les anions, symbolisés par les petites sphères noires, occupent les centres de quatre faces (z = 1/2) et les milieux de huit arêtes (z = 0 et 1). Les cations 9 Cs+ (18C6)2 C, tous cristallographiquement équivalents, sont symbolisés par les grosses sphères blanches ; certains sont situés sur des faces en 0, y, 1/4 et 0, 1 – y, 3/4, d’autres sont à l’intérieur de la maille en 1/2, 1/2 + y, 1/4, et 1/2, 1/2 – y, 3/4 (avec y = 0,0209). La maille contient quatre cations et quatre anions. Chaque anion possède huit cations voisins à des distances 2 à 2 équivalentes allant de 790 à 930 pm. Titre de l’articleions alcalins, à anion e–... BUP no 837 BULLETIN DE L’UNION DES PHYSICIENS 1389 La mise en évidence de dérivés de ce type était de fait pressentie depuis le milieu des années 1970 mais leur très fort pouvoir réducteur et leur instabilité thermique a freiné leur caractérisation. Sur le plan chimique, ces dérivés constituent une remarquable nouveauté puisqu’il s’agit bien de sels à structure ionique dont tous les anions sont des électrons. Sur ce point, ils se différencient très nettement des solides à centres F déjà bien connus. On savait en effet depuis longtemps que des électrons pouvaient être piégés dans les solides ioniques lorsqu’on chauffe ces derniers en présence d’un métal alcalin. On parle alors de centres F ; les études physiques montrent qu’un centre F est en réalité un électron piégé dans un site anionique vacant par suite des défauts de réseau. Dans tous les cas cependant, le dérivé ainsi obtenu présente des anions « classiques » et des centres F dont la concentration est toujours faible même si elle suffit à conférer au cristal concerné des propriétés spécifiques, et notamment des couleurs caractéristiques. Pour illustrer la diversité de la chimie des électrures, on peut aussi mentionner deux autres dérivés faisant intervenir des cryptants. Le premier de stœchiométrie 7 K + C222 A e - possède une structure similaire à celle du potassure 7 K + C222 A K -, les deux mailles cristallines ayant toutes deux la particularité de présenter des cavités anioniques de forme allongée, permettant l’accueil d’une paire électronique pour le premier et d’un anion dimère K 22 - pour le second [13]. Les mesures magnétiques révèlent un état fondamental singulet (S = 0), c’est-à-dire dans lequel les deux électrons sont appariés, mais avec un état triplet (S = 1), autrement dit deux électrons de même spin, thermiquement accessible car situé seulement à environ 0,05 eV au dessus de l’état fondamental. Le second, de stœchiométrie 7 Li+ C211A e -, avait été signalé pour la première fois en 1981, mais il a fallu mettre au point des méthodes de synthèse plus performantes pour l’obtenir sous forme de monocristaux de qualité suffisante et permettre ainsi leur étude par diffraction de rayons X. Celle-ci, réalisée en 1997, montre que ce dérivé contient un cation 7 Li+ C211A structuralement très proche de celui de l’iodure 7 Li+ C211A I - [14]. Pour les raisons évoquées précédemment, l’électron qui joue le rôle d’anion ne peut être localisé par cette étude aux rayons X mais, comme dans le cas des autres électrures, la structure se caractérise par la présence de très grandes cavités puisque capables d’accueillir, dans le cas présent, des sphères de 440 pm de diamètre. Ces cavités ne sont pas isolées les unes des autres mais connectées entre elles par des canaux de 240 pm de diamètre et de l’ordre de 340 pm de longueur. Pour les électrures, des modèles théoriques et des informations apportées par diverses méthodes physiques permettent d’affirmer que les électrons sont localisés dans ces cavités, soit individuellement soit par paire selon le composé [15]. L’existence de canaux entre les cavités non seulement permet des interactions électroniques détectées par le biais de mesures de susceptibilité magnétique mais conduit souvent aussi à des échanges électroniques rapides de telle sorte que la RPE (Résonance paramagnétique électronique), méthode de choix pourtant pour l’étude des dérivés radicalaires, n’apporte Vol. 95 - Octobre 2001 Jean SALA PALA 1390 BULLETIN DE L’UNION DES PHYSICIENS pas, pour ce qui concerne les électrures, d’informations complémentaires sur la structure. CONCLUSION ET PERSPECTIVES Sur le plan pédagogique, l’existence de tels dérivés méritait à nos yeux d’être soulignée. Elle amène à réfléchir et à parler avec prudence, puisque, une fois encore, la conjugaison de la nature chimique des choses, du talent intellectuel et du savoir-faire expérimental des chimistes fait que « le vrai peut quelquefois ne pas être vraisemblable ». Pour les chercheurs, beaucoup de travail reste encore à réaliser sur ces dérivés, non seulement sur le plan expérimental, mais aussi sur le plan théorique puisque plusieurs de leurs propriétés, qui dépassent le cadre de cet article, nécessitent de nouveaux modèles. Et puis se pose bien sûr la question toujours sous-jacente « à quoi cela peut-il bien servir ? ». Pour ce qui est des électrures, l’utilisation « chimique » la plus évidente est liée à l’exploitation de leur très fort pouvoir réducteur pour la réalisation de réductions difficiles par d’autres voies, exploitation facilitée par la forte solubilité de ces dérivés dans certains solvants aprotiques, l’éther diméthylique par exemple. Ces dérivés pourront-ils avoir des applications d’ordre technologique ? Cela n’est pas invraisemblable, pour ce qui concerne les électrures en particulier, mais il est clair que de tels développements passent impérativement par l’obtention de dérivés thermiquement plus stables que ceux connus à ce jour. REMERCIEMENTS Je remercie vivement mes collègues F. CONAN, R. KERGOAT et S. TRIKI pour l’intérêt qu’ils ont porté à ce travail et l’aide qu’ils m’ont fournie lors de la préparation de cet article. BIBLIOGRAPHIE [1] DYE J. L. Progr. Inorg. Chem., 1984, 32, p. 327-441. [2] LEHN J.-M. Angew. Chem. Int. Ed. Engl., 1988, 27, p. 89-112. [3] LEHN J.-M. La chimie supramoléculaire. Concepts et perspectives. Paris : De Boeck Université, 1997. [4] PEDERSEN C. J. (a) J. Amer. Chem. Soc., 1967, 89, p. 7017-7036. (b) Angew. Chem. Int. Ed. Engl., 1988, 27, p. 1021-1027. [5] GORGUES A. Bull. Un. Phys., 1977, vol. 71, n° 595, p. 1201-1213. [6] LEHN J.-M. et SAUVAGE J.-P. J. Am. Chem. Soc., 1975, 97, p. 6700-6707. [7] DYE J. L., CERASO J. M., LOK M. T., BARNETT B. L. et TEHAN F. J. J. Amer. Chem. Soc., 1974, 96, p. 608-609. Titre de l’articleions alcalins, à anion e–... BUP no 837 BULLETIN DE L’UNION DES PHYSICIENS 1391 [8] TEHAN F. J., BARNETT B. L. et DYE J. L. J. Amer. Chem. Soc., 1974, 96, p. 72037208. [9] HUANG R. H., WARD D. L., KUCHENMEISTER M. E. et DYE J. L., J. Amer. Chem. Soc., 1987, 109, p. 5561-5563. [10] DYE J. L. Science, 1990, 247, p. 663-668. [11] ELLABOUDY A., DYE J. L. et SMITH P. B. J. Amer. Chem. Soc., 1983, 105, p. 64906491. [12] (a) DAWES S. B., WARD D. L., HUANG R. H. et DYE J. L. J. Amer. Chem. Soc., 1986, 108, p. 3534-3535. (b) DAWES S. B., WARD D. L., FUSSA-RYDEL O., HUANG R. H. et DYE J. L. Inorg. Chem., 1989, 28, p. 2132-2136. [13] (a) HUANG R. H., FABER M. K., MOEGGENBORG K. J., WARD D. L. et DYE J. L. Nature, 1988, 331, p. 599. (b) WARD D. L., HUANG R. H. et DYE J. L. Acta Crystallogr., 1988, C44, p. 1374. [14] HUANG R. H., WAGNER M. J., GILBERT D. J., REIDY-CEDERGREN K. A., WARD D. L., FABER M. K. et DYE J. L. J. Amer. Chem. Soc., 1997, 119, p. 3765-3772. [15] DYE J. L., WAGNER M. J., OVERNEY G., HUANG R. H., NAGY T. F., TOMANEK D. J. Amer. Chem. Soc., 1996, 118, p. 7329-7336. Vol. 95 - Octobre 2001 Jean SALA PALA