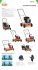Préparation de lames porte-objets pour l`examen cytologique de
Transcription
Préparation de lames porte-objets pour l`examen cytologique de
Méthode Hettich Préparation de lames porte-objets pour l’examen cytologique de liquide pleural ou d’ascite Préparation de lames porte-objets pour l’examen cytologique de liquide pleural ou d’ascite Le liquide pleural et le liquide d’ascite contiennent, outre des cellules mésothéliales, des lymphocytes ainsi que des granulocytes éosinophiles et neutrophiles. La teneur en protéines s‘élève généralement à environ 30 g/l. Le contenu cellulaire varie souvent très fortement. On peut trouver du sang dans les deux liquides mais aussi de la graisse dans le cas de l’ascite. Avantages de la méthode Hettich 1.Des chambres de cytologie adaptées à différents contenus cellulaires et volumes 2. Haut rendement cellulaire 3. Bonne représentation des cellules 4. Répartition optimale des cellules Préparation 1.Préparation d’échantillons contenant une part importante d’érythrocytes Les érythrocytes en trop grand nombre ont une influence négative sur la qualité de la préparation, il est donc recommandé de les éliminer à l‘aide d‘un tampon de lyse avant de réaliser la préparation cytologique. a) Préparation du tampon de lyse 8,29 g de chlorure d’ammonium (NH4Cl) 1,0 g de bicarbonate de potassium (KHCO3) et 0,037 gd’acide éthylène diamine tétra acétique (EDTA) sont mélangés à de l’eau distillée pour obtenir 1 litre de tampon. Pour une meilleure conservation, il est recommandé d‘autoclaver le tampon de lyse. b) Lyse des érythrocytes ·C entrifuger l’échantillon pendant 10 minutes à 350 x g (ce qui correspond à 1.700 min-1 avec le rotor 6 places, et à 1.900 min-1 avec le rotor 4 places). · Prélever le surnageant à l‘aide d‘une pipette et le mettre de côté. · Plonger le sédiment dans le tampon de lyse (10 volumes de tampon pour 1 volume de sédiment). · Bien mélanger et laisser agir pendant 10 minutes à température ambiante. L’hémoglobine se libérant entraîne une coloration rouge transparente. · Arrêter la réaction en ajoutant 10 fois la quantité de solution saline physiologique (NaCl à 0,9 %) ou de solution saline tamponnée au phosphate. · Centrifuger à 350 x g pendant 10 minutes · Déverser et jeter le surnageant et les érythrocytes lysés. · Plonger le sédiment dans 10 ml de NaCl à 0,9 % (ou PBS), bien mélanger et centrifuger une nouvelle fois à 350 x g pendant 10 minutes. · Jeter le surnageant, ajouter le sédiment au surnageant de l‘échantillon d‘origine mis de côté plus tôt, et bien mélanger. Une préparation cytologique peut à présent être obtenue à partir de cet échantillon. Important : ne pas laisser les cellules trop longtemps dans le tampon de lyse car celles-ci seraient alors également dissoutes. 2.Choix des accessoires adaptés Pour la centrifugation de liquide pleural et d’ascite, il est recommandé d’utiliser des chambres de 2 ml (réf. 1664) d’une surface de sédimentation de 60 mm2 et des chambres de 4 ml (réf. 1665) d’une surface de sédimentation de 120 mm2. Les chambres de 2 ml sont appropriées pour les échantillons contenant jusqu‘à 100.000 cellules max. et les chambres de 4 ml pour les échantillons contenant jusqu’à 200.000 cellules max. 3.Assemblage du système de cytologie Pour l’assemblage du système de cytologie, veuillez vous reporter à notre schéma « Des préparations parfaites en un tour de main – le système de cytologie HETTICH ». La préparation de lames porte-objets à partir de liquide pleural et d’ascite nécessite en règle générale une fixation sèche. Il faut donc utiliser une carte-filtre dans le système cytologique (cf. schéma, point B1). Pour la centrifugation d’échantillons infectieux, il est recommandé d’utiliser le couvercle réf. 1661 (cf. schéma, point B2). 2 Préparation de lames porte-objets pour l’examen cytologique de liquide pleural ou d’ascite 4.Centrifugation a) Sédimentation Verser l’échantillon et centrifuger pendant 10 minute à 490 x g (ce qui correspond à 2.000 min-1 avec le rotor 6 places, et à 2.200 min-1 avec le rotor 4 places). b) Retrait du surnageant acellulaire Après la centrifugation, le surnageant acellulaire se trouve encore dans la chambre et doit être retiré prudemment par aspiration. Il est important de ne pas remuer le sédiment au cours de l’aspiration, car cela pourrait influencer sa qualité et entraîner une perte de cellules. Il est donc recommandé de retirer le surnageant de haut en bas en suivant la surface du liquide à l’aide d’une pipette Pasteur. Le bout de la pipette ne doit pas toucher la lame mais laisser une petite goutte de liquide résiduel sur le sédiment ! c) Séchage du sédiment Le sédiment doit ensuite être séché pour pouvoir utiliser les très répandus colorants GIEMSA. Le séchage a lieu au cours d’une seconde centrifugation. Après avoir retiré le surnageant, détacher la bague de serrage et la retirer en même temps que la chambre (cf. schéma, point B4). Replacer la nacelle avec la plaque de fixation, la lame porte-objets et le filtre dans la centrifugeuse et centrifuger pendant 1 minute à 1 100 x g (ce qui correspond à 3 000 min-1 avec le rotor 6 places, et à 3 400 min-1 avec le rotor 4 places). Le liquide résiduel est extrait sous l’effet de la force centrifuge et absorbé par la carte-filtre. Les cellules restent sur la lame sous forme de sédiment. Elles sont parfaitement conservées et réparties de manière idéale. Le séchage par centrifugation permet d’éviter les effets entraînés par l’évaporation, tels que le rétrécissement des leucocytes et la cristallisation. d) Fixation et coloration La préparation sèche peut ensuite immédiatement être fixée puis colorée. Bon à savoir Après coloration au Giemsa ou au May-GrünwaldGiemsa, les lames porte-objets sont rincées à l’aide d’un tampon (Weise, Sörensen). Elles doivent ensuite être séchées. Le système de maintien Labora pour 6 lames porte-objets (réf. 1285) permet de réaliser ces étapes de manière simple et rapide : ·P lacer les lames porte-objets rincées avec le tampon Weise dans les supports puis les mettre dans la centrifugeuse. · Centrifuger pendant 1 minute à 275 x g (ce qui correspond à 1.500 min-1 avec le rotor 6 places, et à 1.700 min-1 avec le rotor 4 places). · Sortir les supports contenant les lames porte-objets sèches de la centrifugeuse. · Les préparations peuvent maintenant être observées au microscope et/ou recouvertes. · Essuyer les nacelles. Le rotor 6 places permet de sécher jusqu’à 36 lames porte-objets simultanément. Références pour la commande Centrifugeuse Réf. 1206 ROTOFIX 32 A UNIVERSAL 320 / UNIVERSAL 320 R Accessoires sélectionnés 1401 / 1406 1) Réf. Rotor 4 places 1624 Rotor 6 places 1626 Nacelle de cytologie 1660 Couvercle pour réf. 1660 1661 Plaque de fixation avec bague de serrage 1662 Chambre de cytologie 1 x 2 ml (60 mm²) 1664 Chambre de cytologie 1 x 4 ml (120 mm²) 1665 Système de maintien Labora pour 6 lames porte-objets 1285 1)Vous trouverez notre gamme complète d’accessoires pour la cytologie dans notre catalogue de cytologie que vous pouvez obtenir gratuitement sur demande. Andreas Hettich GmbH & Co. KG Föhrenstr. 12 D -78532 Tuttlingen Allemagne www.hettichlab.com [email protected] [email protected] Tél. Fax +49 (0)7461 / 7 05 - 0 +49 (0)7461 / 7 05 - 1 22 Ventes nationales : - 200 Ventes internationales : - 201 Service clients pour l‘Allemagne : - 202 Service clients pour l‘étranger : - 203