ESSAI-STAGE Statines et évolution d`un cancer superficiel de la
Transcription
ESSAI-STAGE Statines et évolution d`un cancer superficiel de la
UNIVERSITÉ LAVAL
Faculté des Sciences et de Génie
Département de Mathématiques et de Statistique
ESSAI-STAGE
Présenté à la Faculté des études Supérieures de l’Université Laval dans
le cadre de la maîtrise en Statistique pour l’obtention du grade de :
Maître ès Sciences
Spécialité Biostatistique
Statines et évolution d’un
cancer superficiel de la vessie
L’effet de l’exposition
Présenté par
Modou Sene
Directeur : Thierry Duchesne
Co-directeur : Vincent Fradet
2012
c modou sene
Remerciements
Arrivé au terme de la rédaction de ce travail, il m’est particulièrement agréable d’exprimer ma gratitude, mes reconnaissances et mes sincères remerciements à tous ceux
qui, par leur enseignement, leur soutien et leurs conseils, m’ont aidé à y parvenir.
Je tiens dans un premier temps à remercier mon superviseur, le professeur Thierry
Duchesne, d’abord de m’avoir fait confiance et d’avoir cru en moi pour une collaboration ; qui d’ailleurs a été d’une grande aide pour moi tout au long de cette maîtrise.
Sa gentillesse, sa disponibilité, son soutien pédagogique et financier surtout, ainsi que
la qualité de son encadrement m’ont permis de réaliser ce travail dans les meilleures
conditions, et de profiter pleinement de cette expérience combien importante.
Je tiens aussi à remercier mon co-directeur, Dr Vincent Fradet qui m’a honoré de sa
confiance en m’acceptant au sein de son laboratoire au centre de recherche du CHUQ
Hôtel-Dieu Québec et d’avoir co-dirigé cet essai. Promoteur de ce projet, il m’a permis
de mener un travail de recherche dans un esprit scientifique rigoureux, mais stimulant.
Malgré son volume de travail, il a toujours été à l’écoute, disponible, prêt à répondre à
toutes les questions et à apporter de précieuses remarques ou suggestions pour l’avancement du projet. Il m’a donné l’occasion également de mieux me familiariser avec la
manipulation de grandes bases de données. Son écoute attentive, sa disponibilité, son
soutien financier, la documentation fournie, ainsi que ses vastes connaissances dans sa
c modou sene
Ulaval_2012
i
spécialité, m’ont été d’une aide précieuse. Je lui adresse mes plus sincères remerciements.
Je tiens à témoigner ma reconnaissance, et ma gratitude à André Caron pour le temps
qu’il a consacré à la relecture des codes de programmation, à l’explication du projet. Par
sa maîtrise du projet, ses connaissances et aptitudes en programmation, sa simplicité
et sa disponibilité, il m’a aidé à comprendre le projet et à réaliser certaines analyses.
Merci André de tes précieux conseils, remarques, suggestions et solutions.
Merci également aux professionnels de recherche, agents administratifs et autres étudiants rencontrés au centre de recherche du CHUQ Hôtel-Dieu Québec.
Enfin, je remercie tous les enseignants, parents, amis et camarades de promotion pour
leurs apports, amours et soutiens multiples.
c modou sene
Ulaval_2012
ii
Table des matières
Remerciements
i
Liste des tables
v
Liste des figures
vi
Notations
vii
Résumé
ix
Introduction
1
I
3
Le cadre théorique
1 Cancer de la vessie, statines
1.1 Le cancer de la vessie . . . . . . . . . . . . . . . . . . . . . . . . .
1.1.1 La vessie . . . . . . . . . . . . . . . . . . . . . . . . . . . .
1.1.2 La maladie . . . . . . . . . . . . . . . . . . . . . . . . . .
1.1.2.1 Facteurs de risque . . . . . . . . . . . . . . . . .
1.1.2.2 Signes, symptômes, diagnostic . . . . . . . . . . .
1.1.2.3 Pathologie et stadification du cancer de la vessie .
1.1.2.4 Traitement - interventions . . . . . . . . . . . . .
1.2 Les statines . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
1.2.1 Propriétés et mécanisme d’action des statines . . . . . . .
1.2.2 Les statines utilisées dans l’étude . . . . . . . . . . . . . .
1.3 Description de l’étude . . . . . . . . . . . . . . . . . . . . . . . . .
1.3.1 Devis et population d’étude . . . . . . . . . . . . . . . . .
1.3.2 Outils et méthodes . . . . . . . . . . . . . . . . . . . . . .
.
.
.
.
.
.
.
.
.
.
.
.
.
4
4
4
5
5
6
7
8
9
10
11
11
12
14
2 Modèle semi-paramétrique en analyse de survie
2.1 Rappels et définitions . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2.1.1 Censure et troncation . . . . . . . . . . . . . . . . . . . . . . . .
2.1.2 Fonctions essentielles à une analyse de survie . . . . . . . . . . .
15
16
17
18
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
2.2
II
Le modèle de risques proportionnels de Cox . . . . . . . . . . . . . . .
2.2.1 Le modèle . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2.2.2 Rapport de risques, hypothèses et interprétation des coefficients
du modèle . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2.2.3 Modèle de Cox avec covariables dépendant du temps d’évènement
2.2.4 Estimations et inférences . . . . . . . . . . . . . . . . . . . . . .
2.2.4.1 Estimation des coefficients β par max de vraisemblance
2.2.4.2 Estimation de h0 (t) et S(t) . . . . . . . . . . . . . . .
2.2.4.3 Tests et intervalles de confiance . . . . . . . . . . . . .
2.2.5 Ajustement d’un modèle de Cox . . . . . . . . . . . . . . . . . .
2.2.5.1 Validation a posteriori des hypothèses du modèle . . .
2.2.5.1.1 Forme fonctionnelle . . . . . . . . . . . . . . .
2.2.5.1.2 Hypothèse de proportionnalité . . . . . . . . .
2.2.5.1.3 Modèle stratifié . . . . . . . . . . . . . . . . .
2.2.5.2 Vérification de l’ajustement du modèle . . . . . . . . .
Analyses et résultats
20
22
23
24
26
26
26
26
26
27
28
28
29
3 Variables et analyse descriptive
3.1 Les variables . . . . . . . . . . . . . . . . . . .
3.1.1 Les variables d’issue et leurs définitions
3.1.2 Les covariables retenues . . . . . . . .
3.2 Modélisation de la variable statine . . . . . . .
3.2.1 L’approche densité . . . . . . . . . . .
3.2.2 Moyennes mobiles . . . . . . . . . . . .
3.2.3 Demi-vie . . . . . . . . . . . . . . . .
3.3 Caractéristiques des patients . . . . . . . . . .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
4 Modélisation de l’effet statine
4.1 Vérification des hypothèses et ajustement du modèle aux données
4.1.1 Forme fonctionnelle et hypothèse de proportionnalité . . .
4.1.1.1 Forme fonctionnelle . . . . . . . . . . . . . . . . .
4.1.1.2 Hypothèse de proportionnalité . . . . . . . . . . .
4.1.2 Ajustement global du modèle aux observations . . . . . . .
4.2 Résultats . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4.2.1 Effet des statines sur la récidive . . . . . . . . . . . . . . .
4.2.2 Effet des statines sur la progression des tumeurs . . . . . .
4.2.3 Effet des statines sur le décès toutes causes . . . . . . . . .
Conclusion - Discussion
c modou sene
19
20
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
30
30
30
31
32
33
34
35
36
.
.
.
.
.
.
.
.
.
38
38
38
38
40
41
41
41
42
43
44
Ulaval_2012
iv
Bibliographie
56
Annexe
56
c modou sene
Ulaval_2012
v
Liste des tableaux
1.1
1.2
Caractéristiques des statines . . . . . . . . . . . . . . . . . . . . . . . .
Caractéristiques pharmacocinétiques des statines . . . . . . . . . . . .
11
11
4.1
2
3
4
5
6
7
8
9
10
11
12
Décès : forme fonctionnelle âge, cds et nbr_hosp
. . . .
Selction des cohortes . . . . . . . . . . . . . . .
Caractéristiques des patients . . . . . . . . . . .
Risques relatifs (RR) pour la récidive . . . . . .
Risques relatifs (RR) pour la progression . . . .
Risques relatifs (RR) pour le décès toutes causes
Récidive : test global de nullité des coefficients . . . . .
Progression : test global de nullité des coefficients . . .
Décès : test global de nullité des coefficients . . . . . .
Extrait du codes SAS pour l’issue décès . . . . .
Codes SAS pour l’issue décès (suite) . . . . . .
Codes SAS pour l’issue décès (suite et fin) . . .
40
62
63
64
64
64
65
65
65
66
67
68
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
Table des figures
1.1
Options thérapeutiques
2.1
Exemple : censure et troncation
1
2
3
4
5
Classification TNM
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
. . . . . . . . . . . . . . . . . . . . . . . . . . . .
9
. . . . . . . . . . . . . . . . . . . . . . . . .
17
. . . . . . .
Stadification . . . . . . . . . . .
Tumeur - ganglion - métastase
Récidive : forme fonctionnelle âge .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
Récidive : Transformation de âge en âge2 . . . . . . . . . . . . . . . . . . . . .
Progression : forme fonctionnelle âge . . . . . . . . . . . . . . . . . . . . . . . . .
Progression : forme fonctionnelle âge . . . . . . . . . . . . . . . . . . . . . . . . .
Décès : forme fonctionnelle âge . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Décès : forme fonctionnelle nbr_hosp . . . . . . . . . . . . . . . . . . . . . . . . .
Récidive : HP pour âge2 avec les résidus de Schoenfeld . . . . . . . . . . . . . . .
Récidive : HP pour le sexe avec les résidus de Schoenfeld . . . . . . . . . . . . . .
Progression : Hypothèse de proportionnalité pour le sexe avec LLS . . . . . . . .
Progression : Hypothèse de proportionnalité pour l’âge avec le processus du score
Progression : HP pour âge avec les résidus de Schoenfeld . . . . . . . . . . . . . .
Progression : HP pour le sexe avec les résidus de Schoenfeld . . . . . . . . . . . .
Décès : Hypothèse de proportionnalité pour l’âge avec LLS . . . . . . . . . . . .
Décès : Hypothèse de proportionnalité pour l’âge avec les résidus de Schoenfeld .
Décès : Hypothèse de proportionnalité pour le sexe avec LLS . . . . . . . . . . .
Décès : Hypothèse de proportionnalité pour le sexe avec le processus du score . .
Décès : Hypothèse de proportionnalité pour le sexe avec les résidus de Schoenfeld
Décès : Hypothèse de proportionnalité pour le cds avec les résidus de Schoenfeld
Décès : Hypothèse de proportionnalité pour hosp avec LLS . . . . . . . . . . . .
Décès : Hypothèse de proportionnalité pour hosp avec les résidus de Schoenfeld .
Pondération pour les 30 jours pour chaque approche . . . . . . . . . . . . . . . .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
57
57
57
58
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
58
58
58
58
58
59
59
59
59
59
59
60
60
60
60
60
60
61
61
61
Abréviations
1. AIC : Akaike information criterion (Critère d’Information d’Akaike)
2. BCG : Bacille Calmette-Guérin
3. CDS : Chronical diseases score
4. CHUQ :Centre hospitalier universitaire du Québec
5. CIM : Classification internationale des maladies (en anglais ICD International Statistical Classification of Diseases and Related Health Problems)
6. CPS : Compendium des produits et spécialités pharmaceutiques
7. CrCHUQ : Centre de recherche du centre hospitalier universitaire du Québec
8. CRCEO : Centre de recherche clinique et évaluative en oncologie
9. DVk : demi-vie de k jours
10. HDL : High Density Lipoproteins (lipoprotéines de haute densité)
11. HMG-CoA : 3-hydroxy-3-méthyl-glutaryl coenzyme A réductase
12. IMC : Indice de masse corporelle
13. LDL : Low Density Lipoproteins (lipoprotéines de base densité)
14. LLS : log{−log[S(t)]}
15. MMA :Moyenne mobile arithmétique
16. MMP :Moyenne mobile pondérée
17. MME :Moyenne mobile exponentielle
18. OMS : Organisation mondiale de la santé
19. RAMQ : Régie de l’Assurance Maladie du Québéc
20. RTUTV :Résection transurétrale d’une tumeur de la vessie
21. SQL : Structured Query Language (langage de requête structurée en français)
22. TG : Triglycerides
23. TNM :T=Tumeur, N = ganglion (Node en anglais), M = Métastase
24. TR : Toucher rectal
25. TVIM :Tumeurs de la vessie infiltrant le muscle
26. TVNIM :Tumeurs de la vessie sans infiltration du muscle de la vessie
27. UICC : Union for International Cancer Control (Union internationale contre le cancer)
Résumé
Les statines sont des médicaments qui font baisser le "mauvais" cholestérol du corps
humain. Depuis leur découverte aux alentours de 1970, ils n’ont cessé de voir leur utilisation augmenter. Différentes études en prévention primaire et en prévention secondaire
ont démontré des effets préventifs des statines pour les maladies cardiovasculaires, le
diabète, certains cancers (prostate, langue, œsophage, sein, etc.). Pour le cancer de la
vessie, les résultats actuels n’évoluent pas dans le même sens. Dans l’essentiel de ces
investigations, la définition de l’exposition n’est pas la même, et l’hétérogénéité des
cohortes constitue souvent une limite de l’étude.
Notre objectif est d’étudier l’effet d’une prise d’une statine en intervention secondaire
sur une évolution (la récidive des tumeurs, la progression des tumeurs vers le muscle de
la paroi vésicale, le décès toutes causes confondues) d’un cancer superficiel de la vessie.
Nous avons utilisé une étude observationnelle, rétrospective basée sur une population
de 3 037 patients identifiés à partir de bases de données de la Régie de l’Assurance
maladie du Québec (RAMQ) entre le 1 juillet 1995 et le 31 mars 2002. Un modèle de
Cox avec des variables dépendantes du temps est utilisé pour estimer le risque relatif
(RR). Pour la variable d’exposition, nous avons utilisé plusieurs approches de modélisation (dichotomique, avec la densité, avec les moyennes mobiles, la demi-vie). Enfin
pour chaque issue, nous avons utilisé le critère AIC pour identifier le meilleur modèle.
Introduction
L’Aide-mémoire N˚297 publiée par L’Organisation mondiale de la santé (OMS) en février 2012 1 , énonce qu’en 2008 le cancer était responsable d’environ 13% de la mortalité
mondiale, soit 7.6 millions d’individus. Selon les prévisions de la même source, en 2030,
le nombre de décès attribuables aux cancers atteindra la barre des 13.1 millions de
personnes à travers le monde. Avec ces chiffres, nous constatons qu’en moins d’un quart
de siècle, le nombre de décès liés aux cancers va presque doubler.
L’édition 2012 des statistiques canadiennes sur le cancer [pages 7-10] (2) prévoit une
hausse du nombre de nouveaux cas de cancers diagnostiqués au Canada. Selon ces prévisions, en moyenne 500 personnes par jour recevront le diagnostic d’un cancer. Dans
ce lot, 200 mourront de la maladie, soit presque la moitié. Pour le cancer de la vessie,
le nombre de nouveaux cas est estimé à 7800, dont 4300 hommes (soit 55.1%). Ces prévisions estiment que 2100 (dont 670 femmes, soit 32 %) des cas prévalent en mourront.
En face de telles projections, il nous semble urgent de mener des investigations, qui certainement, permettront de mieux cerner les facteurs de risque et les effets préventifs ou
protecteurs. Or des facteurs liés à l’alimentation (trop de gras), aux habitudes de vie (la
sédentarisation, la cigarette, l’alcool), à la génétique et au milieu de vie (géographique
ou professionnel) sont souvent ciblés comme facteurs pronostiques de la maladie. Cette
façon de vivre, surtout dans les pays industrialisés, explique en partie ou totalement
certains changements de la morphologie de l’état de santé des personnes (l’obésité, IMC
élevé, excès de mauvais cholestérol dans le sang). Selon le site québécois des maladies du
cœur 2 , près de 40% de la population canadienne adulte affiche un taux de cholestérol
élevé. Cette même source estime qu’environ 10 millions d’adultes canadiens ont un taux
de cholestérol plus élevé que les cibles recommandées.
Pour traiter cet excès de mauvais cholestérol dans le sang, on utilise généralement une
famille de médicaments appelée les hypolipidémiants [médicaments dont l’action thérapeutique est de réduire les lipides (triglycérides et/ou cholestérol) du sang]. Les statines
ou inhibiteurs de la HMG-CoA réductase, depuis leur apparition dans les années 70,
ont vu au travers d’essais randomisés et de méta-analyses leurs effets préventifs prouvés
1. http :www.who.int/mediacentre/factsheets/fs297/fr/index.html
2. http ://www.fmcoeur.qc.ca/site/c.kpIQKVOxFoG/b.3669779/k.BC38/Accueil.htm
pour les maladies cardio-vasculaires (9) et pour certains cancers [sein (11), œsophage
(59), prostate (26), estomac (59)]. Pour le cancer de la vessie, en plus de la discordance
notée au niveau des résultats des études [certaines études soutiennent un effet protecteur (17) et (34), alors que d’autres suggèrent le contraire (59)], on constate le plus
souvent que l’effet d’une prise de satines sur le cancer de la vessie est non significatif
(35), (32). Avec les différents résultats des quelques rares études s’intéressant à l’effet
des statines sur le cancer de la vessie, il apparaît quil n’y a pas eu de réelles preuves
expérimentales, biologiques permettant détablir des recommandations solides sur l’effet
anticancer des statines. Dans la plupart des études épidémiologique actuelles, on note
une variation très importante dans la définition de l’exposition, une hétérogénéité des
cohortes (patients avec des tumeurs superficielles, infiltrantes, ou qui se métastasent
dans la même cohorte). Ce document va tenter d’apporter une contribution à cette
question qui demeure en suspens, mais nous allons mener notre investigation avec une
cohorte de patients avec un cancer superficiel de la vessie.
L’objectif du présent travail est d’étudier l’effet d’une prise d’une statine en intervention
secondaire sur une évolution d’un cancer superficiel de la vessie. Cet objectif général
sera scindé en trois sous-objectifs, à savoir quel est l’effet de la prise d’une statine sur
la récidive des tumeurs ; son effet sur la progression des tumeurs vers le muscle de la
paroi vésicale ; et enfin son effet sur le décès toutes causes confondues.
Puisque dans la plupart des cas, les études s’intéressant au lien entre statines et certains cancers suggèrent un effet protecteur, nous postulons qu’une prise d’une statine
diminue le risque de récidive et de progression des tumeurs et augmente la durée de
survie des patients atteints d’un cancer superficiel de la vessie.
c modou sene
Ulaval_2012
2
Première partie
Le cadre théorique
3
Chapitre 1
Cancer de la vessie, statines
1.1
Le cancer de la vessie
Selon les statistiques de la société canadienne du cancer (8, pp. 10 - 12), 7800 nouveaux
cas de cancer de la vessie, dont 5800 hommes et 2000 femmes seront diagnostiqués au
Canada en 2012. Le nombre de décès spécifiques au cancer de la vessie parmi tous les
cas prévalent est estimé à 1450 et 670 respectivement pour les hommes et les femmes. Le
cancer de la vessie est le quatrième cancer en termes d’incidence au Canada (5.9 % de
tous les cas incidents sauf ceux relatifs aux cancers de la peau autre que le mélanome),
après celui de la prostate (27.2%), des poumons (13.6%), du côlon et du rectum (13.3%).
Il est la septième cause de décès de tous les cancers (3.6 %) après le cancer des poumons
(27.2 %), du côlon et du rectum (12.7 %), de la prostate (10 %), du pancréas (5.4 %),
de la leucémie (3.8 %) et le lymphome non hodgkinien (3.8 %).
Quels sont les facteurs à risque ? Quels sont les signes, les symptômes et les stades
de la maladie ? Quels sont les moyens de diagnostic et les traitements utilisés ? Pour
répondre à ces questions, nous décrirons d’abord l’anatomie structurelle et fonctionnelle
de la vessie, avant de faire un bref résumé sur la maladie.
1.1.1
La vessie
La vessie est un organe de l’appareil urinaire qui possède la capacité de se gonfler
et de se rétracter. Elle peut contenir entre 400 et 700 millilitres d’urine et est logée
dans la partie inférieure de l’abdomen. Chez l’homme, le rectum est juste derrière
la vessie et la prostate se situe en dessous de celle-ci. Chez la femme, l’utérus et le
1.1 Le cancer de la vessie
vagin se tiennent entre la vessie et le rectum. La vessie a une fonction de réservoir et
une fonction d’évacuation. Elle reçoit l’urine produite par les reins via l’uretère, puis
l’élimine au cours de la miction par l’urètre après l’avoir stockée.
1.1.2
La maladie
Le cancer de la vessie est un cancer qui se forme dans les cellules épithéliales de la
vessie et correspond à une prolifération de cellules anormales qui s’accumulent dans les
tissus de la vessie pour former une tumeur. Environ 90% des tumeurs vésicales sont des
tumeurs transitionnelles, 5 à 10% sont de type épidermoïde et une faible proportion,
moins de 2%, sont de type adénocarcinome et autres types rares. Ces tumeurs vésicales
qui se limitent à la couche de cellules qui revêtent la paroi interne de la vessie sont
dites urotheliales, c’est-à-dire relatives à l’urothélium (revêtement interne des parois de
la vessie). Toutefois, les tumeurs peuvent envahir le muscle de la paroi vésicale (cancer
invasif) ou d’autres parties du corps voisines de la vessie (métastase). Au diagnostic,
70% des tumeurs de la vessie sont des tumeurs superficielles. Selon Soloway et al (54,
p. 141-237), Vogelzang et al (60, p. 355-542) et Monge (44, p. 267), dans 60 à 70%, ces
tumeurs superficielles récidivent et leur progression vers des tumeurs qui envahissent le
muscle en devenant potentiellement métastatiques est observée dans 20 à 30% des cas.
Le pronostic d’un cancer de la vessie dépend du grade (il est relatif à l’importance des
anomalies des cellules présentes dans la tumeur, le grade étant d’autant plus élevé que
les cellules de la tumeur sont anormales) et du stade [il détermine la profondeur atteinte
par les racines de la tumeur dans la paroi vésicale, ou même l’extension de celle-ci à
des organes voisins de la vessie ou éloignés (métastase)].
1.1.2.1
Facteurs de risque
Dans la littérature scientifique, il est prouvé que le risque de cancer de la vessie est
très élevé chez les fumeurs ou les grands buveurs d’alcool (48) et (19). On peut noter
que le système urinaire qui comprend entre autres les reins, les uretères, la vessie et
l’urètre contribuent à l’élimination des déchets du corps sous forme d’urine. L’élimination des substances toxiques du tabac par les urines via la vessie peut provoquer des
dégâts importants au niveau de cet organe. Certaines infections chroniques de la vessie
(bilharziose urinaire) et certaines expositions professionnelles (à l’arsenic, aux amines
aromatiques utilisées dans les industries du caoutchouc, de l’aluminium, du textile et
des matières synthétiques) constituent des facteurs de risque au cancer de la vessie
(19). Le risque de développer un cancer de la vessie augmente avec l’âge (la plupart des
c modou sene
Ulaval_2012
5
1.1 Le cancer de la vessie
cas sont diagnostiqués chez les personnes de plus de 60 ans) (45), le sexe (les hommes
présentent un risque sensiblement plus grand que les femmes) et des antécédents familiaux (certains types de cancers de la vessie sont liés à des mutations dans la structure
génétique (ADN) des cellules du corps, qui peuvent se transmettre de génération en
génération) (21), (20). D’autres facteurs de risque comme la consommation régulière
de café ou de sucreries artificielles sont souvent évoqués sans que l’on puisse fournir
réellement la preuve de la toxicité de ces produits.
1.1.2.2
Signes, symptômes, diagnostic
Les symptômes suivants sont associés à une manifestation d’un cancer de la vessie :
hématurie (présence de sang dans les urines surtout en l’absence d’infection urinaire),
besoin fréquent d’uriner, besoin urgent d’uriner, incapacité d’uriner et brûlure ou douleur pendant la miction. Bien que ces derniers symptômes soient associés à d’autres
maladies, leur présence doit pousser à la consultation d’un spécialiste. En fonction du
contexte et des caractéristiques du patient, le spécialiste aura recours soit à :
Un examen physique. C’est un examen qui permet au médecin de rechercher tout
signe permettant d’identifier la présence d’un cancer de la vessie. Il peut faire un toucher rectal (TR), une palpation de l’abdomen ou un examen pelvien bimanuel pour la
femme.
Examen cytologique des urines. Il permet d’observer les cellules libérées par le
revêtement de la vessie dans l’urine et de déterminer s’il y a ou non présence de tumeurs malignes. En complément de la cytologie urinaire, de récentes méthodes ont été
développées en biologie moléculaire. Nous citons : le BTA (Bladder Tumor Antigen), la
détermination de la matrice protéique urinaire (NMP22), examen immunocytologique
(ImmunoCyt), UroVysion (60, pp. 403-410), (49, p. 148).
Analyse sanguine. Elle indique si les organes fonctionnent correctement à travers la
qualité et l’apparence des différents types de cellules sanguines.
Cystoscopie. Elle permet d’observer l’intérieur de la vessie à l’aide d’un cystoscope
(dispositif optique). Cet examen de référence est le plus important, puisqu’il permet
d’évaluer la taille, le volume, l’unicité, l’emplacement et le mode de croissance des tumeurs.
Biopsie. La biopsie est utilisée pour établir avec certitude un diagnostic d’un cancer
de la vessie. Typiquement, elle se fera au moment de la résection transurétrale d’une
tumeur de la vessie (RTUTV) qui établit le diagnostic du cancer de la vessie. Cette
procédure consiste à prélever du tissu ou des cellules de la vessie enfin de les analyser
en laboratoire. Les résultats des analyses indiqueront ou non une présence de cellules
cancéreuses.
Techniques d’imagerie. Elles permettent d’avoir un examen approfondi des tissus,
c modou sene
Ulaval_2012
6
1.1 Le cancer de la vessie
des organes et des os. Comme technique utilisée, nous citons la radiographie, l’échographie, la tomodensimétrie (TDM), l’imagerie par résonnance magnétique (IRM), etc.
Avec ces différentes techniques, on obtient des images pouvant fournir des informations
sur la taille, la forme et l’emplacement d’une tumeur et surtout sur la stadification
tumorale clinique.
1.1.2.3
Pathologie et stadification du cancer de la vessie
Les informations relatives à la taille, au nombre, au volume et à l’emplacement de la
tumeur permettent de quantifier l’agressivité de la maladie (stade, grade). La combinaison de cette stadification du cancer de la vessie et de certaines caractéristiques du
patient (âge, récidive, progression, etc.) permettent généralement d’identifier, de choisir
un traitement adéquat et de faire des pronostics sur différentes issues liées à la maladie
(récidive, progression, survie spécifique, décès toutes causes confondues). Il existe plusieurs classifications portant sur la nature et la forme de la tumeur. La classification
la plus utilisée est celle du système T.N.M. de l’American Joint Committee on Cancer.
Cette dernière est basée sur la combinaison de T, taille de la tumeur et invasion des
tissus avoisinants ; N, atteinte des ganglions lymphatiques et M, propagation du cancer
a un autre organe du corps (métastases).
T (Tumor ou tumeur) : elle donne des informations sur l’extension locale de la lésion
dans la paroi de la vessie. Elle est suivie d’un chiffre allant de 0 à 4 pour décrire l’importance de l’extension de la lésion. Plus ce chiffre est élevé, plus il y a une augmentation
de la tumeur. On utilise une biopsie, un RTUTV pour la détermination du stade de la
tumeur.
N (Nodes ou ganglions) : la lettre N suivie d’un chiffre allant de 0 à 3 indique toute
propagation du cancer vers les ganglions lymphatiques situés près de la vessie et si les
ganglions touchés sont fixés à d’autres structures anatomiques. Les techniques utilisées
sont basées sur l’imagerie.
M (Metastasis ou métastases) : elle est suivie d’un 0 ou d’un 1 pour indiquer si oui
ou non le cancer s’est propagé à des organes distants. Cette caractéristique est mesurée
à l’aide des techniques d’imagerie.
Une fois que le diagnostic est confirmé, il faut déterminer le stade et le grade de la
maladie. Le stade correspond à la profondeur de la pénétration de la tumeur dans la
paroi vésicale. Les stades sont exprimés par un chiffre allant de 0 (le moins avancé) à 4
(le plus avancé). Moins le stade est avancé, meilleur est le pronostic. Le grade est basé
sur la différence d’aspect des cellules tumorales par rapport aux cellules normales de
la vessie. Il permet d’évaluer la vitesse à laquelle les cellules se divisent et leur degré
d’envahissement.
Grade G1 : bas grade. Il s’agit d’une tumeur dont la croissance est lente et associée
c modou sene
Ulaval_2012
7
1.1 Le cancer de la vessie
à un risque de propagation moins élevé.
Grade G2 : grade modéré.
Grade G3 : haut grade. Leur croissance est rapide et le risque de propagation est
très élevé.
La RTUTV donne des informations relatives au grade de la tumeur. Dans les tableaux
1, 2, 3 page 57, on a la classification TNM 2009 de l’Union for International Cancer
Control (UICC) et la stadification de la maladie (1) 1 . On classe également les tumeurs
de la vessie en deux grands sous-groupes : les tumeurs de la vessie avec infiltration
du muscle (TVIM) et les tumeurs de la vessie non infiltrantes du muscle de la vessie
(TVNIM). Les tumeurs de la vessie infiltrant le muscle (TVIM), pT2a/T2b et pT3
représentent 20 % des cas. Les tumeurs pT4 ne comptent que pour 10 % des cas diagnostiqués. Elles touchent les couches profondes du tissu de la vessie et elles peuvent
envahir la graisse ou les organes voisins. Elles sont plus dangereuses que les tumeurs
superficielles, car elles métastasent plus souvent et plus précocement. Les tumeurs de
vessie non infiltrantes du muscle (TVNIM) sont des tumeurs superficielles, pTa (Tumeur papillaire non invasive), pTis (carcinome in situ, tumeur plane) ou pT1 (Tumeurs
envahissant le chorion), qui se développent à partir de la muqueuse de la paroi vésicale
(voir figures 2,1, 3 page 57).
1.1.2.4
Traitement - interventions
Les tumeurs de la vessie malignes sont le plus souvent superficielles. Cependant elles
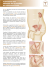
peuvent parfois atteindre les couches profondes de la vessie, à savoir le muscle. L’intervention dépendra du sujet et des caractéristiques de la maladie (voir figure 1.1 2 ).
Pour les TVNIM (Ta, T1 et CIS) à faible risque de progression, un traitement local
permettant de retirer la tumeur par intervention chirurgicale est utilisé. La résection
transurétrale de tumeurs de la vessie (RTUTV), en plus de son intérêt diagnostique, est
le premier traitement appliqué aux tumeurs non infiltrantes. Dans le cas de tumeurs à
haut risque de récidive, cette intervention est combinée avec un traitement complémentaire délivré localement dans la vessie (traitement adjuvant intravésical) pour réduire
le risque de récidive ou de progression de la tumeur. Avec cette chimiothérapie intravésicale, l’agent est instillé dans la vessie peu de temps après la résection endoscopique
initiale. Il est souvent utilisé comme traitement de maintient par la suite. Cette intervention permet de prévenir l’implantation des cellules tumorales immédiatement après
résection endoscopique de la tumeur vésicale. Des agents tels que la Mitomycine C MMC (le plus utilisé), valrubicine, épirubicine, doxorubicine, Bacille de Calmette et
1. http://www.arcagy.org/infocancer/localisations/rein-et-voies-urinaires/
cancer-vessie/formes-de-la-maladie/les\discretionary{-}{}{}differents-stades.html
2. extraite présentation du Dr Fradet et al. RQRUM - Montréal 12 juin 2007
c modou sene
Ulaval_2012
8
1.2 Les statines
Figure 1.1 – Options thérapeutiques
Guérin - BCG, etc. sont instillés localement dans la vessie immédiatement après un
RTUTV.
Il est généralement recommandé une cystectomie radicale aux patients qui ont une
tumeur de haut grade surtout des tumeurs musculaires infiltrantes T2 et T1 de haut
grade réfractaires au traitement intravésical comme le BCG. Une cystectomie radicale
consiste à l’ablation complète de la vessie ainsi que du tissu adipeux et du péritoine
périvésical, de la prostate et des vésicules séminales chez l’homme. Pour la femme, il y
a une exentération pelvienne antérieure. Il y a ablation de la vessie ainsi que du tissu
adipeux et du péritoine périvésical, de l’utérus et de son col, de la voûte vaginale antérieure, de l’urètre et des ovaires. Une chimiothérapie néoadjuvante peut être administrée
avant une cystectomie ou une radiothérapie définitive. Pour les sujets inaptes pour la
cystectomie totale ou qui désirent conserver leur vessie, ils peuvent être traités avec
résection répétée et traitement intravésical répété. Une combinaison d’une RTUTV, radiothérapie, chimiothérapie utilisant comme protocole de protection vésicale avec des
tumeurs infiltrantes le muscle peut être envisagée (49, pp.150-156).
Pour le cas d’un cancer qui s’est métastasé, du fait qu’il est difficile de retirer toute
la tumeur par intervention chirurgicale locale, l’intervention consiste à atteindre ces
cellules par une chimiothérapie par voie intraveineuse.
1.2
Les statines
Selon la version 2010 du CPS (14, p. 1295) et Eric Bruckert (18), la première statine
(inhibiteur 3-Hydroxy-3-methylglutaryl-coenzyme A (HMG-CoA) reductase) a été isolée dans une culture Penicillinum citrinum et s’est d’abord appelée Compactine, puis
c modou sene
Ulaval_2012
9
1.2 Les statines
mévastatine. La découverte de la Compactine par le biochimiste et microbiologiste japonais Akira Endo en 1976 et celle obtenue de façon indépendante par Brown à partir
d’une culture de Penicillinum brevicompactum a permis le développement d’une nouvelle classe d’agents hypolipidémiants, les inhibiteurs de la 3-hydroxy-3-méthyl-glutaryl
(HMG-CoA) coenzyme A réductase. Cette découverte lui a valu le prix Albert Lasker
pour la recherche médicale clinique en 2008. La lovastatine (mévinoline) a été découverte par Alberts à partir d’une souche différente de levure, Aspergillus terreus (12).
La simvastatine a été obtenue en 1984 par synthèse chimique partielle, par ajout d’un
second radical méthyl à la lovastatine. La pravastatine, puis la fluvastatine, premier
inhibiteur de l’HMG-CoA réductase entièrement synthétique, puis l’atorvastatine et la
cérivasatatine. L’avancée thérapeutique apportée par les statines vient essentiellement
des résultats obtenus dans les grandes études de prévention, notamment pour les maladies cardio-vasculaires. Cette famille de médicaments, depuis qu’elle a été formellement
établie grâce aux études (22), (9), (23), (50), (53), a vu sans cesse progresser l’intérêt
qui lui est accordé pour une intervention auprès de patients dyslipidémiques. Ces études
réalisées soit avec une statine, soit avec des fibrates ou avec d’autres hypolipidémiants
ont prouvé qu’un abaissement du LDL-cholestérol permet de réduire significativement
la morbi-mortalité. Elles ont constaté un effet des hypolipidémiants sur les autres lipoprotéines. Une réduction de la triglycérine est constatée et une augmentation du "bon"
cholestérol, les HDL.
Nous aborderons d’abord les propriétés et mécanismes d’action des statines, et ensuite
nous donnerons les caractéristiques des différentes statines utilisées pour cette étude.
1.2.1
Propriétés et mécanisme d’action des statines
Les statines sont des médicaments de la famille des hypocholestérolémiants. Elles sont
des inhibiteurs (elles empêchent ou ralentissent) de l’HMG-CoA Réductase, une enzymeclé qui déclenche la synthèse du cholestérol. Les statines bloquent donc la synthèse
hépatique du cholestérol, ce qui entraîne une augmentation des récepteurs des lipoprotéines de basse densité (LDL) dans le foie surtout. L’organisme produit donc moins de
cholestérol et ce ralentissement de la production de cholestérol aura pour conséquence
de signaler au foie d’absorber davantage des lipoprotéines à faible densité (Low Density
Lipoproteins ou LDL) ou "mauvais" cholestérol présent dans le sang. Cette absorption
des LDL peut entraîner la réduction des taux de triglycerides (TG) et l’augmentation
des taux des lipoprotéines à haute densité (High Density Lipoproteins ou HDL) ou "bon"
cholestérol. La prise des statines est recommandée le soir ou au coucher, car l’organisme
fabrique davantage de cholestérol la nuit.
c modou sene
Ulaval_2012
10
1.3 Description de l’étude
Table 1.1 – Caractéristiques des statines
Table 1.2 – Caractéristiques pharmacocinétiques des statines
1.2.2
Les statines utilisées dans l’étude
Dans le contexte de notre étude observationnelle, nous avons utilisé les statines suivantes : l’atorvastatine (commercialisé sous Tahor, Lipitor), la fluvastatine (commercialisé sous Fractal, Lescol), la pravastatine (commercialisé sous Elisor, Vasten), la
simvastatine (commercialisé sous Zocor, Lodales, Inegy), la lovastatine (commercialisé sous Mevacor, Sandoz) et la cérivastatine (commercialisé sous Baycol) Dans les
tables 1.1 et 1.2 tirés du CPS 2010 (14), nous résumons les différentes caractéristiques
des statines de l’étude.
1.3
Description de l’étude
Dans cette partie, nous discuterons successivement du devis d’étude utilisé, la population de base pour l’étude et des outils et méthodes utilisées pour répondre aux questions
soulevées dans la problématique.
c modou sene
Ulaval_2012
11
1.3 Description de l’étude
1.3.1
Devis et population d’étude
Nous avons utilisé une étude de cohorte rétrospective longitudinale. Cette étude basée
sur des bases de données de la Régie de l’Assurance Maladie du Québec (RAMQ) s’est
déroulée entre le 1 juillet 1995 et le 31 mars 2002 (81 mois = 6 ans 9 mois). En combinant
quatre bases de données de la RAMQ via un identifiant patient unique (numéro de
matricule banalisé du bénéficiaire ou id), nous avons identifié les différentes cohortes
utilisées dans nos analyses. Ces quatre bases de données avaient les caractéristiques
suivantes :
1. PHARMA (Services pharmaceutiques) : elle contenait les informations provenant
des pharmacies. On y retrouve 37 151 897 enregistrements et 31 variables 3 . De ces
31 variables, nous avons retenu : le numéro de matricule banalisé du bénéficiaire
(id), la date de service (Date), les codes DIN (Drugs Identification Number), de
dénomination commune, de teneur, la classe AHF (American Hospital Formulary
Services), la quantité du médicament et la durée du traitement. Avec le code de
dénomination commune, nous avons identifié les différentes statines ; le code de
teneur a permis la standardisation des différentes statines utilisées. Les variables
durée du traitement et quantité du médicament sont utilisées pour la modélisation
de l’exposition.
2. MEDICA (Services médicaux) : cette base de données avait 35 201 191 enregistrements et 21 variables 4 . Les variables utilisées dans cette dernière sont notamment
le numéro de matricule du patient, la spécialité du professionnel traitant, les codes
de diagnostic et de regroupement d’actes, la date de l’acte, l’endroit où l’acte a
été rendu et la nature de l’acte.
3. COUVERTU (Couverture de la RAMQ) : cette base de données contient 366 838
observations et 4 variables 5 : le numéro d’identification (id), le code de situation,
les dates de début et de fin de couverture.
4. DEMOG (Données démographiques des individus couverts par le régime) : on
y retrouve 208 597 enregistrements et 5 variables 6 dont le numéro d’identification(id), le sexe, l’âge RAMQ (âge du patient à la date index pour les moins de
3. http://www.ramq.gouv.qc.ca/fr/donnees-statistiques/sur-demande/donnees-regie/
pages/services-pharmaceutiques.aspx
4. http://www.ramq.gouv.qc.ca/fr/donnees-statistiques/sur-demande/donnees-regie/
pages/services-medicaux-remuneres-acte.aspx
5. http://www.ramq.gouv.qc.ca/fr/donnees-statistiques/sur-demande/donnees-regie/
Pages/periodes-admissibilite-regime-public-assurance-medicaments-qc.aspx
6. http://www.ramq.gouv.qc.ca/fr/donnees-statistiques/sur-demande/donnees-regie/
Pages/fichier-inscription-personnes-assurees.aspx
c modou sene
Ulaval_2012
12
1.3 Description de l’étude
85 ans et 85 ans pour ceux âgés d’au moins 85 ans), la date de décès et la date
index RAMQ (date du premier code d’acte relatif au cancer de la vessie).
Nous avons, à l’aide du numéro de matricule des patients qui était crypté, mais unique
dans toutes les bases de données, collecté dans les bases données services pharmaceutiques, services médicaux et couverture RAMQ les informations associées aux 208 597
individus de la base de données démographique. Nous avons ensuite appliqué un algorithme de sélection permettant d’identifier parmi ces sujets, ceux vérifiant les critères
d’inclusion pour chacune des cohortes. L’algorithme de sélection est donné dans le tableau 2, page 62. Ainsi la sélection concerne les patients de 18 ans et plus ayant au
moins une résection transurétrale d’une tumeur de la vessie (RTUTV) [code de procédure 6168] et un suivi d’au moins 6 mois. Nous avons identifié 12477 patients.
Pour se limiter aux cas spécifiques au cancer de la vessie, on a sélectionné les patients
avec comme code de diagnostic dans la Classification internationale des maladies version
9 (CIM9, ou en anglais : International Statistical Classification of Diseases and Related
Health Problems, ICD9) : néoplasie (tumeur ou croissance anormale de nouveau tissu)
maligne de la vessie (188.0, 188.1, 188.2, 188.3, 188.4, 188.5, 188.6, 188.7, 188.7, 188.8
et 188.9), carcinome in - situ (233.7), néoplasie de nature non précisée à la date index
ou durant les visites post - enrôlement avec un urologue (239.4). Des 12477 patients
retenus à ce stade, nous n’en considérons que 10879.
Pour que l’analyse concerne uniquement les cas incidents, tous les patients ayant subi
une cystoscopie (code de procédure 320) dans les deux ans précédent la date index, sauf
ceux dont la cystoscopie correspond à un diagnostic d’un cancer de la vessie et ceux
dans les 3 mois avant la date de début suivi. 3498 (soit 32.15% des 10879) patients sont
exclus.
Des 7381 restants, sont exclus : 61 avaient une RTUTV ou une cystectomie partielle
(code de procédure 6113 et 6224) ou totale (code de procédure 6205 et 6338) ou un
traitement intravesical (code de procédure 325, 482 et 493) dans les deux ans avant la
date index ; 1943 patients qui avaient dans les deux ans précédent la date index un code
de facturation lié à un diagnostic d’une néoplasie maligne et 4 sur la même période qui
étaient traités soit par chimiothérapie ou radiothérapie. Après cette étape d’inclusionexclusion, il restait dans la cohorte 5373 sujets.
Parmi ces sujets, ceux ayant développé dans les six mois suivant le début du suivi un
cancer invasif nécessitant une cystectomie (433 cas) ou un traitement par chimiothérapie ou radiothérapie (163) étaient écartés. Des 4777 restants, nous avons encore écarté
1740 patients pour une couverture incomplète de médicaments pour les 12 mois avant
la date index.
On se retrouve donc avec 3037 patients pour constituer nos trois cohortes. Un autre critère d’exclusion était d’avoir une couverture incomplète de médicaments durant toute la
période de suivi. En écartant respectivement 131, 181 et 181 patients qui n’avaient pas
c modou sene
Ulaval_2012
13
1.3 Description de l’étude
une couverture complète de médicaments durant leur période de suivi, on se retrouve
avec 2905, 2856 et 2856 patients dans les cohortes récidive, progression et décès toutes
causes confondues.
1.3.2
Outils et méthodes
La constitution des trois fichiers d’analyse à partir des quatre bases de données de la
RAMQ s’est faite avec le logiciel SAS 9.3, notamment les procédures freq, format, sql
et les commandes merge, set, retain, drop, create table, select-from-where, etc.
Pour étudier l’effet d’une prise de statines sur les différentes évolutions d’un cancer
superficiel de la vessie, nous, avons utilisé un modèle de Cox avec une ou plusieurs
variables dépendantes du temps. Et pour l’ajustement des trois modèles, les logiciels
SAS 9.3 et R 2.14.0 ont été utilisés.
Tous les tests et intervalles de confiance étaient basés sur un seuil observé de α = 0.05.
Le critère utilisé pour comparer les différents modèles était le critère d’information
d’Akaike, ou AIC (AIC = 2p−2l(β), avec l(β) la fonction log-vraisemblance du modèle
et p le nombre de paramètres du modèle ; plus l’AIC est petit, meilleur est le modèle).
c modou sene
Ulaval_2012
14
Chapitre 2
Modèle semi-paramétrique en
analyse de survie
Introduction
Dans plusieurs domaines, des études sont faites dans l’optique de comparer l’effet de
divers traitements, mécanismes, procédés, etc. afin de repousser, d’accélérer ou d’estimer l’arrivée d’un événement d’intérêt. Nous citons en guise d’exemples : la panne
d’une machine, le remboursement d’un crédit, la faillite d’une entreprise, la durée d’une
période de chômage, l’évolution d’un état de santé. Ces modèles d’analyse s’intéressant
à l’évaluation du temps de réalisation d’un événement sont appelés modèles de survie.
Dans un tel contexte d’étude, les sujets entrent dans l’étude au même moment ou au
fur et à mesure que l’étude se déroule. La contribution de chaque sujet est évaluée en
fonction de son temps de suivi et celui-ci est évalué de façon périodique. En analyse
de survie, on utilise généralement soit une approche paramétrique (on connaît a priori
la loi régissant les données, une loi exponentielle, une Weibull, une log-normale par
exemple), soit une approche semi-paramétrique.
Des modèles multivariés d’analyse de survie développés pour des applications en économie (durée de vie des entreprises), en finance (l’endettement), en démographie (espérance de vie, âge au mariage, âge du premier emploi), en assurance (temps écoulé avant
la survenue d’un dommage), dans le domaine de l’industrie (panne d’un équipement industriel), en médecine (le temps écoulé avant qu’une guérison se produise, une réponse
au traitement, un décès, une progression de la maladie à un autre stade, une récidive
etc.), le plus utilisé est le modèle de Cox. Ce modèle proposé par Sir David Roxbee
Cox en 1972 permet d’une part d’introduire une dimension temporelle dans les modèles
2.1 Rappels et définitions
classiques de régression et d’autre part d’effectuer une analyse de régression basée non
pas sur les caractéristiques de base des sujets à la date index (début d’observation),
mais sur les différentes valeurs prises par ces caractéristiques au cours du temps. Le
modèle de Cox est un modèle semi-paramétrique dans le sens où il intègre une partie
non paramétrique qui ne dépend que du temps, et une partie paramétrique qui est indépendante du temps et fonction des caractéristiques des sujets. Dans la section 2.1,
nous rappellerons quelques notions essentielles en analyse de survie et la section 2.2
nous permettra d’aborder le modèle de Cox.
2.1
Rappels et définitions
Une caractéristique d’une étude de survie réside d’une part dans le fait qu’une hypothèse
de normalité n’est pas formulée à cause de la nature asymétrique de la variable de temps
de suivi (non négative) et d’autre part dans le fait que l’événement étudié est rarement
observé chez tous les sujets pendant l’étude. Si l’événement se produit au cours du suivi
pour un sujet, alors une évaluation de sa contribution au suivi est faite. En plus de cette
éventualité, une réalisation de l’un des trois scénarios suivants peut se produire sans
que l’événement ne soit observé : l’étude arrive à terme, le sujet est perdu de vue, le
suivi est arrêté au cours de l’étude. Dans les trois scénarios, la réponse par rapport à la
survenue de l’événement étudié est négative et on dit qu’il y a censure. Dans le premier
cas, on sait que la durée de survie est supérieure à la durée de l’étude, alors que pour
les deux autres, il y aura une imprécision sur l’observation de la durée de suivi ; on ne
sait pas à quel moment est survenu l’événement d’intérêt.
Pour la suite, nous adoptons les notations suivantes :
• n : nombre de sujets
• N (t) : nombre de sujets à risque au temps t
• D : nombre de temps d’évènement
• X : variable aléatoire de durée réellement observée
• T : variable aléatoire de temps de survie
• C : la variable date de censure
L’indice i indique que l’information est relative à l’individu i.
c modou sene
Ulaval_2012
16
2.1 Rappels et définitions
Figure 2.1 – Exemple : censure et troncation
2.1.1
Censure et troncation
Une observation est censurée s’il est impossible d’indiquer la valeur exacte de son temps
d’évènement, mais qu’il est possible de situer cette valeur dans un intervalle de temps.
La durée T n’est pas intégralement observée, ou tout simplement le sujet n’a pas expérimenté l’événement pendant la période d’observation. À la différence de la censure,
qui n’est pas soumise à une contrainte, la troncation s’accompagne d’au moins une
contrainte. Une observation est tronquée si la valeur de son temps d’évènement n’est
observable que dans un intervalle donné. Si l’observation est tronquée dans un sous ensemble E de R+ , alors une observation de celle-ci n’est pas possible dans le complémentaire de E sur R+
On peut parler de censure et/ou troncation à droite, à gauche et par intervalles. Une
observation i est dite censurée à droite si Ci ≤ Ti , et dans ce cas on pose δi = 0. Un
sujet est dit censuré à gauche s’il a déjà fait l’événement d’intérêt avant la date de
début d’observation sans que l’on connaisse exactement la date exacte de la survenue
de l’évènement. Une troncation à droite à Td signifie que l’évènement est observé au
plus tard à Td (il s’agit d’une limite supérieure). Une troncation à gauche à Tg signifie
que l’évènement ne peut être observé après Tg (il s’agit d’une limite inférieure).
Exemple : Considérons les 7 sujets suivants de notre étude, voir (2.1).
Les individus 4, 5 et 6 ont eu une récidive durant la période de suivi. Les sujets 6 et
7, qui en début d’observation (1 juillet 1995) n’avaient pas expérimenté une récidive,
sont tronqués à gauche à la date de début d’observation. C’est-à-dire, qu’une récidive
ne peut être observée pour ces patients qu’au-delà du 1 juillet 1995. Les patients 1 et
7, qui ont survécu jusqu’à la fin de l’étude, sont censurés à droite au 31 mars 2002. On
c modou sene
Ulaval_2012
17
2.1 Rappels et définitions
n’aura pas la date exacte d’une éventuelle récidive, mais on est certain qu’elle ne peut
se produire qu’après le 31 mars 2002. L’individu 2 est perdu de vue pendant l’étude, il
est censuré à droite à la date de perte de vue. Enfin, pour le sujet 3, on a une censure
à gauche, car celui-ci a déjà fait une récidive avant le début de l’étude, donc la date de
récidive précède le 1 juillet 1995.
2.1.2
Fonctions essentielles à une analyse de survie
En analyse de durée de vie, cinq fonctions essentielles sont généralement utilisées. Dans
cette section, nous donnerons d’abord une définition, une notation et quelques propriétés
pour chacune de ces fonctions et en second lieu nous donnerons les différents liens entre
ces fonctions.
La variable T définie ci-haut étant une durée de vie, elle est continue et prend ses valeurs
dans R+ .
1. Fonction de répartition La fonction de répartition, notée F (t), représente la
probabilité de faire l’événement au plus tard à l’instant t :
F (t) = P [T ≤ t]
pour
tout t ≥ 0,
F est monotone non décroissante, et lim+ F (t) = 0
(2.1)
et lim F (t) = 1. Ret→+∞
t→0
marque : Pout tout t, on a : 0 ≤ F (t) ≤ 1.
2. Fonction de densité La fonction de densité f est telle que
f (t) =
dF (t)
P [T ∈ (t, t + ∆)]
= lim
,
∆→0
dt
∆
Z
(2.2)
t
⇔ F (t) =
f (x)dx.
0
Puisque que F (·) est non décroissante, sa dérivée f (·) est positive et, de plus,
R +∞
f (x)dx = 1.
0
3. Fonction de survie : Pour un temps t donné, la fonction de survie représente le
complémentaire de la fonction de répartition, c’est-à-dire la probabilité de ne pas
faire l’évènement d’intérêt (survivre) jusqu’à l’instant t :
S(t) = P [T > t]
= 1 − F (t) = 1 −
Z t
f (x)dx
(2.3)
0
=
Z +∞
0
c modou sene
f (x)dx −
Z t
f (x)dx =
0
Ulaval_2012
Z +∞
f (x)dx.
t
18
2.2 Le modèle de risques proportionnels de Cox
On a que : S(t) ∈ [0; 1], S(·) est monotone et non croissante. Enfin lim+ S(t) = 1
t→0
et lim S(t) = 0.
t→+∞
4. Fonction de risque et fonction de risque cumulé
La fonction de risque à l’instant t, que nous notons h(t), représente le risque
instantané de faire l’événement juste après t, sachant qu’on a survécu jusqu’à t ;
P [T ∈ (t, t + ∆t)|T > t]
f (t)
=
∆t→0
∆t
S(t)
dS(t)
d ln S(t)
1
=−
.
= −
S(t)
dt
dt
h(t) =
lim
(2.4)
Puisque S(t) ∈ [0; 1], alors − ln S(t) est positif, donc h(t) est positive ∀t ∈ R+ .
La fonction de risque cumulé H(t) est obtenue par la formule suivante :
H(t) =
Z t
(2.5)
h(x)dx.
0
On sait que F (t) = 1 − S(t) =
h(t) =
Rt
0
f (x)dx
⇔
f (t)
. Donc on peut déduire que
S(t)
(
dS(t)
−
dt
f (t)
h(t) =
=
S(t)
S(t)
⇒ H(t) =
Z t
0
h(x)dx =
Z t
0
(
dF (t)
dS(t)
= −
, de plus
dt
dt
)
=−
d ln S(t)
dt
)
h
it
d ln S(x)
−
dx = − ln S(x) = − ln S(t)
0
dx
H(t) = − ln S(t)
2.2
f (t) =
⇔
S(t) = exp{−H(t)}
f (t) = h(t)S(t)
⇔
f (t) = h(t) exp{−H(t)}
F (t) = 1 − S(t)
⇔
F (t) = 1 − exp{−H(t)}.
(2.6)
Le modèle de risques proportionnels de Cox
C’est un modèle qui permet la prise en compte simultanée de plusieurs variables pour
expliquer la survenue d’un événement, sans faire d’hypothèse sur la forme des fonctions
de survie.
c modou sene
Ulaval_2012
19
2.2 Le modèle de risques proportionnels de Cox
2.2.1
Le modèle
Soit Z = (Z1 , Z2 , . . . , Zp ) le vecteur des covariables considérées dans notre modèle de
Cox. À chacune de ces p variables Zk , nous associons un coefficient βk , k = 1, 2, . . . , p.
À la différence des autres modèles de régression, le modèle de Cox est un modèle où la
modélisation de l’effet des variables exogènes ne porte pas sur la valeur de la variable
aléatoire de durée de vie, mais plutôt sur la valeur de la fonction de risque. Connaissant
alors les caractéristiques du vecteur Z, ce modèle nous permet d’estimer le risque à
tout temps h(t | Z). Si nous notons h0 (t) la partie non paramétrique, appelée aussi
0
fonction de risque de base (elle est identique pour tous les sujets), et β Z la partie
paramétrique, alors pour lier ces deux parties, on utilise une fonction de lien que nous
notons `(·). Alors pour tout t ≥ 0,
h(t | Z) = h0 (t) × `(β, Z).
(2.7)
Du fait que le modèle de Cox s’intéresse au risque et que celui-ci doit être positif pour
toute valeur possible de Z, alors la fonction de lien `(·) doit être définie de R vers R+ .
Dans un modèle de Cox, on utilise généralement une fonction de lien exponentielle, soit
`(·) = exp(·).
Avec un lien exponentiel, on peut réécrire l’équation (2.7) ainsi :
h(t | Z1 , Z2 , . . . , Zp ) = h0 (t) exp {β1 Z1 + β2 Z2 + · · · + βp Zp }
(2.8)
Pour la suite, la fonction de lien exponentiel sera utilisée.
2.2.2
Rapport de risques, hypothèses et interprétation des coefficients du modèle
Considérons deux individus A et B pour lesquels on ZA et ZB , respectivement. Comparer
le risque de l’individu A de faire l’événement d’intérêt par rapport à celui du sujet B,
h(t|Z=ZA )
revient à déterminer le rapport h(t|Z=Z
:
B)
0
0
0
h(t | Z = ZA )
eβ ZA
h0 (t)eβ ZA
{β (ZA −ZB )}
=
=
e
.
=
0
0
h(t | Z = ZB )
h0 (t)eβ ZB
eβ ZB
c modou sene
Ulaval_2012
(2.9)
20
2.2 Le modèle de risques proportionnels de Cox
Remarques : Si les vecteurs ZA et ZB ont les mêmes valeurs pour les toutes les variables
du vecteur Z sauf pour la variable Zk , avec k ∈ 1, 2, . . . , p, alors
e{β
0
(ZA −ZB )}
= e{β1 (Z1,A −Z1,B )+β2 (Z2,A −Z2,B )+···+βk (Zk,A −Zk,B )+···+βp (Zp,A −Zp,B )}
= e{βk (Zk,A −Zk,B )} .
• Si Zk est dichotomique (exemple traitement Zk = 1, contrôle Zk = 0) , alors
l’égalité (2.9) devient
h(t | Zk = 1)
= e{βk (1−0} = eβk ,
h(t | Zk = 0)
(2.10)
où eβk représente alors le risque de faire l’événement pour ceux qui reçoivent le
traitement par rapport à ceux qui ne le reçoivent pas. Si eβk < 1 (βk < 0), alors on
peut dire que le traitement a un effet protecteur. Si par contre eβk > 1 (βk > 0),
alors le risque est plus important si on reçoit le traitement que si on ne le reçoit
pas. Enfin pour le cas eβk = 1 (βk = 0), on dit qu’il n’y a pas de différence entre
le groupe traitement et le groupe contrôle.
• Si Zk est catégorique avec m modalités (m > 2), on peut créer (m -1) variables
binaires (variables indicatrices) à partir des m -1 modalités, et la modalité
restante sera la modalité de référence.
Exemple : Soit Zk , le stade de la tumeur (0, I, II, III, IV). Si nous considérons le
stade 0 comme référence, alors nous aurons quatre variables, une(pour chacune des
1 ; si Zk = j
modalités (I, II, III, IV). Ainsi avec j = I, II, III, IV : Zk,j =
0 ; sinon
Pour un patient qui a un stade I, on aura Zk ≡ (Zk,I , Zk,II , Zk,III , Zk,IV ) =
(1, 0, 0, 0) et pour un patient qui a un stade 0, on a Zk
≡
(Zk,I , Zk,II , Zk,III , Zk,IV ) = (0, 0, 0, 0). Pour comparer le risque des patients
de stade I par rapport à ceux de stade 0 (référence), on calcule
h(t | Zk = I)
= e{1×βk,I +0×βk,II +0×βk,III +0×βk,IV −(0×βk,I +0×βk,II +0×βk,III +0×βk,IV )}
h(t | Zk = 0)
= eβk,I .
(2.11)
Pour comparer le risque des patients de stade IV par rapport à ceux de stade II,
on a
h(t | Zk = IV )
= e{0×βk,I +0×βk,II +0×βk,III +1×βk,IV −(0×βk,I +1×βk,II +0×βk,III +0×βk,IV )}
h(t | Zk = II)
= eβk,IV −βk,II .
(2.12)
c modou sene
Ulaval_2012
21
2.2 Le modèle de risques proportionnels de Cox
• Si Zk est une variable continue, alors on peut l’utiliser comme telle ou la transformer à l’aide d’un recodage en une variable catégorique en k classes (k ≥ 2).
Dans le cas où la variable est traitée de façon continue, alors on s’intéresse à l’effet d’une variation unitaire de celle-ci. En d’autres termes si on a une variation
(hausse, baisse) de Zk d’une unité, quel sera l’effet de celle-ci sur le risque de faire
l’événement ? Si Zk passe d’une valeur Ω à Ω + 1, alors on aura
h(t | Zk = Ω + 1)
= e{βk (Ω+1)−βk Ω} = eβk .
h(t | Zk = Ω)
(2.13)
La validité du modèle de Cox sous-tend la vérification de deux hypothèses :
Hypothèse de proportionnalité : Cette hypothèse stipule que le risque instantané
ne dépend pas du temps (modèle à risques proportionnels). Cela signifie que le rapport
de risques instantanés pour deux sujets i et j ayant comme vecteurs de covariables Zi
et Zj ne dépend que de ces vecteurs et non du temps {voir (2.9), (2.10), (2.11), (2.12),
(2.13)}.
Hypothèse de log-linéarité : Il existe une relation log-linéaire entre la fonction de
risque instantané h(t | Z) et les covariables du modèle. En d’autres termes, si
h(t | Z) = h0 (t) exp {β1 Z1 + β2 Z2 + · · · + βp Zp },
alors
log {h(t | Z)} = log {h0 (t) exp (β1 Z1 + β2 Z2 + · · · + βp Zp )}
(2.14)
= log {h0 (t)} + β1 Z1 + β2 Z2 + · · · + βp Zp
= β0 + β1 Z1 + β2 Z2 + · · · + βp Zp ,
avec β0 = log {h0 (t)}. En d’autres termes, cela signifie également qu’il existe une forme
exponentielle du rapport des risques instantanés (hazard ratio HR) (voir (2.9))
2.2.3
Modèle de Cox avec covariables dépendant du temps
d’évènement
Pour un modèle de Cox, un facteur qui varie au cours du suivi doit être considéré
variable qui dépend du temps. Ce changement peut, selon la situation, s’opérer de
manière unique et généralement irréversible tout au long de son suivi (une cystectomie
totale, la première récidive), ou de façon multiple (exemple, la récidive des tumeurs, la
progression de la tumeur, la prise d’une statine, etc.). Dans la situation où le modèle
présente au moins une covariable dépendante du temps, alors certaines hypothèses du
c modou sene
Ulaval_2012
22
2.2 Le modèle de risques proportionnels de Cox
modèle avec covariables indépendantes du temps vont changer. Ainsi dans (2.7), la
fonction de lien f (·), qui était indépendante du temps, deviendra dépendante du temps
dans un modèle de Cox présentant des covariables qui varient avec le temps, car le
vecteur de covariables Z va varier en fonction du temps. Si on désigne par Z(t) ce
nouveau vecteur qui est fonction du temps, alors pour toute observation i, on peut
associer le vecteur (ti , δi , Zi (u), 0 ≤ u ≤ t) et la fonction de risque à tout temps peut
s’écrire
0
h{t | Z(u), 0 ≤ u ≤ t} = h0 (t) exp (β Z(t))
= h0 (t) exp
(p
1
X
βk Z k +
k=1
(2.15)
p2
X
)
β` Z` (t) ;
`=1
où p1 + p2 = p (le nombre de paramètres du modèle), βk est le paramètre associé à la
covariable fixe Zk et β` le paramètre associé à la covariable dépendante du temps Z` (t).
Pour ce modèle, le rapport de risques entre deux individus A et B dépend du temps et
il est évalué à tout instant t. Celui-ci peut se déduire des équations (2.9) et (2.15) par
h{t | Z = ZA (t)}
= exp [β`,A {Zl,A (t) − Z`,B (t)}].
h{t | Z = ZB (t)}
(2.16)
De cette égalité, on peut noter que si au temps t∗1 les sujets A et B sont tous dans le
groupe traitement (Zk,A (t∗1 ) = Zk,B (t∗1 ) = 1 ) et qu’au temps t∗2 , B cesse le traitement
alors que A reste sous traitement (Zk,A (t∗1 ) = 1 et Zk,B (t∗1 ) = 0 ), alors les rapports de
risques aux temps t∗1 et t∗2 pour ces deux individus ne seront pas identiques. Dans la
première situation on aura
h{t | Z = ZA (t∗1 )}
0
= exp {β (Zk,A (t∗1 ) − Zk,B (t∗1 ))} = 1,
h{t | Z = ZB (t∗1 )}
alors que dans la seconde, on aura
h(t | Z = ZA (t∗2 ))
= exp {βk (1 − 0)} = exp (βk ),
h(t | Z = ZB (t∗2 ))
d’où le rapport de risques instantané qui dépend du temps.
2.2.4
Estimations et inférences
L’inférence basée sur un modèle de Cox sous-tend l’estimation de certains paramètres.
Pour une inférence, nous nous intéresserons le plus souvent à la fonction de survie, à la
fonction de risque de base, à la vraisemblance (2.17) et aux coefficients du modèle. La
c modou sene
Ulaval_2012
23
2.2 Le modèle de risques proportionnels de Cox
démarche est la même en présence ou non d’ex æquo (même temps d’événement) ou
l’existence ou non de covariables qui varient avec le temps. La seule chose qui change
est l’expression de la fonction de vraisemblance. Ce changement affecte les statistiques,
les intervalles de confiances, les critères de jugement (AIC par exemple) car les seuils
et valeurs associées à ces derniers sont fonction de la vraisemblance du modèle. Pour la
suite, nous supposons avoir un modèle de Cox avec des covariables fonction du temps.
2.2.4.1
Estimation des coefficients β par max de vraisemblance
Nous considérons que δi = 1 si l’événement est observé pour le ième individu et δi = 0
s’il y a censure. Si de plus nous supposons que la loi de la censure est indépendante de
celle de la survie, alors la fonction de vraisemblance, dénotée L("Likelihood"), s’écrit
L(β) =
=
n n
Y
i oδ i n
h
P T ∗ ∈ [ti , ti + ∆t[β
i=1
n n
Y
oδi n
f (ti , β)
o1−δi
S(ti , β)
P [T ti |β]
o1−δi
(2.17)
,
i=1
où f (·) et S(·) sont respectivement les fonctions de densité et de survie. Pour estimer
et faire des inférences sur les coefficients β, on utilise la fonction de vraisemblance
définie ci-haut. En désignant par R(t∗i ) l’ensemble des individus à risque au temps (t∗i ),
hi (ti ) et Si (ti ) les fonctions de risque et de survie pour l’individu i au temps (t∗i ), alors
hi (t∗ )
la probabilité conditionnelle X i ∗ permet d’obtenir la contribution du temps
hk (ti )
k∈R(t∗i )
d’événement ti à la fonction de vraisemblance du modèle. Ainsi, on obtient
δi
L(β) =
D
Y
hi (t∗i )
X
X
hk (t∗ )
∗
i=1
i
k∈R(t∗i )
δi
hk (t∗i ) Si (t∗i )
k∈R(ti )
Cox proposa une vraisemblance partielle (Partial Likelihood PL). Il est prouvé que
les inférences sur β faites avec cette dernière sont bien valides et efficaces. L’expression
c modou sene
Ulaval_2012
24
2.2 Le modèle de risques proportionnels de Cox
de fonction de vraisemblance partielle de Cox est donnée par
δi
P L(β) =
D
Y
hi (t∗i )
X
∗
hk (t )
i=1
=
D
Y
i=1
i
k∈R(t∗i )
=
D
Y
i=1
eβ
n
X
0
eβ
0
Z(i)
eβ
X
0
Zk
k∈R(t∗i )
Z(i)
(2.18)
,
0
Yk (t∗i )eβ Zk
k=1
avec Z(i) le vecteur des covariables du sujet qui a fait l’événement à t∗i , temps où l’un
des D événements est observé.
De l’équation (2.18), on peut déduire la log vraisemblance partielle l(β), la fonction de
score U (β) et la matrice d’information I(β)
l(β) = log P L(β)
=
p
D X
X
βk Z(i),k −
i=1 k=1
⇒ Uk (β) =
D
X
log
p
X
Yj (t∗i ) exp
j=1
i=1
βk Zj,k
(2.19)
k=1
∂l(β)
∂βk
n
X
=
n
X
D
X
Z(i),k
i=1
−
0
Zj,k Yj (t∗i ) exp β Zj
j=1
n
X
Yj (t∗i ) exp β
0
Zj
,
(2.20)
j=1
k = 1, 2, . . . , p,
⇒ Ik,l (β) = −
∂ 2 l(β)
,
∂βk ∂βl
(2.21)
k, l ∈ {1, 2, . . . , p}. L’équation (2.21) donne l’élément en position (k, l) de la matrice
d’information qui est une matrice carrée p × p.
Estimation des coefficients : Pour estimer un coefficient βk , on maximise la vraisemblance partielle (2.18) à l’aide de l’algorithme de Newton -Raphson. Cet algob soit βb(0) ,
rithme fonctionne sous le principe suivant : on fixe une valeur initiale pour β,
puis on calcule successivement à l’aide de l’équation (2.22) βb(1) , . . ., βb(m) jusqu’à ce
que l’algorithme converge, c’est-à-dire (βb(m) - βb(m−1) ) soit très petit (atteint un seuil de
convergence fixé).
βb(n) = βb(n−1) + I −1 (βb(n−1) )U (βb(n−1) ).
(2.22)
c modou sene
Ulaval_2012
25
2.2 Le modèle de risques proportionnels de Cox
2.2.4.2
Estimation de h0 (t) et S(t)
Une fois β estimé, il reste à estimer la fonction de risque de base h0 (t). On peut estimer
b (t) à l’aide de l’equation (2.23), ensuite on peut utiliser
le risque de base instantané h
0
c (t). Et de l’équation (2.6)
l’estimateur de Breslow dans l’équation (2.24) pour estimer H
0
c (t)}, et
nous déduisons l’expression de la fonction de survie de base Sb0 (t) = exp{−H
0
0
exp β Zj
b
b
enfin, celle de la survie S(t | Z) = [S0 (t)]
di
0
i∈R(t) exp (β Zj )
b (t) = P
h
0
c (t) =
⇒H
0
X
i:t∗i ≤t
X
di
0
exp β Zj
(2.23)
(2.24)
j∈R(t)
2.2.4.3
Tests et intervalles de confiance
Pour tester si un coefficient β est égal à une certaine valeur (H0 : β = β0 ), nous pouvons
0
utiliser soit le test basé sur la statistique de Wald {χ2W ald = (βb − β0 ) I(β0 )(βb − β0 )}, du
0
b −
Score {χ2Score = U (β0 )I −1 (β0 )U (β0 )} ou du rapport de vraisemblances {Λ = 2[l(β)
l(β0 )]}. Nous aurons une évidence contre l’hypothèse nulle si le seuil observé (P [χ2d >
Tobs ])est plus petit que notre seuil de test α, où Tobs est la valeur obtenue avec χ2W ald ,
χ2Score ou Λ et d la dimension de β.
2.2.5
Ajustement d’un modèle de Cox
2.2.5.1
Validation a posteriori des hypothèses du modèle
2.2.5.1.1 Forme fonctionnelle Pour vérifier si une variable continue Zk est sous
une bonne forme fonctionnelle dans le modèle, nous utiliserons les résidus de martingale
et la somme cumulée de ces résidus. La somme cumulée des résidus de martingale permet
d’évaluer l’écart entre les estimés du modèle et les vraies valeurs. Si une différence
significative est notée, alors on peut extraire les résidus de martingale avec la fonction
coxph() (martingale dans residual) de R ou PHREG de SAS (RESMART dans
Output), puis tracer la courbe de ces résidus en fonction de Zk . L’allure de cette
dernière nous indiquera une transformation de la variable Zk (voir les codes SAS des
c modou sene
Ulaval_2012
26
2.2 Le modèle de risques proportionnels de Cox
tables 10, 11 et 12 pages 66-68).
2.2.5.1.2 Hypothèse de proportionnalité Pour la vérification a posteriori de
l’hypothèse que la proportionnalité est valable pour la variable Zk , nous pouvons utiliser
le graphique de log{−log(S)} en fonction du temps, un terme d’interaction avec le temps
pour Zk , le processus de score standardisé ou les résidus de Schoenfeld standardisés.
Supposons que nous désirons vérifier que la variable catégorique Zk avec m niveaux
vérifie l’hypothèse de proportionnalité. Pour cela, nous considérons deux individus i et
i0 avec respectivement comme vecteur de covariables Zk,i et Zk,i0 et qui ne sont pas dans
un même groupe parmi les groupes de Zk . On peut alors démontrer que la différence
des log des fonctions de risque cumulé pour ces deux individus est constante dans le
temps :
log {H(t | Z)} = log (− log {S(t | Z)})
0
log {H(t | Z)} = log {H0 (t) exp(β Z)}
0
0
log {H(t | Zi )} − log {H(t | Zi0 )} = log H0 (t) + β Zi − log H0 (t) − β Zi0
0
= β Zi − Zi0 .
(2.25)
c |Z )
Si l’hypothèse de proportionnalité est raisonnable, alors les m graphes log H(t
p
p = 1, · · · , m correspondant à Zk doivent être parallèles verticalement. Or de
c
b | Z ), donc
l’équation (2.6) nous
pouvons déduire
que H(t
| Zp ) = - log S(t
p
c
b
log H(t | Zp ) = log − log {S(t | Z)} . Cela revient alors à vérifier si les m graphes de
b | Z)} en fonction du temps sont parallèles verticalement. C’est-à-dire
log − log {S(t
connaissant l’une d’entre elles, on peut approximativement obtenir les autres par une
translation verticale. Avec la procédure PHREG de SAS, on peut dans baseline
créer une base de données avec l’option Output dans laquelle se trouve LLS, puis
tracer les graphes LLS en fonction du temps (voir les codes SAS des tables 10, 11 et
12 pages 66-68).
Les résidus de Schoenfeld, proposé par Schoenfeld (1982)(52, pp. 239-241) puis modifiés
par Grambsch et Therneau (1994)(58, pp. 515-526) permettent de vérifier l’hypothèse
de proportionnalité pour un modèle de Cox. Ils représentent la contribution du
ième événement sur la fonction de score. Les résidus de Schoenfled standardisés que
Grambsch et Therneau (1994) proposent ont une meilleure puissance de diagnostic que
les résidus de Schoenfled.
Le processus du score fonctionne avec le même principe que la somme cumulée des
résidus de martingale (l’option ASSES, PH de la procédure PHREG de SAS).
Pour les résidus de Schoenfeld, si l’hypothèse de proportionnalité est raisonnable, alors
on doit être en mesure de placer une droite de pente nulle (ligne horizontale) dans la
bande de confiance.
c modou sene
Ulaval_2012
27
2.2 Le modèle de risques proportionnels de Cox
2.2.5.1.3 Modèle stratifié Si la variable Zk viole l’hypothèse de proportionnalité,
alors on peut vérifier si une stratification avec cette dernière est adéquate. Pour cela
0
nous testons H0 : h(t | Zk ) = h0,k (t)exp(β Z) (cette hypothèse signifie qu’on a le même
vecteur de coefficients β pour toutes les strates, mais un risque de base pour chacune
des catégories de la variable Zk ).
2.2.5.2
Vérification de l’ajustement du modèle
Pour vérifier d’éventuelles mauvaises spécifications de notre modèle ou la présence de
données aberrantes, nous utilisons les résidus de déviance. Et pour la vérification de
l’existence d’individus qui ont une influence importante sur les estimés des coefficients,
donc du risque, nous utilisons les DFBETA ou résidus du score standardisés. Les résidus
de déviance suivent approximativement une loi normale standard. Donc les observations
ayant des résidus en dehors de ]-3,3[ posent problème.
Pour vérifier si la j ème observation est influente, on calcule le résidu de score standardisé
(noté DFBETA) associé. Belsley, Kuh et Welsch (1980) (7) suggèrent la règle de décision
suivante : tout individu dont la valeur absolue du DFBETA est plus grande que √2n serait
potentiellement influent (voir les codes SAS des tables 10, 11 et 12 pages 66-68).
c modou sene
Ulaval_2012
28
Deuxième partie
Analyses et résultats
29
Chapitre 3
Variables et analyse descriptive
Dans la section 3.1 nous donnerons les différentes définitions des variables utilisées dans
nos trois modèles. Les sections 3.2 et 3.3 nous permettrons respectivement d’aborder
les différentes approches que nous avons utilisées pour la modélisation de la variable
statine et de faire un résumé bref des caractéristiques de nos patients pour les trois
issues.
3.1
3.1.1
Les variables
Les variables d’issue et leurs définitions
Nous avons trois issues : la récidive, la progression et le décès. Une récidive était définie
comme une facturation correspondant au code de procédure 6168 (RTUTV) et faite par
un urologue. Dans le cadre de cette étude, on n’a pas fait de différence entre récidive
locale et récidive à un autre site. La progression, qui correspond à l’extension de la
tumeur vers le muscle vésical, était définie comme la présence d’un code de facturation
6205 (une cystectomie totale), code qui est utilisé pour les cancers invasifs ou les cas de
progression des tumeurs vers le muscle. Enfin pour le décès, on s’est intéressé au décès
toutes causes confondues. Du fait qu’on n’avait pas les dates exactes de décès (seul le
mois de décès était donné), nous avons considéré comme date de décès pour toutes les
cohortes le dernier jour du mois de décès.
3.1 Les variables
3.1.2
Les covariables retenues
Nous avons retenu comme variables potentiellement explicatives :
• male, le sexe du patient (1 pour homme et 0 pour femme) ;
• âge, l’âge-RAMQ du patient en années. Il correspond à l’âge en début de suivi.
Pour ceux qui avaient 85 ans et plus, leur âge-RAMQ était 85 ans ;
• nbr_hosp, le nombre d’hospitalisations dans les 12 mois avant la date de début
d’observation,
• cds, le Chronic Disease Score (CDS) qui est une mesure globale de comorbidité.
Il est basé sur l’utilisation des médicaments, il est calculé à partir des données
pharmaceutiques. L’algorithme de Von Korff (61), validé sur les données de la
RAMQ a été utilisé ;
• cystecPart et cystec, pour cystectomie partielle et totale respectivement (ablation totale ou partielle de la vessie). Ces variables sont associées à une progression ;
• intravex, pour traitement intravésical. Ce traitement adjuvant est une variable
retenue ici comme proxy de l’aggrestivité tumorale ;
• RTUTV, pour résection transurétrale de tumeur vésicale (RTUTV). Elle est
synonyme d’une récidive pour une résection subséquente ;
• exposition aux statines. C’est une variable qui dépend du temps. Sa modélisation sera exposée à la section 3.2.
Les variables intravex, cystecPart, cystec et RTUTV sont des variables qui dépendent du temps. À chaque temps d’événement t∗ , ces variables prennent la valeur 1
si l’intervention est déjà observée, 0 sinon.
Pour l’issue récidive, nous avons utilisé les variables male, âge et intravex. Pour la
progression, en plus des variables sexe et âge, nous avons utilisé la récidive (RTUTV)
comme variable dépendante du temps. Pour l’issue décès, on a ajouté aux variables
de l’issue progression, le CDS, le nbr_hosp et les variables relatives à une progression
(cystecPart et cystec).
c modou sene
Ulaval_2012
31
3.2 Modélisation de la variable statine
3.2
Modélisation de la variable statine
Pour modéliser l’effet d’une exposition aux statines sur l’évolution d’un cancer superficiel de la vessie, nous avons d’abord standardisé les quantités prises pour les six statines
de l’étude. Ainsi selon l’équivalence utilisée dans l’article de Fradet et al (28),
1mg(Atorvastatine) = 0.1mg(Cérivastatine) = 2mg(Simvastatine)
= 4mg(Lovastatine) = 6mg(P ravastatine) = 8mg(F luvastatine). (3.1)
Nous avons ensuite identifié les codes associés aux différentes statines dans la base de
données médicaments. Ainsi, on a atorvastatine (46355 et 47232), fluvastatine (46240
et 47083), lovastatine (45500), pravastatine (45570 et 47169), simvastatine (45564 et
46584), cérivastatine (46425 et 47272). Pour calculer la quantité de principes actifs
dans chaque quantité prise de statine, nous avons identifié les codes pour les différentes
teneurs (104 pour 0.4 mg, 760 pour 0.8 mg, 5612 pour 0.2 mg, 6710 pour 0.3 mg, 21106
pour 5 mg, 24400 pour 10 mg, 28426 pour 20 mg,34160 pour 40 mg, et 40199 pour
80 mg). Nous avons ensuite déterminé le nombre de comprimés par prescription en
divisant la variable quantité par 1000. Avec cette information, la quantité de principes
actifs dans chaque prescription a été calculée en multipliant le nombre de comprimés
par la teneur. À l’aide des équivalences de la formule (3.1), nous avons standardisé les
différentes quantités de principes actifs en prenant comme référence 1 mg d’atorvastatine. Ces quantités sont ensuite utilisées pour constituer une variable pilulier qui
permettait d’extraire pour chaque jour, la quantité de principes actifs utilisée. À chacun des 2856 patients de la cohorte progression par exemple, cette variable associe 2500
enregistrements. Si au jour j le sujet n’a pas une prise d’une statine, alors la variable
pilulier avait comme valeur zéro. Cette variable nous permettra plus tard de calculer
le cumul de la quantité de principes actifs dans une statine soit sur toute la période
de suivi, soit dans un intervalle de temps bien déterminé. Nous avons ensuite utilisé
différentes approches pour la modélisation de la variable statine. Nous avons exploré
respectivement le cumul, la densité, les moyennes mobiles et la demi-vie.
Comparativement à une modélisation dichotomique de la variable d’exposition, nous
avons essayé différentes approches. Nous avons d’abord calculé les quantités cumulées
de principes actifs dans les différentes statines utilisées. Avec ce cumul dans le temps,
on pouvait être tenté par une modélisation se basant sur ces cumuls. Mais puisqu’à
un temps d’événement donnée, on pouvait avoir deux patients avec les mêmes cumuls,
mais pas avec les mêmes durées d’exposition (la variable cumul pour ceux qui ont au
moins une statine durant la période de suivi avait l’allure d’une fonction en escalier
non décroissante. Dès que le patient atteint un certain seuil pour son cumul, même s’il
cesse de prendre des statines, son niveau d’exposition reste constant, peu importe le
c modou sene
Ulaval_2012
32
3.2 Modélisation de la variable statine
délai du suivi. Sur une même période deux sujets pouvaient avoir le même cumul, mais
l’un est exposé modérement aux statines sur une longue période et l’autre est exposé
chroniquement mais sur une courte période), nous avons intégré la notion de durée
dans la définition de la variable statine. Ainsi, nous avons essayé plusiieurs approches
de modélisation, décrites ci-après.
3.2.1
L’approche densité
L’avantage de cette méthode par rapport à celle du cumul est qu’elle permet de prendre
en compte simultanément la quantité de principes actifs de statines cumulée et la durée
d’exposition aux statines. Ainsi la nouvelle approche permet de différencier ceux qui
prennent occasionnellement des statines de ceux qui en prennent de façon régulière.
D’autre part, elle permet de différencier, à l’aide des durées d’exposition, deux patients
ayant cumulé les mêmes quantités de principes actifs, mais à des périodes différentes.
Par exemple pour deux patients ayant cumulé la même quantité de principes actifs, celui
qui a la durée d’exposition la plus longue aura une densité d’exposition moins élevée.
Pour ceux qui ont une prise occasionnelle, plus la durée de survie est longue, plus la
densité tend vers la valeur nulle correspondant à ceux qui ne sont pas sous statine. Cette
variable densité est obtenue pour un temps t∗ donné en divisant la quantité cumulée
de principes actifs contenue dans les statines depuis le début du suivi par le temps de
suivi correspondant :
∗
Statine(densité) (t ) =
Pt∗
t=index
∆t
q(t)
,
(3.2)
avec q(t) la quantité standardisée de principes actifs prise quotidiennement et ∆t =
t∗ − tinitial la durée entre la date de la prise de la première statine (tinitial ) et la date t∗
considérée.
Cette méthode, bien que corrigeant certaines faiblesses de la méthode du cumul, présente certainement des limites. Un patient ayant cumulé une faible quantité de statine,
mais sur une longue période, sera associé à une valeur de la variable densité très faible
(tend vers zéro, mais ne l’atteindra jamais). Pour tenir compte de ces limites, nous avons
essayé de corriger cet effet résiduel en fixant divers seuils de densité en dessous duquel
le patient est considéré dans le groupe de non-consommateurs de statine. L’influence
de cette correction sur le risque relatif instantané pour certaines issues nous pousse à
explorer des modèles à courte mémoire. Ainsi seules les quantités de médicaments des
trente derniers jours sont considérées pour les raisons suivantes. La première est qu’en
moyenne, la durée des périodes de renouvellement était de 30 jours. D’autre part, Pan et
al (46) ont montré qu’une statine administrée avant le pontage aorto-coronaire réduisait
c modou sene
Ulaval_2012
33
3.2 Modélisation de la variable statine
le risque de décès toutes causes confondues jusqu’au 30ème jour postopératoire. En chirurgie non cardiaque, Kartai et al (36), ainsi que Ward et al (62) ont travaillé sur l’effet
des statines sur les trente (30) jours préopératoires. Dans d’autres domaines, l’efficacité
d’un traitement avec une statine est évaluée entre la quatrième et la huitième semaine
suivant la prise. Et enfin selon le site Pharmacorama (5), la concentration plasmatique
d’un médicament
C(t) = C0 e−kt ,
(3.3)
(avec C(t), C0 et k respectivement la concentration plasmatique à l’instant t, la concentration initiale et la constante d’élimination) dépend essentiellement en cas d’administration répétée de trois facteurs : la dose administrée, la fréquence d’administration et
la demi-vie. Et puisque la durée d’efficacité du médicament est liée à la vitesse d’élimination du médicament, une approche tenant compte de ces différents points serait plus
adéquate que celle de type densité évoquée ci - haut. Nous avons alors considéré une
période de trente jours d’abord comme notre période de référence et ensuite nous avons
étudié l’effet de la longueur de cette période de base sur le risque relatif instantané.
Avec cette période d’exposition de base commune à tous les sujets, nous avons introduit
la notion de pondération pour tenir compte de l’élimination progressive du médicament
dans l’organisme. Car nous estimons que les doses de statines du premier, du douzième,
du vingt-cinquième et du vingt-neuvième jour n’auront pas les mêmes effets au trentième jour. Ces différentes pondérations sont basées soit sur les moyennes mobiles, soit
sur la demi-vie d’efficacité des statines. La notion de moyenne mobile, utilisée dans
beaucoup de domaines (finance, hydrologie, etc.) a servi également dans le domaine de
la santé. Ainsi Abrahamovicz et al (10) ont utilisé les notions de pondération à allure
exponentielle pour étudier l’impact de l’exposition aux benzodiazépines sur le risque de
blessures. Harris et al (31) ont utilisé des moyennes mobiles centrées de base trois jours
pour estimer les quantités de progestérone et de cortisol. Quant à la demi-vie, Kroll et
al (38) et Duggal et al (25) l’ont utilisée dans leurs travaux scientifiques.
3.2.2
Moyennes mobiles
Avec cette méthode, nous avons obtenu sur une période de d jours (30 jours par exemple)
et à tout instant t, les coefficients de pondération de trois façons différentes : avec les
moyennes mobiles arithmétiques M M Ad (t) (même poids pour tous les jours considérés),
avec les moyennes mobiles pondérées M M Pd (t) (un coefficient de pondération qui croît
de façon linéaire entre le premier jour et le dernier jour) et avec les moyennes mobiles
exponentielles M M Ed (t) (on accorde la presque totalité des poids aux derniers jours).
c modou sene
Ulaval_2012
34
3.2 Modélisation de la variable statine
Nous donnons ci - dessous les différentes formules correspondant à ces moyennes :
Statine(M M Ad ) (t) =
Statine(M M Pd ) (t) =
d
X
αi Xi (t),
i=1
Pd
i=1 βi Xi (t)
,
Pd
i=1 βi
(3.4)
(3.5)
Statine(M M Ed ) (t) = δXi (t) + [1 − δ]Xi (t − 1)
(3.6)
2
n
Xd (t) + ψXd−1 (t) + ψ Xd−2 (t) + · · · + ψ Xd−n (t)
=
lim
,
2 + · · · + ψn
1
+
ψ
+
ψ
n→∞
avec d : la longueur de la période ; Xi (t) la quantité de statine prise le jour i ;
2
.
αi = d1 ∀i ; βi = di ∀i, ψ = 1 − δ = 1 − d+1
3.2.3
Demi-vie
Une fois la longueur de la période fixée (par exemple ici 30 jours), on est mieux en
mesure de jouer sur les valeurs des coefficients (ils sont tous fonction de cette période).
Nous avons exploré la notion de demi-vie qui nous permettait d’agir simultanément sur
la période et sur la valeur des poids utilisés pour la pondération. Nous avons travaillé
toujours sur une période de 30 jours, mais nous avons essayé plusieurs valeurs de la
demi- vie d’efficacité des statines (2, 5, 7, 10, 15 jours).
Si on utilise une période d =30 et une demi-vie t1/2 , alors à t1/2 , 2t1/2 , 3t1/2 , 7t1/2
par exemple, l’organisme a utilisé 50, 75, 87.5 et 99.3% de l’efficacité du médicament.
Connaissant la valeur de la demi-vie, nous calculons l’effet résiduel pour chacun des
trente derniers jours. Ainsi, la variable d’exposition aux statines basée sur le principe
de la demi-vie est obtenue par
Statine(DV ) (t) =
d
X
i (t)Xi (t),
(3.7)
i=1
i−d
avec i (t) = 2 t1/2 .
c modou sene
Ulaval_2012
35
3.3 Caractéristiques des patients
3.3
Caractéristiques des patients
Les principales caractéristiques démographiques et pathologiques des patients de nos
trois cohortes sont décrites dans le tableau 3 de la page 63. Avec ce tableau, nous notons
les caractéristiques suivantes :
Pour la récidive, la différence entre les deux groupes (utilisateurs et non-utilisateurs de
statines) n’est pas significative pour le sexe (χ2 = 0.7; p = 0.41) et pour la variable
Intravex (χ2 = 3.3; p = 0.07). Par contre pour les variables âge (t = 5.26; p < 0.001)
et récidive (χ2 = 16.12; p < 0.001), on note une différence significative au seuil de
0.05. Les patients qui n’ont jamais utilisé une statine sont en moyenne plus âgés que
ceux du groupe des exposés au moins à une statine (71.9 contre 69.7). On remarque
aussi que 717 patients parmi les 2905 (soit 24.68%) ont au moins une prescription
d’une statine durant leur suivi. Cette exposition aux statines est presque identique
pour les deux sexes, 25.10% pour les hommes et 23.64% pour les femmes. Dans cette
cohorte, 54.6% (1586/2905) des patients ont expérimenté l’événement. Dans 72.82 %
(1155/1586) des cas, la récidive concerne un patient de sexe masculin. Des 1586 évènements enrégistrés pour l’issue récidive, le groupe des non-exposés est concerné dans
78.25% des cas. Pour le lien entre prise de statine et récidive, aucune différence n’est notée entre les femmes exposées et les non-utilisatrices de statines (χ2 = 2.62; p = 0.1052).
Par contre au niveau du groupe des hommes, on note une différence très significative
(χ2 = 14.11; p = 0.0002). Pour l’ensemble (femmes et hommes), la différence est également très significative (χ2 = 16.12; p < 0.0001). Le sexe serait-il un facteur modifiant ou
de confusion pour la relation entre prise de statine et récidive ? Nous constatons aussi
qu’une portion importante des cas de récidive concerne des non-utilisateurs de statines
(78.25%). Parmi les 345 qui ont récidivé dans le groupe des utilisateurs de statine, 253
(73.33%) sont des hommes. Pour le temps moyen de suivi et l’écart-type associé à cette
distribution, nous avons 772.2 (écart-type = 564.8), 869.7 (écart-type=589.9) et 740.3
(écart-type = 552.7) respectivement pour l’ensemble de la cohorte, les patients sous
statines et les non-utilisateurs.
Des 2856 patients observés pour la progression, 775 patients (27.14%) ont au moins une
prise de statine durant tout le temps de suivi. Dans la cohorte, seulement 66 cas de progression sont enregistrés. Parmi ces 66 cas, 86.36% (57 cas) proviennent du groupe des
non-utilisateurs de statines et la presque totalité des cas concerne le groupe des hommes
(54), soit 81.82%. On note également qu’aucune des femmes sous statine n’est concernée
par une progression, et cette différence est significative (p = 0.0263). Dans le groupe
des exposés aux statines, 9 récidives sont enregistrées. L’âge moyen est sensiblement
identique pour les deux groupes. Il est respectivement de 69.75, 71.85 et 71.28 ans pour
le groupe statine, les non-utilisateurs de statine et l’ensemble de la cohorte. De façon
globale, on constate que la différence en termes de progression est significative entre
c modou sene
Ulaval_2012
36
3.3 Caractéristiques des patients
les deux groupes constitués avec l’exposition aux statines (χ2 = 6.227; p = 0.0126). Le
temps de suivi moyen est semblable pour les deux groupes : sous statine (1109.49 jours),
non consommatrice (1031.26 jours).
Enfin, pour les 2856 patients dans la cohorte décès toutes causes confondues, nous avons
enregistré 491 décès, soit 17.19 % durant toute la période de suivi. Parmi ces cas de décès, on a respectivement 64 et 427 cas dans le groupe des utilisateurs et dans le groupe
des non-exposés. De plus, dans 73.73% des cas, le décès concerne un sujet de sexe masculin. Des 64 décès dans le groupe statine, les femmes sont concernées dans seulement
17.19% des cas. Pour le "chronic diseases score" (cds), on constate que le score moyen
est plus élevé dans le groupe statine que dans le groupe non-statine (4.49 versus 2.92).
Cette différence est largement significative au seuil de 5% (χ2 = −11.76; p < 0.0001).
Pour le nombre d’hospitalisations dans les 12 mois avant le début de suivi, les moyennes
dans les deux groupes sont identiques (0.81).
L’âge est distribué de façon identique dans les deux groupes, pour chacune des cohortes
progression et décès toutes causes confondues.
c modou sene
Ulaval_2012
37
Chapitre 4
Modélisation de l’effet statine
Dans ce dernier chapitre, nous exposerons en premier lieu comment les hypothèses et
l’ajustement du modèle de Cox ont été vérifiés, puis exposerons les différents résultats
pour les trois issues.
4.1
Vérification des hypothèses et ajustement du
modèle aux données
Pour les trois issues qui nous intéressent ici, un modèle de Cox avec au moins une
variable dépendante du temps est ajusté. Puisqu’aucune de nos variables explicatives
n’est polytomique (les variables considérées sont dichotomiques ou continues), aucune
transformation n’est faite à ce stade. La vérification des hypothèses du modèle fut notre
première étape de travail.
4.1.1
Forme fonctionnelle et hypothèse de proportionnalité
4.1.1.1
Forme fonctionnelle
Nous avons utilisé les résidus de martingale ainsi que la somme cumulée de ces résidus
pour vérifier, pour chacun de nos modèles, si les variables continues étaient sous la
bonne forme fonctionnelle.
Parmi les variables du modèle récidive {âge, sexe, traitement intravésical (intravex) et
4.1 Vérification des hypothèses et ajustement du modèle aux données
statine}, seul l’âge est continue. La somme cumulée des résidus de martingale de la
figure 4 montre qu’il existe un écart entre les valeurs observées et les valeurs simulées
(p =0.0370). Au seuil de 5%, nous avons une évidence contre l’hypothèse selon laquelle
l’âge serait sous la bonne forme fonctionnelle dans ce modèle. À l’aide du graphe des
résidus de martingale de la figure
5, nous avons transformé l’âge en âge2 selon la pro
0, si age ≺ 65
cédure suivante : age2 =
1, si 65 ≤ âge ≺ 75
2, si age ≥ 75
Pour la progression, en plus de la variable RTUTV qui est dichotomique et dépendante
du temps, nous avons à l’exception de la variable intravex, les mêmes variables que pour
l’issue récidive. Avec la figure 6, nous pouvons constater que l’âge n’est pas sous une
bonne forme fonctionnelle dans le modèle (p=0.0080).Le graphe des résidus de martingale en fonction de l’âge de la figure 7, ne nous indique pas une transformation de
la variable âge. Avec ce graphe, une forme linéaire de l’âge dans le modèle semblerait
adéquate.
Pour l’issue décès, nous avons trois variables continues, l’âge, le "chronic diseases score"
(cds) et le nombre d’hospitalisations dans les 12 mois avant la date de début de
suivi (nbr_hosp). Le tableau 4.1, indique que la forme fonctionnelle des variables âge
(p=0.0420) et nombre d’hospitalisations (p =0.0014) serait problématique. Par contre,
on peut accepter la forme du cds (p =0.2996). Pour avoir une idée des transformations
à choisir, nous avons consulté
les figures 8 et 9. Elles nous suggèrent les transformations
(
0, si nbr_hosp ≤ 2
suivantes : hosp =
1, si nbr_hosp > 2
0, si age ≺ 65
age2 = 1, si 65 ≤ âge ≺ 75
2, si age ≥ 75
Pour l’issue progression, nous avons utilisé la même transformation de l’âge que pour
les issues récidives et décès. Cela étant d’une part motivé par le fait que selon la somme
cumulée des résidus de martingale, l’âge ne serait pas sous la bonne forme fonctionnelle.
D’autre part, pour une comparabilité des modèles, nous avons adopté cette transformation, vu que le graphe des résidus de martingale en fonction de l’âge n’indiquait de
façon explicite une transformation de la variable âge.
c modou sene
Ulaval_2012
39
4.1 Vérification des hypothèses et ajustement du modèle aux données
Table 4.1 – Décès : forme fonctionnelle âge, cds et nbr_hosp
4.1.1.2
Hypothèse de proportionnalité
Pour vérifier si le risque de faire une récidive, d’avoir une progression ou de décéder de
toutes causes était constant dans le temps, nous avons utilisé l’une ou une combinaison
b
des méthodes suivantes : le graphique de log{− log[S(t)]}
en fonction du temps, le processus du score standardisé, une interaction avec le temps ou les résidus de Schoenfeld.
Pour la récidive, bien qu’il soit difficile de se prononcer sur l’hypothèse de proportionnab
lité avec le processus de score standardisé ou le graphe de log{− log[S(t)]}
en fonction
du temps, les résidus de Schooenfeld des figures 10 et 11 nous montrent que le risque
semble être constant dans le temps pour le sexe, alors que pour la variable âge2, le
risque semble dépendre du temps. Nous avons testé si une stratification avec cette variable était adéquate. Avec un seuil observé de 0.052, on n’a pas d’évidence forte contre
l’hypothèse nulle au seuil théorique de 0.05. Nous décidons une stratification avec les
variables age2 et sexe, car ces dernières sont généralement considérées comme confondantes pour la pathologie étudiée.
Pour la progression, les figures 12-15 suggèrent un risque constant dans le temps, aussi
bien pour l’âge que pour le sexe. Le seuil observé pour le test de la nullité du coefficient
devant le terme d’interaction entre l’âge et le temps vaut 0.345 >0.05.
Pour le décès, nous constatons à travers les figures 16-20, que les variables age2 et sexe
violent l’hypothèse de proportionnalité. L’hypothèse d’un risque constant dans le temps
serait raisonnable pour le cds (table 4.1, et figure 21) et la nouvelle variable nbr_hosp
hosp (figures 22 et 23).
c modou sene
Ulaval_2012
40
4.2 Résultats
4.1.2
Ajustement global du modèle aux observations
Pour la vérification de la présence de données aberrantes ou influentes, nous avons
utilisé les résidus de déviance et le DFBETA. Puisque les résidus de déviance forment
une marche aléatoire suivant une normale standard, une observation dont le résidu est
plus grand que 3 en valeur absolue est considérée comme aberrante.
Pour l’influence,
q
1
nous avons considéré toute observation, dont le DF BET A > 2 n comme influente.
Pour les trois modèles, aucune observation influente n’est observée. Par contre pour les
données aberrantes, nous avons respectivement trouvé pour la récidive, la progression
et le décès 8 , 10 et 11 observations. Bien que dans les trois situations la proportion de
données aberrantes soit très faible (moins de 1%), nous avons ajusté un modèle sans
ces observations et nous avons comparé les rapports de risques des modèles avec et sans
ces observations considérées comme aberrantes. Dans tous les cas, les variations de la
mesure d’association sont très faibles. Nous considérons pour la suite ces observations
dans nos analyses.
Enfin les valeurs des seuils associés aux trois tests (p < 0.001) des tables 7, 8 et 9
montrent que nos trois modèles sont globalement explicatifs.
4.2
Résultats
Pour nos trois issues, nous avons identifié d’abord la meilleure approche parmi celles utilisant la demi-vie. Celle ayant le plus petit AIC est choisie. Nous avons ensuite comparé
l’approche choisie avec les autres approches (dichotomique, densité, moyennes mobiles
arithmétiques, moyennes mobiles pondérées et moyennes mobiles exponentielles). Toujours à l’aide du critère d’information de Alkaike, nous avons enfin choisi l’approche
avec le plus petit AIC pour estimer le risque relatif.
Les différents résultats sont résumés dans les trois sous-sections suivantes.
4.2.1
Effet des statines sur la récidive
Pour l’issue récidive, la table 4 de la page 64 montre que parmi les approches utilisant la
demi-vie, celle à 7 jours paraissait la plus appropriée si on se base sur le critère d’Alkaike
(AIC) pour comparer les modèles. Avec la seconde étape de la comparaison, on constate
à l’aide du critère AIC que l’approche utilisant les moyennes mobiles pondérées semble
être la plus appropriée. D’autre part on peut noter que les autres méthodes fournissent
c modou sene
Ulaval_2012
41
4.2 Résultats
sensiblement le même rapport de risques qu’il s’agisse du modèle univarié ou multivarié.
On a alors une faible augmentation du risque de récidive des tumeurs pour les patients
sous statine. On a comme rapport de risques RR = 1.011 (p = 0.0148 ; IC95% =1.0021.020) et RR = 1.012 (p = 0.0102 ; IC95% =1.003-1.021), respectivement pour l’analyse
univariée et multivariée.
Après avoir ajusté avec des facteurs potentiellement confondants, l’analyse multivariée
montre qu’une hausse de l’exposition aux statines d’un milligramme par jour, multiplie
le risque de récidive des tumeurs de 1.012, donc une faible hausse du risque entre 0.3%
et 2.1%.
Nos résultats détectent une association inverse entre statines et récidive des tumeurs.
Cela montre une certaine sensibilité de notre approche, car une définition de l’exposition
basée sur une approche dichotomique ne serait pas en mesure de détecter cette faible
hausse du risque de récidive associé aux statines. Pour une approche dichotomique, les
RR pour les modèles univariés et multivariés seraient respectivement de 1.10 (p=0.1324)
et 1.10 (p=0.1598).
4.2.2
Effet des statines sur la progression des tumeurs
Pour la progression, la table 5 de la page 64 montre que pour l’approche demi-vie, plus
la valeur de la demi - vie est grande, meilleur est le modèle (à l’exception de ce qui est
constaté avec le modèle univarié où l’approche utilisant la demi-vie à 2 jours semble
être la plus adéquate). Donc pour cette issue, les modèles avec une longue mémoire de
rappel semblent être les plus appropriés. Cela se voit clairement avec le modèle utilisant la densité, qui a la valeur d’AIC la plus petite. L’analyse univariée montre qu’avec
ce modèle, l’effet d’une prise de statine sur la progression d’un cancer superficiel de
la vessie n’est pas significatif [RR = 0.902 (p = 0.0628 ; IC95% =0.810-1.006)]. En
ajustant avec la variable RTUTV, nous constatons qu’avec l’analyse multivariée qu’une
hausse de 1mg/jour de l’exposition aux statines diminuerait de 12.5% [RR = 0.875 (p
= 0.00290 ; IC95% =0.777-0.986)] le risque de progression des tumeurs vers les parois
du muscle vésical.
Avec une modélisation dichotomique de la variable d’exposition, il y aurait certainement
une surestimation de l’effet protecteur des statines contre une progression des tumeurs.
Comparativement à notre approche (RR=0.902), une analyse univariée basée sur une
modélisation dichotomique de la variable d’exposition aux statines donnerait comme
RR 0.47. Après avoir ajusté avec des facteurs cliniques, il y aurait toujours une surestimation potentielle de l’effet protecteur des statines. Le Risque relatif observé serait
respectivement de 0.875 (l’effet d’une hausse unitaire de l’exposition aux statines) pour
notre approche et de 0.38 pour une définition dichotomique de l’exposition (exposés
versus non exposés).
c modou sene
Ulaval_2012
42
4.2 Résultats
4.2.3
Effet des statines sur le décès toutes causes
Enfin pour l’issue décès toutes causes confondues, la table 6 de la page 64 indique que
les modèles avec une courte mémoire de rappel sont plus appropriés. Il s’agit des méthodes utilisant la moyenne mobile exponentielle (MME), la moyenne mobile pondérée
(MMP), la moyenne mobile arithmétique (MMA), la demi-vie à 2 (DV2), 5 (DV5) et 7
(DV7) jours. Si nous utilisons l’approche basée sur la MME, dont la borne supérieure
de l’intervalle de confiance associé est incluse dans les autres intervalles de confiance,
on peut conclure qu’une hausse de l’exposition aux statines d’un milligramme par jour
permet d’allonger la durée de survie des patients. Une diminution du risque de décéder
de toutes causes de l’ordre de 11% [RR = 0.890 (p < 0.0001 ; IC95% =0.846-0.935)] et
13% [RR = 0.865 (p < 0.0001 ; IC95% =0.820-0.913)] est notée, respectivement pour
l’analyse univariée et multivariée.
En comparant notre approche à une approche dont la variable d’exposition aux statines
est définie de façon dichotomique, nous constatons que cette dernière surestimerait l’effet protecteur des statines contre le décès toutes causes confondues pour les patients
avec un cancer superficiel de la vessie. Il y aurait une hausse de 17% (RR=0.890 versus 0.72) et 29.5% (RR=0.865 versus 0.57) respectivement pour l’analyse univariée et
l’analyse ajustée. Avec une approche dichotomique, on constate qu’en ajustant avec des
facteurs cliniques, l’effet protecteur constaté avec le modèle univarié varie de 15%. Or
avec notre approche, seulement une variation de 2.5% est notée.
Dans les trois issues, nous pouvons constater comparativement à une approche de modélisation dichotomique, nos modèles détectent des effets non détectables par approche
dichotomique (pour l’issue récidive). Nos approches permettent également de minimiser
les biais d’information de nature différentiels ou non affectant la mesure d’association.
Ces biais sous-estiment ou surestiment le vrai risque relatif, ce que nous avons constaté
avec l’approche dichotomique.
Au terme de ces analyses, nous pouvons constater que les modèles les plus adéquats
pour l’issue décès sont ceux avec une courte mémoire. Cela signifie qu’une bonne modélisation de l’issue décès doit se limiter à l’exposition récente aux statines. Pour la
progression, c’est plutôt les modèles avec longue mémoire qui semblent être les plus
appropriés. Cela vaut dire qu’une bonne modélisation de la variable statine pour l’issue
progression doit ramasser sur une longue période dans le passé la quantité de statine
utilisée par le patient.
c modou sene
Ulaval_2012
43
Conclusion - Discussion
Discussion
L’objectif de ce travail de recherche était d’étudier l’effet d’une exposition aux statines
sur l’évolution d’un cancer superficiel de la vessie. L’originalité de cette étude réside
non seulement dans le fait qu’il y a peu d’études s’intéressant au lien entre statine et
cancer de la vessie, mais aussi l’utilisation d’une grande base de données avec des informations fiables et des méthodes innovatrices utilisées pour la définition des issues et de
l’exposition. L’approche utilisée en terme de modélisation statistique apporte un plus
par rapport à ce qui est généralement utilisé dans le domaine épidémiologique. Dans la
majeure partie des études, pour des raisons d’interprétabilité de la mesure d’association,
une exposition dichotomique fait le plus souvent l’affaire. Ainsi, un risque relatif de 0.8
dans une exposition dichotomique s’interprète facilement. Comparativement aux non
exposés, les exposés ont 20% moins de risques de subir l’événement étudié. Alors que,
dans notre approche où l’unité d’exposition est le mg/jours de principe actif dans une
statine (variable d’exposition continue), il est bien difficile pour le médecin d’expliquer
à son patient où à un auditoire novice dans le domaine qu’une hausse de 1mg/jour
réduirait le risque d’une récidive de 2% (RR=0.98). Bien que cette dernière permette
d’évaluer convenablement la relation dose-réponse, ces résultats sont souvent mal compris par ceux n’ayant pas une bonne base en épidémiologie analytique. Ce que nous
ignorons souvent avec cette méthode est de combien le sujet est exposé. D’autre part, le
sens d’un accroissement unitaire de l’exposition dans un modèle où la variable d’exposition est continue peut biologiquement s’interpréter difficilement. Malgré la précision
qu’apporte notre approche, il serait logique à ce stade de notre travail, de faire un petit
bilan. Bilan qui nous permettra d’évaluer le rapport coût-bénéfice. Mais avant cela,
voyons s’il existe des points qui limiteraient potentiellement cette étude observationnelle, longitudinale.
Cette étude rétrospective montre qu’une exposition aux statines est associée à un faible
risque de récidive des tumeurs de la vessie (RR = 1,10, IC95 1,003 à 1,20). Cette association inverse que nous avons observée, des études récentes l’ont déjà soulevée. Friedman
4.2 Résultats
et al (29), Vinogradova et al (59), Kaye et al (35), ont soutenu une association négative entre statine et cancer de la vessie. Nos résultats corroborent aussi ceux de Blais
et al (17), Karp et al (34) pour l’effet protecteur des statines pour l’issue décès. Et
enfin pour la progression des tumeurs, à part l’approche utilisant la densité, les autres
approches donnent des résultats non significatifs comme dans la grande majorité des
quelques rares études s’intéressant au lien entre statines et cancer de la vessie. Cela nous
permet de penser que notre travail apporte un plus. Si les résultats de certaines études
antérieures tirent dans des sens différents, cela s’expliquerait peut-être par la définition
même de l’exposition (dichotomique le plus souvent. Or d’une étude à une autre, la
dichotomisation de la variable d’exposition est souvent différente) ou de l’issue.
Bien qu’elle suggère un certain effet protecteur des statines contre une progression ou
un décès toutes causes pour les patients avec un cancer superficiel de la vessie, les points
suivants peuvent être source d’erreurs systématiques affectant le risque relatif entre exposés et non-exposés. À la différence d’une erreur aléatoire qui correspond à un manque
de précision dans la mesure, une erreur systématique masque, surestime, sous-estime,
ou crée un lien statistiquement significatif entre l’exposition et la maladie, mais qui réellement n’existe pas. Parmi les potentielles erreurs systématiques qui constitueraient une
limite pour cette étude, on peut noter celles commises lors de la sélection des cohortes,
la collecte de l’information ou au cours des analyses. On peut citer entre autres les biais
de référence, de prévalence, la source d’information, les procédures de sélection. Selon
Brian L. Strom (55, pp 321-331) si les raisons de l’exposition pour laquelle le patient
est recommandé à une structure de santé donnée sont reliées au statut d’exposition ;
ou bien si le médicament étudié contribue au processus de diagnostic, alors il y aurait
une erreur systématique de référence. Du fait que les bases de données de la RAMQ
ramassent toutes l’information sur les patients de la province Québécoise, il y a une très
faible probabilité que ce biais se manifeste pour notre étude. Au niveau de la collecte
de l’information et du classement, on peut se demander s’il n’y a pas de surestimation
ou de sous-estimation de l’exposition. Si pour un patient donné, une prescription est
délivrée, mais non totalement utilisée, alors ceci aura comme conséquence une surestimation de l’exposition pour ce sujet. Cette erreur de mesure sur l’exposition, si elle se
manifeste dans les deux modalités de l’issue, alors on aura un biais d’information non
différentiel. Vu qu’il existe une contribution patient pour l’acquisition du médicament,
s’il existe des cas de prescriptions non utilisées, leur proportion seraient très faible, voire
insignifiante. D’autre part, on peut aussi soupçonner d’autres sources de médicaments
(Internet, lors d’un déplacement à l’étranger, etc.). Mais si l’on sait qu’au niveau provincial, la couverture RAMQ est la moins chère, il serait peu probable qu’un assuré aille
se procurer une statine en dehors du circuit de la RAMQ. Notre mesure d’exposition
est quasi épargnée d’un éventuel biais de mémoire qui affecte généralement les études
cas-témoin, mais pouvant se manifester pour toute autre étude. L’information n’est pas
collectée auprès des patients, mais plutôt à partir de données fiables et à jour.
c modou sene
Ulaval_2012
45
4.2 Résultats
Toute fois, on peut soupçonner la présence de biais de détection surtout pour les issues
récidive et progression. Si dans l’une de ces cohortes, il existe un groupe de patients
susceptibles de voir un urologue plus fréquemment que les autres, alors pour ce groupe
la probabilité de détecter d’une anomalie sera plus importante que dans le reste de
la cohorte. Pour ce même groupe, il est clair que la fréquence de leurs consultations
favoriserait une détection précoce d’une récidive ou d’une progression, donc rapproche
l’intervalle de temps entre les RTUTV et augmente éventuellement le nombre de traitements adjuvants intra vésicaux. Ce qui aura un effet sur la contribution de ces patients
sur leur temps de suivi, puisqu’on utilise ici un modèle de Cox avec des variables dépendantes du temps.
Nos approches ne sont pas indemnes de biais de temps immortel. Ce biais est un
biais de classification résultant d’une combinaison d’un biais de sélection et d’un biais
d’évaluation. Il est nommé généralement biais de sélection du survivant au traitement
(immortal-time bias) et cause une distorsion du risque relatif estimé. Il peut entraîner
une exposition attribuée de manière erronée sur une certaine période de temps. Il est
selon Samy Suissa (55, p. 385) un grand défi d’analyser une étude portant sur l’efficacité d’un médicament surtout si l’exposition à ce dernier change dans le temps dans
la cohorte. Bien que ce type de biais affecte potentiellement notre étude, les modèles
mathématiques que nous avons utilisés contrôlent certainement ces biais de temps immortel. Nos approches permettent de définir l’exposition en tenant compte de la durée et
de la quantité d’expositions. Pour l’âge, nous pensons que sa définition pour le groupe
des 85 ans et plus pour des raisons de confidentialité n’affecte pas significativement
notre mesure d’association. D’autant plus que dans les analyses l’âge en début de suivi
est utilisé. Par contre pour le décès, du fait qu’on avait seulement le mois du décès, et
que le dernier jour du mois de décès a été choisi comme jour de décès, peut affecter
sensiblement les modèles avec courtes mémoires que nous avons essayés. Les approches
utilisant la demi-vie à 2 jours, les moyennes mobiles à 30 jours qui semblent être les
plus adéquats pour l’issu décès seront probablement affectées. On sait qu’avec une approche utilisant une demi-vie à t jours, après une période de 7t, la presque totalité de
la quantité de médicaments (99.3%) est utilisée par l’organisme. Avec une demi-vie à 2
jours, après 14 jours, on peut supposer que toute l’efficacité du médicament est utilisée.
Supposons deux patients A et B qui sont décédés respectivement au jour 5 et au jour
25 du mois de janvier 2002. Pour nos modèles, les dates de décès de ces deux patients
seront identiques, le 31 janvier 2002. Ce qui entraîne de faux cas d’égalités. Or avec les
dates exactes de décès, ces deux individus allaient contribuer de façon différente pour
les événements enregistrés entre 5 et 25 janvier 2002.
D’autre part, bien que la relation d’équivalence que nous avons utilisée pour standardiser les quantités de statines soit une formule valide, on peut se demander si ces 6
statines ont les mêmes effets anticancer. Hamelin et Turgeon (30) ont prouvé cet effet
anticancer est fonction du sous-type de statine. Si ces statines ont des lipophilicités dif-
c modou sene
Ulaval_2012
46
4.2 Résultats
férentes (la lovastatine et la simvastatine, sont les plus lipophiles), or pour que certains
mécanismes anticancer s’exercent, la molécule doit pénétrer les membranes cellulaire et
nucléaire Fradet (27)), on peut envisager dans de futures investigations tenir compte
de ce paramètre.
Il est raisonnable de se demander si l’absence d’un certain nombre de facteurs ne serait
pas une limite pour cette étude. La nature de la source d’information, base de donnée
administrative, ne nous a pas permis d’avoir accès à l’information relative à des facteurs tels que l’exposition au tabac, à l’alcool, à la tumeur [le grade, la profondeur de
la pénétration (stade), la grosseur, l’architecture tumorale solide versus papillaire, la
multifocalité, la fréquence de la récidive, etc.]. Martinache et al (43) ont montré que l’hématurie au moment du diagnostic et la taille des tumeurs sont des facteurs de récidive,
alors que les patients avec une récidive au cours de la première année après la résection
initiale sont plus susceptibles d’avoir une progression des tumeurs à travers le muscle
vésical. Barmoshe et al (15) dans leur étude publiée en 2004, ont cité comme facteurs de
récidive ou de progression le stade, le grade, l’emplacement, la profondeur et le type de
thérapie intravésicale. Geoege Janke et al (33) dans leur récente étude, ont conclu que
les tumeurs malignes de haut grade sont des facteurs de récidive (p<0.001) et de progression (p=0.036). Dans la même étude, comme autres facteurs affectant la récidive,
ils ont cité la taille de la tumeur [16-30mm (p=0.006) et plus de 30mm(p<0.001)], les
tumeurs de catégorie T1 (p=0.002) et la multiplicité (p<0.001). Et selon cette même
étude, la progression est associée aux tumeurs de catégorie T1 (p<0.001), à la récidive
locale (p<0.001) et aux concomitants CIS(p=0.024).
Parmi les sources potentielles de biais de confusion nous citons : la comédication, l’observance thérapeutique, les biais d’indication. Lennernas et al (42) et Becquemont (16)
ont expliqué qu’une interaction médicamenteuse avec les statines se situe principalement au niveau du métabolisme hépatique et intestinal. Si la plupart des statines
sont métabolisées par le foie et l’intestin et que certains médicaments peuvent être
conjointement pris avec ces hypolipidémiants, alors cela peut inhiber le métabolisme
de certaines statines, ralentir l’élimination de ces médicaments dans l’organisme ou
hausser leurs concentrations plasmatiques. Cette interaction, si elle se manifeste, affectera l’exposition surtout pour les approches utilisant les moyennes mobiles ou la
demi-vie. Parmi ces médicaments, nous pouvons citer le Diltiazine, la Vérapamil (pour
les maladies cardiovasculaires), l’érythromycine et la clarithromycine (antibiotiques), la
cyclosporine (immunosuppresseurs) et le jus de pamplemousse. Dans les différentes cohortes, il existe des patients qui ont utilisé d’autres hypolipidémiants (fibrates, résines,
etc). L’observance thérapeutique mérite d’être soupçonnée. On peut se demander si les
patients ont tous accepté les traitements proposés, respecté la prescription établie par
le médecin et ont suivi le traitement comme indiqué.
Dans une étude pharmaco-épidémiologique, le biais d’indication (confounding by indication, prescription bias) est très fréquent. Biais ayant pour conséquence une estimation
c modou sene
Ulaval_2012
47
4.2 Résultats
faussée de la mesure d’association entre la prise d’un médicament et la survenue d’un
événement d’intérêt. Il pourrait se manifester par exemple si les médecins prescrivent
préférentiellement une statine chez les sujets à risque élevé de progression et non pas
de façon aléatoire ou bien si l’exposition aux statines constitue un critère de diagnostic
utilisé par les médecins pour détecter une récidive, une progression, ou faire un pronostic de survie pour les patients avec un cancer superficiel de la vessie. On peut sans
doute penser que cette étude est épargnée de ce type de biais, du fait qu’on étudie ici
l’effet des statines en intervention secondaire. La prescription d’une statine n’étant pas
relative à un cancer de la vessie, mais plutôt pour lutter contre le "mauvais" cholestérol.
Toutefois le mesure de l’exposition n’est pas exceptée de biais de rémanence (carry over
effect) qui est une erreur de mesure consistant à ne pas attribuer un événement ou un
effet à une exposition antérieure dont l’influence sur l’organisme persiste malgré son
arrêt. S’il existe des patients qui ont été exposés à des statines avant leur entrée dans
l’étude, ou avant leur couverture par la RAMQ, il en résulterait un biais de rémanence.
Malgré les limites potentielles énumérées ci-haut, notre étude présente des points forts.
Parmi ces points il y a la taille des cohortes, les différents critères d’inclusion et d’exclusion appliqués pour que les différentes analyses concernent les cas incidents de cancer
de la vessie. Cette homogénéité (patients avec un cancer superficiel) de nos cohortes
constitue une différence majeure avec ce qui est généralement fait. Dans une bonne
partie des études, l’enrôlement concerne des patients de stades, grades très différents.
La définition des issues qui est basée sur un système international standard, la classification internationale des maladies, permet de bien identifier les cas de récidive ou de
progression. L’information sur l’exposition obtenue à partir de la base de données pharmaceutique de la RAMQ, et non par déclaration individuelle, écarte de potentiels biais
de rappel. Enfin la modélisation de la variable d’exposition, qui permet de tenir compte
de la durée et de la quantité d’expositions, d’où de différencier l’exposition chronique,
occasionnelle ou modérée apporte un plus par rapport à l’approche dichotomique qui
est l’approche la plus utilisée dans les études épidémiologiques.
Il serait intéressant de se demander si les statines protègent les femmes contre une
progression des tumeurs. Aucune des femmes ayant au moins une statine n’a eu de
progression. D’autre part, nous notons un certain paradoxe. Les statines auraient un
effet protecteur très significatif pour le risque de décès toutes causes confondues, alors
que pour la récidive, une association négative semble se dégager. Cela peut s’expliquer
par des hypothèses liées à l’âge ou à l’adhérence au traitement. Si les statines allongent
la survie de patients avec des tumeurs, et qu’il est prouvé que l’âge est un facteur
de risque de récidive et de progression, ils seront alors de plus en plus exposés à une
nouvelle apparition d’une tumeur ou à une progression de la tumeur existante vers le
muscle vésical. Une autre hypothèse relative à l’adhérence au traitement expliquerait
ce paradoxe. Cette hypothèse soutient que certains patients, sachant qu’ils sont en fin
de vie, deviennent moins adhérents aux traitements [l’acceptation du traitement pro-
c modou sene
Ulaval_2012
48
4.2 Résultats
posé, l’observance thérapeutique (respecte la prescription établie par le médecin) et la
persistance (fidélité) à suivre le traitement] sont souvent affectées. Or si ces derniers
reçoivent une prescription et que celle-ci n’est pas utilisée convenablement, alors il y
aura une surestimation ou une sous-estimation de l’exposition qui aura un effet sur le
risque relatif.
Après avoir abordé les points forts et les limites potentielles de cette étude, on peut
maintenant se demander si la modélisation utilisée en valait la peine. En d’autres termes,
si le jeu en valait la chandelle. D’abord cette approche nous a permis d’identifier l’effet statine pour les trois issues relatives au cancer de la vessie. Notre modèle détecte
une faible hausse du risque de récidive associé aux statines. Cette forte sensibilité du
modèle par rapport aux modèles utilisant une approche dichotomique fait qu’il devient
incontournable, bien qu’il nécessite plus de ressources pour sa mise en place et pour
l’interprétation de ses résultats. D’autre part au niveau des seuils observés, notre approche donne des " p- values " plus petites, donc plus significatives. Ce qui minimise
la probabilité de commettre une erreur de première espèce, c’est-à-dire rejeter à tort
l’hypothèse selon laquelle le coefficient qui est devant la variable statine dans le modèle
de régression de Cox est nul. Ou en d’autres termes rejeter l’hypothèse selon laquelle
exposés et non exposés aux statines présentent le même risque (RR = e(β=0) = 1)
de récidive, de progression, ou de décès. Par contre pour l’issue progression, on note
qu’une approche de modélisation dichotomique ferait l’affaire. Pour cette issue, aussi
bien pour l’analyse univariée que multivariée, les AIC du modèle qui semble être le
plus adéquat, celui utilisant la densité, sont presque identiques à celui de l’approche
dichotomique. Les "p-values" pour les modèles ajustés sont sensiblement égaux. Cette
approche, bien qu’exigeant un effort considérable en terme de modélisation, de compréhension du concept par un non-initié, d’interprétation des résultats, apporte un plus
par rapport à une approche dichotomique. Cette approche allant jusqu’à évaluer l’effet
d’une variation d’exposition d’un milligramme par jour peut-être d’un grand apport
pour quantifier une toxicité éventuelle du médicament. Ce qui était le cas de la cérivastatine de Bayer en 2002, une des statines utilisées dans cette étude, car étant utilisée
durant la période de l’étude.
Un autre aspect de cette étude, est qu’elle nous permet de déceler un certain paradoxe.
Les statines favoriseraient probablement une récidive des tumeurs pour un cancer superficiel de la vessie et en même temps joueraient un rôle de protection contre la progression
des tumeurs et le décès. Ce paradoxe pourrait s’expliquer par la thérapie intravésicale
seulement considérée comme variable exogène pour l’issue récidive. Ce traitement dans
laquelle des agents sont injectés directement dans la vessie pour prévenir les récidives
tumorales est généralement appliqué pour des tumeurs à haut risque de récidive enfin
de réduire de manière significative le risque de rechute locale. D’autre part, si la résection transuréthrale sous-estime le stade réel (T) des tumeurs, cela pourrait expliquer en
partie ou totalement le taux élevé de rechute. Si ces patients présentent un haut risque
c modou sene
Ulaval_2012
49
4.2 Résultats
de rechute, alors la probabilité qu’ils soient sous traitement intravésical est forte, donc
source potentielle d’un biais d’indication. Cette erreur systématique pouvant causer une
distorsion du risque relatif instantané, peut constituer une piste pour la justification du
paradoxe.
Conclusion
Les statines, ces inhibiteurs de l’HMG-coA, l’enzyme clé de la synthèse du cholestérol,
sont l’un des médicaments les plus efficaces utilisés dans la lutte contre le " mauvais
" cholestérol dans le sang. Nous avons essayé, à travers cette étude, d’investiguer sur
l’effet de cette classe de médicaments en intervention secondaire pour le cancer de la
vessie ; plus spécifiquement le cancer superficiel avec des tumeurs superficielles non infiltrantes. Au terne de ce travail, nous pouvons retenir que l’utilisation d’une statine, bien
qu’elle ne soit pas spécifique au traitement d’un cancer de la vessie, semble contribuer à
allonger la survie des patients avec un cancer superficiel de la vessie. Ces médicaments
semblent également diminuer le risque de progression des tumeurs vers les parois du
muscle vésical. Toutefois, ces médicaments favorisent, mais très faiblement, le risque de
récidive des tumeurs après une résection.
Les bienfaits des statines que ce travail suggère augmentent l’intérêt à effectuer des
travaux supplémentaires qui pourraient ultimement mener à l’amoindrissement du coût
élevé lié à l’intervention (cystectomie, traitement intravésical, chimiothérapie, radiothérapie, etc.), l’augmentation de la qualité de vie des patients et à apporter une réponse
ou une piste de réponse à des questions d’actualité.
c modou sene
Ulaval_2012
50
Bibliographie
[1] Arcagy :http://www.arcagy.org/, consulté le 20 juillet 2012.
[2] Cancer canada :http://www.cancer.ca/canada-wide, visité en juillet, 2012.
[3] Centre hospitalier universitaire du québec :http://www.chuq.qc.ca, visité en juin
2012.
[4] Organisation mondiale de la santé :http://www.who.int/mediacentre/
factsheets/fs297/fr/index.html, visité le 28 septembre 2012.
[5] Pharmacorama
:http://www.pharmacorama.com/Rubriques/Output/
Pharmacocinetiquea3.php, consulté le 26 septembre 2012.
[6] Ramq
:http://www.ramq.gouv.qc.ca/fr/donnees-statistiques/
sur-demande/donnees-regie, visité en juin 2012.
[7] Sas support :http://support.sas.com/documentation/, visité le 28 septembre
2012.
[8] Statistiques canadiennes sur les cancers :http://www.cancer.ca/~/media/CCS/
Canada, consulté le 30 juillet 2012.
[9] Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease : the scandinavian simvastatin survival study (4s). Lancet 344(8934) (1994),
1383–9.
[10] Abrahamowicz, M., Bartlett, G., Tamblyn, R., and du Berger, R.
Modeling cumulative dose and exposure duration provided insights regarding the
associations between benzodiazepines and injuries. J.C. Epidemiol. 59 (2006),
393–403.
[11] Ahern, T., Pedersen, L., Tarp, M., Cronin-Fenton, D., Garne, J.,
Silliman, R., Sørensen, H., and Lash, T. Statin prescriptions and breast cancer recurrence risk : a danish nationwide prospective cohort study. J Natl Cancer
Inst. 103(19) (2011), 1461–1488.
BIBLIOGRAPHIE
[12] Alberts, A. Discovery, biochemistry and biology of lovastatin. A.J. Cardiol.
62(15) (1988), 10J–15J.
[13] Allison, P. D. Survival Analysis using SAS, A pratical guide, second ed. Cary
N.C. :SAS Press, (2010).
[14] APC. Compendium des produits et spécialités pharmaceutiques. L’ouvrage de référence Canadien sur les médicaments pour les professionnels de la santé, 45 ed.
CPS2010, (2010).
[15] Barmoshe, S., and Zlotta, A. Prognosis of t1g3 tumors : Clinical factors. Eur
Urology Supplements 3(3) (2004), 73–78.
[16] Becquemont, L. Inhibiteurs de l’hmg-coa reductase et interactions médicamenteuses. La lettre du pharmacologue 14(3) (2000), 64–68.
[17] Blais, L., Desgagné, A., and LeLorier, J. 3-hydroxy-3-methylglutaryl coenzyme a reductase inhibitors and the risk of cancer : a nested case-control study.
Arch Intern Med. 160(15) (2000), 2363–8.
[18] Bruckert, E. Les statines : une révolution thérapeutique qui pose beaucoup de
questions. STV 11(5) (1999), 383–6.
[19] Burger, M., Catto, J., Dalbagni, G., Grossman, H., and Herr, H.
Epidemiology and risk factors of urothelial bladder cancer. Eur Urol . (2012), .
[20] Colina, P., Koeniga, P., Ballereaua, C., Phea, V., Berthona, N., Villersa, A., Bisertea, J., and Roupretc, M. Sporadic upper urinary tract
urothelial cell carcinomas : Identification of interaction between toxic carcinogens
and individuals genetic susceptibility. P en Urologie 20(1) (2010), 1–10.
[21] Cui, X., Lu, X., Hiura, M., Omori, H., Miyazaki, W., and Katoh, T.
Association of genotypes of carcinogen-metabolizing enzymes and smoking status
with bladder cancer in a japanese population.. Env Health Prev Med. (2012).
[22] D’Agostino, R., Russell, M., Huse, D., Ellison, R., Silbershatz, H.,
Wilson, P., and Hartz, S. Primary and subsequent coronary risk appraisal :
new results from the framingham study. Am Heart J. 139(2 Pt 1) (2000), 272–81.
[23] Downs, J., Clearfield, M., Weis, S., Whitney, E., Shapiro, D., Beere,
P., Langendorfer, A., Stein, E., Kruyer, W., and Jr Gotto, A. Primary
prevention of acute coronary events with lovastatin in men and women with average
cholesterol levels : results of afcaps/texcaps. air force/texas coronary atherosclerosis
prevention study. JAMA 279(20) (1998), 1615–22.
c modou sene
Ulaval_2012
52
BIBLIOGRAPHIE
[24] Duchesne, T. Analyse de durée de vie. Département Mathématiques et Statistique Ulaval, A 2011 (2011). Cours STT 7130 : Analyse des durées de vie ; Chapitre
1 à 6.
[25] Duggal, J., Singh, S., Kuchinic, P., Butler, P., and ARora, R. Utility
of esmolol in thyroid crisis. Can J Clin Pharmacol 13(3) (2006), e292–e295.
[26] Farwell, W., D’Avolio, L., Scranton, R., Lawler, E., and Gaziano, J.
Are statins associated with decreased risk for prostate cancer diagnosis and grade ?
JNCI J Natl Cancer Inst 103(11) (2011), 885–892.
[27] Fradet, V. Les lipides et les cancers urologiques - approches épidémiologiques.
L’importance du temps immortel. PhD thesis, Département de Sciences Biomédicales Faculté de médecine, Université de Montréal., (2011).
[28] Fradet, V., Lelorier, J., Sheehy, O., Caron, A., Duchesne, T., and
Saad, F. Statin drugs and bladder cancer evolution. Article non publié.
[29] Friedman, G., Flick, E., Udaltsova, N., Chan, J., Quesenberry Jr, C.,
and Habel, L. Screening statins for possible carcinogenic risk : up to 9 years
of follow-up of 361 859 recipients. Pharmacoepidemiology and Drug Safety 17(1)
(2008), 27–36.
[30] Hamelin, B., and Turgeon, J. Hydrophilicity/lipophilicity : relevance for
the pharmacology and clinical effects of hmg-coa reductase inhibitors. Trends
Pharmacol Sci. 19(1) (1998), 26–37.
[31] Harris, B., Lovett, L., Smith, J., Read, G., Walker, R., and Newcombe, R. Cardiff puerperal mood and hormone study. ifi. postnatal depression
at s to 6 weeks postpartum, and its hormonal correlates across the peripartum
period. BJP 168 : (1996), 739–744.
[32] Jacobs, E., Newton, C., and Thun, M. Long-term use of cholesterol-lowering
drugs and cancer incidence in a large united states cohort. Cancer Research 71
(2011), 1763–1771.
[33] Jancke, G., Rosell, J., Chebil, G., and Jahnson, S. Bladder wash cytology
at diagnosis of ta-t1 bladder cancer is predictive for recurrence and progression. J
of Urol 80(3) (2012), 625–631.
[34] Karp, I., Behlouli, H., LeLorier, J., and Pilote, L. Statins and cancer
risk. AJM 121 (2008), 302–309.
[35] Kaye, J., and Jick, H. Statin use and cancer risk in the general practice research
database. BJC 90 (2004), 635–637.
c modou sene
Ulaval_2012
53
BIBLIOGRAPHIE
[36] Kertai, M., Boersma, E., Westerhout, C., Klein, J., van Urk, H., Bax,
J., Roelandt, J., and Poldermans, D. Acombination of statins and betablockers is independentlyassociated with areduction in the incidence of perioperativemortality and nonfatalmyocardialinfarction in patientsundergoingabdominalaorticaneurysm surgery. EJVES 28(4) (2004), 343352.
[37] Klein, J., and Moeschberger, M. Survival analysis : techniques for censored
and truncated data, second ed. New York : Springer, (2003).
[38] Kroll, M., Twomey, P., and Srisawasdi, P. Using the single-compartment
ratio model to calculate half-life, nt-probnp as an example. Clin Chim Acta 380(12) (2007), 197–202.
[39] Lawless, J. Statistical Models and Methods for Lifetime Data, second ed. Hoboken NJ :Wiley, (2003).
[40] Leblanc, B., Duclos, A., Bénard, Fand Côté, J., Valiquette, L., Paquin, J., Mauffette, F., Faucher, R., and Perreault, J. Long-term
followup of initial ta grade 1 transitional cell carcinoma of the bladder. J Urol.
162 (1999), 1946–1950.
[41] Lee, E. T., and Wang, J. Statistical Methods for Survival Data Analysis,
third ed. Hoboken NJ : Wiley, (2003).
[42] Lennernas, H., and Fager, G. Pharmacodynamics and pharmacokinetics of
the hmg-coa reductase inhibitors. similarities and differences. Clin Pharmacokinet
32(5) (1997), 403–25.
[43] Martinache, G., Zerbib, M., Descazeaud, A., Debré, B., and Peyromaure, M. Tumeurs de la vessie pta : facteurs de récidive et de progression. P
Urol 18(1) (2008), 35–40.
[44] Monge, M. avec la collab. de BERGERON C. Cancérologie et biologie : marqueurs
tumoraux organe par organe. Issy-les-Moulineaux : Elsevier Masson SAS, (2006).
[45] Nielsen, M. Advanced age is associated with poorer bladder cancer-specific survival in patients treated with radical cystectomy. E Urol 51 : (2007), 699–708.
[46] Pan, W., Pintar, T., Anton, J., Lee, V., Vaughn, W., and Collard,
C. Statins are associated with a reduced incidence of perioperative mortality after
coronary artery bypass graft surgery. Circulation. 110(11 Suppl 1) (2004), II 45–49.
[47] Pfister, C., Moore, L., Allard, P., Larue, H., Lacombe, L., Têtu, B.,
Meyer, F., and Fradet, Y. Predictive value of cell cycle markers p53, mdm2,
c modou sene
Ulaval_2012
54
BIBLIOGRAPHIE
p21, and ki-67 in superficial bladder tumor recurrence. Clin Cancer Res 5 (1999),
4079–4084.
[48] Rink, M., Furberg, H., Zabor, E., Xylinas, E., and Marko, E. Impact
of smoking and smoking cessation on oncologic outcomes in primary nonmuscleinvasive bladder cancer. Eur Urol (2012).
[49] Saad, F., and Sabbagh, R. Le cancer de la vessie approche diagnostique et
thérapeutique. le clinicien 16(4) (2001), 143–156.
[50] Sacks, F., Pfeffer, M., Moye, L., Rouleau, J., Rutherford, J., Cole,
T., Brown, L., Warnica, J., Arnold, J., Wun, C., Davis, B., and Braunwald, E. The effect of pravastatin on coronary events after myocardial infarction
in patients with average cholesterol levels. cholesterol and recurrent events trial
investigators. N Engl J Med. 335(14) (1996), 1001–9.
[51] Samson, E. Identification des marqueurs pronostiques chez les patients atteints
dun cancer de la tête et du cou. Master’s thesis, Département de mathématiques
et statistique Université Laval Québec Canada, (2009).
[52] Schoenfeld, D. Partial Residuals for proportionnal hazards regression Model.
Vol. 69, No. 1., pp. 239-241. Biométrika, (1982).
[53] Shepherd, J., Cobbe, S., Ford, I., Isles, C., Lorimer, A., MacFarlane,
P., McKillop, J., and Packard, C. Prevention of coronary heart disease with
pravastatin in men with hypercholesterolemia. west of scotland coronary prevention
study group. N Engl J Med. 333(20) (1995), 1301–7.
[54] Soloway, M., Carmack, A., and Khoury, S. Bladder Tumors. Health Publication Ltd. Editions 21, (2006).
[55] Strom, B. L., and Kimmel, S. E. Texbook of Pharmacoepidemiology. West
Sussex England : John Wiley, (2003).
[56] Sylvester, R., van der Meijden, A., Oosterlinck, W., Witjes, J.,
Bouffioux, C., Denis, L., Newling, D., and Kurth, K. Predicting recurrence and progression in individual patients with stage ta t1 bladder cancer
using eortc risk tables : a combined analysis of 2596 patients from seven eortc
trials. Eur Urol. 49(3) (2006), 466–5 ; discussion 475–7.
[57] Tanagho, E. A., and McAninch, J. W. Smith’s, General Urology, fifteenth ed.
New York : McGraw-Hill, (2000).
[58] Therneau, T., and Grambsch, P. Proportional Hazards tests in diagnostics
based on Weighted Résiduals. Vol. 81, No. 3., pp. 515-526. Biométrika, (1994).
c modou sene
Ulaval_2012
55
BIBLIOGRAPHIE
[59] Vinogradova, Y., Coupland, C., and Hippisley Cox, J. Exposure to statins and risk of common cancers : a series of nested case - control studies. BMC
11 (2011), 409.
[60] Vogelzang, N., Scardino, P., Shipley, W., Debruyne, F., and Linehan,
W. Comprehensive Textbook of Genitourinary Oncology, third ed. Philadelphia,
(2006).
[61] Von Korff, M., Wagner, E., and Saunders, K. A chronic disease score
from automated pharmacy data. J Clin Epidemiol 45(2) (1992), 197–203.
[62] Ward, R., Leeper, N., Kirkpatrick, J., Lang, R., Sorrentino, M., and
Williams, K. The effect of preoperative statin therapy on cardiovascular outcomes in patients undergoing infrainguinal vascular surgery. Int J Cardiol. 104(3)
(2005), 264–8.
[63] Waters, D., Ganz, P., Amarenco, P., and Pedersen, T. Le point sur la
situation : un forum sur le traitement avec des statines et les études cliniques sur
ces médicaments. Actu. Scientifiques . (2005), .
[64] Whitfield, M., Gillett, M., Holmes, M., and Ogden, E. Predicting the
impact of population level risk reduction in cardio-vascular disease and stroke on
acute hospital admission rates over a 5 year period - a pilot study. P. Health
120(12) (2006), 1140–1148.
[65] Zhou, Z., Rahmane, E., and Pilote, L. Association between time of statin
initiation after hospital discharge from acute myocardial infarction and risk of
recurrence and mortality in patients > or =65 years of age. A.J. Cardiol 97(2)
(2006), 155–159.
c modou sene
Ulaval_2012
56
ANNEXE
Annexe A : figures
Figure 1 – Classification TNM
Figure 2 – Stadification
Figure 3 – Tumeur - ganglion - métastase
BIBLIOGRAPHIE
Figure 4 – Récidive : forme fonction-
Figure 5 – Récidive : Transformation
nelle âge
de âge en âge2
Figure 6 – Progression : forme fonc-
Figure 7 – Progression : forme fonc-
tionnelle âge
tionnelle âge
Figure 8 – Décès : forme fonctionnelle
Figure 9 – Décès : forme fonctionnelle
âge
nbr_hosp
c modou sene
Ulaval_2012
58
BIBLIOGRAPHIE
Figure 10 – Récidive : HP pour âge2
Figure 11 – Récidive : HP pour le sexe
avec les résidus de Schoenfeld
avec les résidus de Schoenfeld
Figure 12 – Progression : Hypothèse
Figure 13 – Progression : Hypothèse
de proportionnalité pour le sexe avec LLS
de proportionnalité pour l’âge avec le
processus du score
Figure 14 – Progression : HP pour
Figure 15 – Progression : HP pour le
âge avec les résidus de Schoenfeld
sexe avec les résidus de Schoenfeld
c modou sene
Ulaval_2012
59
BIBLIOGRAPHIE
Figure 16 – Décès : Hypothèse de proportionnalité pour l’âge avec LLS
Figure 18 – Décès : Hypothèse de pro-
Figure 17 – Décès : Hypothèse de proportionnalité pour l’âge avec les résidus
de Schoenfeld
Figure 19 – Décès : Hypothèse de pro-
portionnalité pour le sexe avec LLS
portionnalité pour le sexe avec le processus du score
Figure 20 – Décès : Hypothèse de pro-
Figure 21 – Décès : Hypothèse de pro-
portionnalité pour le sexe avec les résidus
de Schoenfeld
portionnalité pour le cds avec les résidus
de Schoenfeld
c modou sene
Ulaval_2012
60
BIBLIOGRAPHIE
Figure 22 – Décès : Hypothèse de proportionnalité pour hosp avec LLS
Figure 23 – Décès : Hypothèse de proportionnalité pour hosp avec les résidus
de Schoenfeld
Figure 24 – Pondération pour les 30 jours pour chaque approche
c modou sene
Ulaval_2012
61
BIBLIOGRAPHIE
Annexe B : tables
Table 2 – Selction des cohortes
Patients in provinceof Quebec with a billing code and a diagnosis of bladder cancer
st
st
between July 1 1995 and March 31 2002
n = 208 597
Adults patients (age>=18 years) with at least one TURBT
and with a minimum of 6 months of follow-up
n = 12 477
Excluded:
- 618 patients without bladder cancer diagnosis
- 980 patients without cystoscopy or procedure billing code after the initial (index) TURBT
Adult patients with a bladder cancer diagnosis
and appropriate follow-up after the initial TURBT
n = 10 879
Excluded:
- 3498 patients without cystoscopy between 3 and 24 months before index TURBT
Adult patients with only one recent diagnostic cystoscopy
n = 7381
Excluded:
- 61 patients with TURBT or cystectomy or intravesical therapy within 2 years before index
TURBT
- 1943 patients with a diagnosis of malignant neoplasia within 2 years before index TURBT
- 4 patients with chemotherapy of radiotherapy within 2 years before index TURBT
Adult patients with incident bladder cancer without history of another cancer
n = 5373
Excluded:
- 433 patients with cystectomy within 6 months following index TURBT
- 163 patients with chemotherapy or radiotherapy within 6 months following index TURBT
Patients with incident superficial bladder cancer only
n = 4777
Excluded:
- 1740 patients with incomplete or absent drug coverage for the year before index TURBT
Patients with adequate drug information for the year before index TURBT
n = 3037
Exclusion ofpatients with incomplete drug coverage for entire follow-up duration
Excluded: 131 patients
Cohort for bladder cancer
recurrence
n = 2905
c modou sene
Excluded: 181 patients
Cohort for bladder cancer
progression
n = 2856
Ulaval_2012
Excluded: 181 patients
Cohort for death from all causes
n = 2856
62
BIBLIOGRAPHIE
Table 3 – Caractéristiques des patients
c modou sene
Ulaval_2012
63
BIBLIOGRAPHIE
Table 4 – Risques relatifs (RR) pour la récidive
Table 5 – Risques relatifs (RR) pour la progression
Table 6 – Risques relatifs (RR) pour le décès toutes causes
c modou sene
Ulaval_2012
64
BIBLIOGRAPHIE
Table 7 – Récidive : test global de nul-
Table 8 – Progression : test global de
lité des coefficients
nullité des coefficients
Table 9 – Décès : test global de nullité des coefficients
c modou sene
Ulaval_2012
65
BIBLIOGRAPHIE
Table 10 – Extrait du codes SAS pour l’issue décès
c modou sene
Ulaval_2012
66
BIBLIOGRAPHIE
Table 11 – Codes SAS pour l’issue décès (suite)
c modou sene
Ulaval_2012
67
BIBLIOGRAPHIE
Table 12 – Codes SAS pour l’issue décès (suite et fin)
c modou sene
Ulaval_2012
68