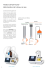La titration, un peu de théorie
Transcription
La titration, un peu de théorie
110 La titration. Un peu de théorie Les titrations classiques A point final L’appareil ajoute du réactif jusqu’à atteindre une valeur de pH ou mV sélectionnée au préalable. Cette méthode est généralement appliquée dans des normes d’analyses pour lesquelles une valeur de point final est spécifiée ou lors de l’adaptation d’une méthode avec un indicateur optique. La titration est la détermination quantitative d’une substance au moyen de sa réaction avec une substance connue, un réactif titrant. aA + bB cC Avec la gravimétrie, c’est l’une des méthodes d’analyse les plus anciennes connues. La titration s’utilise comme méthode standard d’analyse quantitative. Ses avantages par rapport à d’autres techniques sont les suivantes: - C’est une méthode directe. - Elle est exacte et reproductible. Dans des conditions optimales, mieux que 0,1 %. - Elle peut être automatisée. Elle permet d’analyser aussi bien un échantillon qu’une série. �� � � �� ��� � � ������ � La titration potentiométrique La méthode d’indication classique était le changement de couleur d’un indicateur. À l’heure actuelle, la méthode d’indication la plus utilisée est la méthode potentiométrique. L’électrode utilisée dépend de la réaction (pH, métallique, spécifique, etc). �� ������ � Figure A. Titration avec indicateur optique, phénolphtaléine. Exemple: standardisation de HCl avec NaOH. Commentaires: Le volume de réactif titrant consommé doit être élevé. Le point de virage (?) est très subjectif. Temps de titration court pour experts. Figure B. Titration PF potentiométrique. Exemple: standardisation de HCl avec NaOH. 1- Ajout initial rapide. 2- Ajout lent dans la zone de rapprochement. 3- Détermination exacte du volume au point final. 4- Consommation d’un faible volume de réactif. Le titrateur potentiométrique actuel Cet appareil combine différents éléments pour automatiser les titrations potentiométriques. Localisation de points d’équivalence L’appareil analyse la variation de potentiel générée par les ajouts successifs de réactif titrant sur l’échantillon et, à partir de ces données, il localise le point d’équivalence. Ce type de titration s’applique à l’étude d’échantillons inconnus, à la détermination de composants d’un échantillon, à la détermination d’un ou de plusieurs points d’équivalence, etc. Parties principales - Capteurs: électrodes de pH, redox, ISE, etc. sonde de température (CAT). - Mesureur-contrôleur du processus. - Burette ou burettes pour l’ajout de réactif titrant ou d’autres réactifs. - Agitateur: magnétique ou à tige. ��� � Accessoires utiles - imprimante pour l’enregistrement des résultats; - ordinateur pour stocker les données et les traiter; - pompes péristaltiques auxiliaires pour traiter préalablement les échantillons ou augmenter le degré d’automatisation; - passeur automatique d’échantillons pour automatiser l’analyse consécutive de plusieurs échantillons. �� � �� � � �� �� � �� � � �� ������ � �� ������ � �� Figure A. Titration potentiométrique manuelle Exemple: détermination de la présence de chlorures dans l’eau. - Temps d’analyse long. - Faible définition de la courbe. Difficile localisation de l’inflexion. Figure B. Titration potentiométrique automatique. Localisation du point d’inflexion. Exemple: détermination de la présence de chlorures dans l’eau. 1- Ajout initial rapide. 2- Ajout lent pour définir avec exactitude la zone d’inflexion. 3- La titration se termine après la localisation du point d’inflexion. Cela représente : un gain de réactif et de temps. Catalogue de Laboratoire 2004 1ère Edition 111 pH-stat C’est une variante de la titration au point final appliquée à l’analyse cinétique. Les informations relatives à la cinétique de la réaction sont extraites de la consommation de réactif titrant en fonction du temps. �� �� � � �� � ����� Exemple: contrôle d’un antiacide La procédure automatique suit les étapes suivantes: - Pré-titration pour neutraliser le substrat - Stabilisation du milieu - Introduction de l’échantillon et début du processus - Évolution du pH Titration Karl Fischer Titration au point final adaptée à la réaction spécifique de Karl Fischer pour déterminer le contenu en eau d’une substance. Le système de détection utilisé dans ce cas est le système bipotentiométrique, qui se fonde sur la mesure du potentiel en appliquant un courant constant entre deux électrodes en platine. � �� �� ��� �� ��� � �� � �� � �� � ����� � �� Exemple: contrôle de l’humidité d’un dissolvant. 1- Ajout initial rapide jusqu’à ce que le potentiel subisse une forte diminution. 2- Ajout à vitesse moyenne. 3- Ajout à vitesse lente, jusqu’à la fin. Catalogue de Laboratoire 2004 1ère Edition Productivité Le niveau d’automatisation d’un système complet de titration automatique se traduit immédiatement par un important gain de temps pour l’utilisateur et l’obtention rapide de résultats. Économie L’utilisation de burettes de haute précision permet de réduire fortement la consommation d’échantillons et de réactifs. Avec un titrateur automatique, l’utilisateur n’a plus à effectuer les tâches quotidiennes et peut se consacrer davantage aux tâches plus créatives. � �� � ����� Pourquoi utiliser un titrateur automatique ? Qualité et sécurité À l’heure actuelle, un titrateur n’est pas simplement un appareil servant à effectuer une titration. C’est un outil indispensable pour les laboratoires analytiques pour lesquels la qualité est essentielle et qui doivent travailler conformément aux recommandations GLP.
Documents pareils
HI 901 • HI 902
 L'entretien de la burette est simple et
complètement automatique: à vous de
décider de la vider ou de la laver et
combien de lavages elle doit exécuter.
Grâce au système novateur Clip Lock™
pour la...
L'entretien de la burette est simple et
complètement automatique: à vous de
décider de la vider ou de la laver et
combien de lavages elle doit exécuter.
Grâce au système novateur Clip Lock™
pour la...