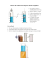La vitesse de réaction :aspect quantitatif La réaction entre le
Transcription
La vitesse de réaction :aspect quantitatif La réaction entre le
La vitesse de réaction :aspect quantitatif La réaction entre le magnésium et l’acide chlorhydrique a lieu selon l’équation suivante : Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g) La réaction dégage un gaz, l’hydrogène. On peut déterminer la vitesse de la réaction en mesurant la quantité d’hydrogène produite à des intervalles de temps précis. Matériel : -Grosse éprouvette avec un bouchon à un trou ou un erlenmeyer de 150ml avec un bouchon à un trou. -Tube de verre pour insérer dans le bouchon à un trou -Tube à dégagement gazeux (en caoutchouc ou en latex) -Cylindre gradué de 100ml -0,30g de tournures de magnésium -25ml d’acide chlorhydrique à 0,5mol/L -Chronomètre -Bassin ou chaudière Protocole : -Verse l’acide chlorhydrique dans l’éprouvette ou l’erlenmeyer. -Remplis le bassin ou la chaudière d’eau au 2/3. -Remplis le cylindre de 100ml avec l’eau du bassin et inverse-le dans le bassin en s’assurant qu’il n’y aura pas de bulles dans le cylindre. -Installer un tube de verre dans le trou du bouchon à un trou et y fixer le tube à dégagement gazeux. -Insérer l’extrémité libre du tube dans le cylindre gradué qui servira à récolter le gaz. -Lorsque vous êtes prêts à commencer, déposez le 0,30g de tournures de magnésium, fermez l’éprouvette avec le bouchon-tube et partez le chronomètre à la première bulle de gaz qui se forme dans le cylindre. (Le gaz formé va faire déplacer l’eau du cylindre). -Notez le volume de gaz dans le cylindre gradué à toutes les 20 secondes. -Recommencez l’expérience 2 fois et garde les résultats de l’expérience qui a le mieux fonctionné. Résultats : Temps (sec) Volume de gaz mesuré (ml) Volume de gaz mesuré (ml) Essai 1 Essai 2 0 20 40 60 80 100 120 140 160 180 Analyse : 1) Trace le graphique du volume (ml) en fonction du temps (s) 2) Calcule la vitesse moyenne de la réaction pour les 80 premières secondes. 3) Trace une tangente au point 100 secondes et calcule la pente de cette tangente. Détermine la vitesse instantanée à ce point. 4) Est-ce que la vitesse de la réaction est constante? Explique le type de courbe que tu as obtenu.