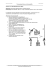Herstellung von Buttersäureestern ohne Buttersäure
Transcription
Herstellung von Buttersäureestern ohne Buttersäure
1. EINLEITUNG 1 2. BUTTERSÄUREESTER 2 2.1 Carbonsäureester 2 2.2 Vorkommen 3 2.3 Verwendung 3 2.4 Nachweise 2.4.1 Nachweisverfahren „Rojahn-Test“ 2.4.2 Ester in Ananassäften 2.4.3 Ester in Ananasbonbons 4 4 4 5 3. HERSTELLUNG 7 3.1 Versuche 3.1.1 Buttersäureesterherstellung mit Natriumbutyrat 3.1.1.1 Versuchsaufbau 3.1.1.2 Durchführung 3.1.1.3 Erklärung 3.1.2 Buttersäureesterherstellung mit Buttersäurechlorid 3.1.2.1 Versuchsaufbau 3.1.2.2 Durchführung 3.1.2.3 Erklärung 7 7 7 7 8 10 10 10 11 3.2 Buttersäureesterherstellung mit Buttersäure 11 3.3 Vergleiche der Herstellungsmethoden 12 4. FAZIT 14 1. Einleitung Das Thema meiner Facharbeit lautet „Herstellung von Buttersäureestern ohne Buttersäure“. Diese Formulierung beinhaltet, dass die übel riechende Butansäure kein Bestandteil meiner Experimente sein sollte. Anstelle der Säure musste ich also Derivate i der gleichen benutzen. Den Schwerpunkt meiner Arbeit legte ich auf die Herstellung des, nach Ananas duftenden, Buttersäureethylester. Dazu führte ich zwei Versuche durch. In dem ersten Versuch benutzte ich das Natriumsalz der Buttersäure, als Zweites erprobte ich die Alkoholyse des Buttersäure-Chlorids zur Herstellung des Esters. Zur Einführung in das Problem dienen allgemeine Angaben zu dem Thema Buttersäureester. Außerdem wird eine wichtige EsterNachweisreaktion vorgestellt. Mein Ziel ist es, dass Leser meiner Facharbeit interessante und lebensnahe Informationen über die Ester der Buttersäure erfahren, welche zwar in vielen Alltagsgegenständen vorkommen, dennoch kaum jemand über ihre Existenz bescheid weiß. Derivat=[lateinisch derivare, „ableiten“]eine chemische Verbindung, die aus einer anderen durch Ersatz (Substitution) von Atomen durch andere Atome oder Atomgruppen abgeleitet und dargestellt werden kann. (www.wissen.de) i 1 2. Buttersäureester 2.1 Carbonsäureester Carbonsäureester entstehen aus der Reaktion von Carbonsäuren mit Alkoholen unter Abspaltung von Wasser (Kondensationsreaktion). Die Esterbildung verläuft umkehrbar und führt normalerweise zu Gleichgewichten, in welchen sowohl Alkohol und Säure, wie auch Ester und Wasser vorhanden sind (Hydrolyse). Durch Zugabe von Schwefelsäure lässt sich die Kondensationsreaktion beschleunigen; zur Hydrolyse wird häufig Natronlauge verwendet. Bei der Veresterung handelt es sich um eine nucleophile Addition, in der sich zuerst ein Alkoholmolekül an das positiv polarisierte Kohlenstoffatom der Carboxylgruppe anlagert.1 ) O R C + (H+) H OH OR1 O R C + H2O OR 1 Abb.: Vereinfachte Darstellung einer direkten Veresterung freier Säuren mit Hilfe einer Katalysatorsäure 16) Die Ester der Carbonsäuren sind auf Grund des enthaltenen Sauerstoffs polar. Durch den abgespaltenen Wasserstoff der Carbonsäure, sind die Ester nicht sauer. Untereinander bilden sie keine Wasserstoffbrückenbindungen aus, daher ist ihr Siedepunkt, im Vergleich zu Alkoholen und Carbonsäuren vergleichbarer Molekülmasse, wesentlich niedriger und sie sind dadurch relativ flüchtig. Ester haben auf Grund ihres polaren Carbonyl-Sauerstoffs eine geringe Wasserlöslichkeit, welche mit steigender molarer Masse abnimmt. Allgemein werden Ester als hydrophob bezeichnet.11)14) Carbonsäureester können in verschiedenen Formen vorliegen. Dabei führen kurzkettige Carbonsäuren bei der Veresterung zu Lösungsmitteln und angenehm riechenden Aromastoffen. Zu dieser Gruppe gehören unter anderem die Ester der Buttersäure. Fette entstehen durch die Veresterung langkettiger Carbonsäuren mit dem dreiwertigen Alkohol Glycerin. Ester 2 aus langkettigen Alkoholen und Carbonsäuren formen die Gruppe der Wachse.1)2)11) Buttersäureester, Butansäureester oder auch Butyrate bilden sich durch die Veresterung von Buttersäure mit einem einwertigen Alkohol. Die „ölige, unangenehm ranzig riechende Flüssigkeit“3)(S.534) reagiert dabei zu „sehr angenehm fruchtartig riechenden“3)(S.535) Substanzen. 2.2 Vorkommen Ester der Buttersäure haben ein geringes Vorkommnis in der Natur. In kleinen Mengen treten sie oder andere Carbonsäureester in reifen Früchten auf und bilden eine Komponente des jeweiligen Aromas.11) Außerdem sind sie in Pastinaken enthalten, welche eine Gruppe in der Familie der Doldengewächse bilden.14) Im Allgemeinen entstehen Ester in Pflanzen bei dem Abbau organischer Säuren.11) Das Vorkommen von Buttersäureestern in Butter wurde bereits im Jahre 1823 von Eugène Chevreuil (1786 - 1889), einem französischen Chemiker, festgestellt.4) 2.3 Verwendung Die niedermolaren Ester der Buttersäure werden auf Grund ihres häufig fruchtigen Geruchs hauptsächlich zur Herstellung von Aromastoffen für Lebensmittel und Parfüme verwendet. Dabei bilden meist erst mehrere Ester gemeinsam oder Ester in Verbindung mit Terpenen oder Aldehyden ein bestimmtes Aroma.3)14) Eines der meist verwendeten Buttersäureester ist das Ethylbutyrat (Buttersäureethylester). Es ist eine wichtige Komponente in zahlreichen Aromastoffen. Jährlich werden mehrere Tonnen dieses Esters hergestellt und verarbeitet.15) Bei der Produktion von Margarine werden Buttersäureester im letzten Herstellungsschritt künstlich hinzugesetzt7), um dem Vorbild der echten Butter möglichst nahe zu kommen. Ebenfalls finden sie Verwendung in der Lösungsmittel-, Likör- und Essenzenindustrie.3) 3 Höhermolare Buttersäureester haben hingegen WeichmacherEigenschaften und werden demnach oft als Weichmacher in Elektrokabeln verwendet. Dadurch lassen sich auch Fraßschäden in der Elektrik von Autos erklären, da besonders Nagetiere den Geschmack einiger Weichmacher häufig als angenehm süß empfinden.3)14) 2.4 Nachweise 2.4.1 Nachweisverfahren „Rojahn-Test“ 10) 12) Der so genannte Rojahn-Test ist ein Nachweis alkalisch verseifbarer Verbindungen, wie, in meinem Fall, zum Beispiel für Ester. Zunächst gibt man ein bis drei Milliliter der Prüfsubstanz in ein Reagenzglas. Liegt ein Ester in reiner Form vor, gibt man zunächst etwa drei Milliliter Ethanol hinzu. In das Reagenzglas werden dann drei Tropfen des Indikators Phenolphthalein gegeben, welcher sich im alkalischen Milieu (pH-Wert ≥9) rosa färbt. Daraufhin gibt man Tropfenweise Natronlauge unter ständigem Schütteln hinzu, bis der Indikator umschlägt und eine dauerhafte RosaFärbung eintritt. Das Reagenzglas wird nun in ein vorbereitetes Wasserbad von 40°C bis 90°C Wärme gestellt. In regelmäßigen Abständen sollte das Reagenzglas zum vorsichtigen Schütteln aus dem Bad genommen werden. Bei einer Anwesenheit von Estern sollte sich die Lösung nach höchstens 20 Minuten entfärbt haben. Grund ist, dass der vorhandene Ester durch die Natronlauge irreversibel verseift wird (alkalische Esterverseifung). Dabei greifen die Hydroxid-Ionen die Estermoleküle nucleophil am Carbonyl-Kohlenstoff-Atom an. Darauf folgen die Abspaltung des entstandenen Alkoholat-Ions und die daraus hervorgehende Bildung der Carbonsäure. Der unumkehrbare Schritt der Verseifung findet mit dem Protonübergang vom Carbonsäuremolekül auf das Alkoholat-Ion statt. Das alkalische Milieu wird von den Produkten der Hydrolyse wieder neutralisiert, der Indikator entfärbt sich. 2.4.2 Ester in Ananassäften Um nachzuweisen, dass Fruchtsäfte häufig Carbonsäureester enthalten, die für das jeweilige Aroma sorgen, habe ich zwei verschiedene 4 Ananassaftproben mit Hilfe des „Rojahn Testes“ auf Ester überprüft. Meine beiden Proben waren zum einen Ananasnektar i mit einem 50prozentigen Fruchtanteil und Ananassaft ii mit einem 100-prozentigen Fruchtgehalt. In je ein Reagenzglas gab ich ein Milliliter der verschiedenen Ananassäfte zusammen mit drei Tropfen Phenolphthalein. Die gelbliche Färbung des Safts und die Trübe waren im Vergleich zum Nektar viel intensiver, was auf den höheren Fruchtanteil im Saft zurückzuführen ist. Unter ständigem Schütteln gab ich dann tropfenweise Natronlauge in die Reagenzgläser und zwar gerade soviel, dass der Indikator die Lösung dauerhaft rosa färbte, welches jeweils nur zwei Tropfen der Lauge bedurfte. Auf Grund der Ausgangsfarben verfärbte sich der Nektar in das für Phenolphthalein charakteristische pink und der Saft orange. Nun stellte ich die beiden Reagenzgläser in das vorbereitete, ca. 70°C warme Wasserbad. iii Alle zwei bis drei Minuten nahm ich die Reagenzgläser kurz heraus, um sie zu schütteln. Als nach ungefähr zwölf Minuten noch keine Veränderung zu beobachten war, erhitzte ich das Wasserbad auf 90°C. Erst nach insgesamt 20 Minuten ließ sich bei dem Ananassaft eine deutliche Verblassung zurück in Richtung Ausgangsfarbe feststellen. Die „Nektarlösung“ hatte sich nach der gleichen Zeit nur sehr gering entfärbt. Nach 30 Minuten hatte die „Saftlösung“ fast ihre Ausgangsfarbe erreicht, die Nektarlösung hatte sich von pink in orange verfärbt. Daraus schloss ich, dass beide, Ananassaft und Nektar, Ester enthalten. Dabei scheint eine höhere Esterkonzentration in dem reinen Fruchtsaft enthalten zu sein, was wiederum darauf schließen lässt, dass die Ananasfrucht Ester bildet, wobei es sich um zumindest eine Komponente des Aromas handelt. Leider konnte ich durch die eingeschränkten Möglichkeiten in unserem Schullabor nicht genauer feststellen, welche Ester in den Proben vorlagen. Dies wäre nur mithilfe eines Gaschromatographen möglich gewesen. 2.4.3 Ester in Ananasbonbons iv Für den Nachweis von Fruchtestern in Ananasbonbons führte ich den Rojahn-Test in etwas abgeänderter Form durch. Hierzu löste ich ein i „Gut & Günstig Ananasnektar“ aus Ananassaftkonzentrat, Fruchtgehalt: mind. 50% „Edeka Rio Grande Premium Ananassaft“ 100% Direktsaft iii Siehe Bild zum Versuchsaufbau im Anhang iv Ananasbonbons „California Früchte“ von Storck ii 5 Bonbon zunächst in ungefähr 50 Millilitern heißem Wasser auf. Daraufhin gab ich vier Zentimeter der hellgelben, klaren Bonbonlösung in ein Reagenzglas und fügte vier Tropfen Phenolphthalein hinzu und danach drei Tropfen Natronlauge, welche die Lösung dauerhaft rosa färbten. Das Reagenzglas stellte ich dann in ein 90°C warmes Wasserbad und nahm es gelegentlich zum Schütteln heraus. Anders als bei den Säften, konnte ich bereits nach vier Minuten ein deutliches Erblassen der Flüssigkeit feststellen. Nach etwa sieben Minuten hatte sich die anfangs rosafarbene Lösung in orange verfärbt und nach nicht mehr als zehn Minuten glich die Färbung wieder der reinen Bonbonlösung. Der Nachweis von Estern im Ananasbonbon war also erfolgreich. An dieser Stelle ist anzumerken, dass von der Ananasbonbonlösung, entgegen meiner Erwartungen, kein charakteristischer Ananasgeruch ausging. Mehrere Riechtests meiner Mitschüler zeigten, dass die Bonbonlösung vielmehr nach Zitronenaroma roch. Leider muss ich jedoch wieder darauf hinweisen, dass ich ohne einen Gaschromatographen nicht bestimmen konnte, welche Ester in dem Bonbon vorlagen. Es ist also denkbar, dass es sich bei den von mir nachgewiesenen Estern nicht um Buttersäureester, sondern möglicherweise um Essigsäureester handelte. 6 3. Herstellung 3.1 Versuche 3.1.1 Buttersäureesterherstellung mit Natriumbutyrat 3.1.1.1 Versuchsaufbau Ich beschloss meinen Versuch sicherheitshalber unter dem Abzug durchzuführen, da es, obwohl Buttersäure nicht in reiner Form vorlag, zu einem unangenehmen Geruch kommen konnte. Eine Heizplatte versah ich mit einem halbrunden Aufsatz, der die Hitze und den Magnetismus weiterleitete. Dadurch konnte ich ein besseres Erhitzen der Substanzen, die gemeinsam mit einem Magnetrührer in einen Rundkolben gegeben werden sollten, ermöglichen. In Höhe des Rundkolbenmundes schloss ich einen Rückflusskühler an, welcher bei einem Sieden der Substanzen für das Auffangen und Kondensieren der Gase sorgen sollte. i 3.1.1.2 Durchführung In den mit einem Magnetrührer ausgestatteten Rundkolben (250 ml) gab ich zunächst drei Gramm des stark sauren Kationenaustauschers, Amberlite® IR 120 von Merck. Ein Gramm Natriumbutyrat und zehn Milliliter Ethanol vermischte ich zunächst in einem Becherglas, da die beiden Substanzen untereinander nicht reagieren würden. Diese Mischung gab ich daraufhin zu dem Ionenaustauscher in den Rundkolben, welchen ich sofort an den Rückflusskühler schraubte. Wasser wurde zu diesem Zeitpunkt noch nicht eingefüllt. Ich wollte ein mögliches Austreten des üblen, nach „Erbrochenem“ riechenden, Geruchs des Zwischenprodukts, Buttersäure, vermeiden. Das Austauscherharz sollte ich darauf zusammen mit dem Buttersäuresalz und dem Alkohol bis zum Sieden erhitzen und für 15 Minuten unter Rückfluss kochen. Dabei ergab sich das Problem, das ich nach 25 Minuten noch immer kein Siedeverhalten der Flüssigkeit feststellen konnte. Ich beschloss also, da ich davon ausging, dass das Gemisch bereits hohe Temperaturen erreicht haben müsste, den Rückflusskühler an das Wasser anzuschließen um die i Siehe Bild zum Versuchsaufbau im Anhang 7 entstehenden Gase abzukühlen und kondensieren zu lassen. Kurze Zeit später konnte ich bei einem Abstellen des Magneten eine Siedeverzugähnliche Reaktion beobachten. Dies wies darauf hin, dass die Flüssigkeit ihren Siedepunkt bereits überschritten hatte. Bereits wenige Sekunden nach Anschließen des Rückflusskühlers wurde das Kondensieren von Gasen am Kolbenrand in Form von Tropfen sichtbar. Ich ließ ich den Versuch noch etwa 15 Minuten weiterlaufen. Danach stellte ich die Heizplatte aus und befestigte den Rückflusskühler gemeinsam mit dem Kolben höher, sodass der Kolben aus dem Aufsatz gehoben wurde und keiner direkten Hitze mehr ausgesetzt war. Nach kurzem Warten, stellte ich die Rückflusskühlung ab und verschloss den Kühler mit einem Pfropfen, um sicherzugehen, dass bis zum nächsten Tag keine Gase austreten konnten. Das gründliche Abkühlen des Gemisches und das spätere Verdünnen waren für die Geruchsprobe wichtig, denn „heiß und hochkonzentriert riechen auch die Fruchtester wie technische Lösemittel. Außerdem ist diese Art von Probe gesundheitsschädigend.“6) Die Geruchsprobe zeigte leider, dass mein Versuch nicht wie vorgesehen funktioniert hatte. Zwar stieg mir zunächst ein leicht fruchtiger Geruch in die Nase, doch darauf folgte unverkennbar der charakteristische Geruch der Buttersäure, wenn auch nicht sehr konzentriert. Die folgenden Stunden versuchte ich den Versuch durch Zugabe von Ethanol, und später auch Kationenaustauscher, zu retten. Als ich den Versuch schon lange beendet hatte und das Gemisch in dem Kolben neun Tage später schließlich entsorgen wollte, zeigte jedoch ein weiterer Geruchstest, dass sich eindeutig ein Buttersäureethylester gebildet hatte. 3.1.1.3 Erklärung Ich ging davon aus, dass der Kationenaustauscher Amberlite®IR 120 konfektioniert, also in Wasserstoffform, vorlag. In diesem Zustand ist er im Stande, die Wasserstoff-Ionen gegen die in dem Natriumbutyrat, beziehungsweise Buttersäure Natriumsalz, enthaltenen Natrium-Ionen auszutauschen. Abb.6) 8 Buttersäure war bei diesem Versuch zwar als Zwischenprodukt vorgesehen, welches jedoch sofort mit dem Ethanol zu Buttersäureethylester hätte weiterreagieren sollen. Der Kationenaustauscher war auf Grund seiner sauren Wirkung ein Katalysator dieser Reaktion. Abb.6) Es sind mehrere Fehlerquellen denkbar, welche dazu geführt haben könnten, dass der Versuch nicht wie vorgesehen ablief. Es ist möglich, dass ich die Mengenangaben nicht genau eingehalten habe, was leicht durch Rückstände der Chemikalien in den jeweiligen Gefäßen, die ich zum Abmessen benutzte, zustande gekommen sein kann. Durch zu viel Natriumbutyrat im Verhältnis zum Ethanol wäre es wahrscheinlich, dass nicht alle Buttersäuremoleküle mit dem Alkohol verestert werden konnten. Die Benutzung von wenig Kationenaustauscher hätte ebenfalls dazu führen können, dass nicht alle Natrium-Ionen von der Buttersäure hätten gespalten werden können. Feuchtes Buttersäurenatriumsalz hat auch den für Buttersäure typischen unangenehmen Geruch. Auf Grund des nicht zu beobachtenden Moments des Siedebeginns ist es ebenfalls möglich, dass das Gemisch zu kurz erhitzt wurde, denn „die Veresterung ist eine sehr langsame Reaktion und ist ohne Katalysatoren auch unter Rückfluss erst nach langer Zeit beendet“16) Die Esterbildung im Laufe mehrerer Tage zeigte, dass die Gleichgewichtskonstante dieser Reaktion eindeutig auf Seiten der Produkte liegen muss. Nach neun Tagen konnte ich davon ausgehen, dass sich ein Gleichgewicht eingestellt hatte. Die Geruchsprobe unterstützte diesen Verdacht, da sowohl der Geruch des wohlriechenden Esters Ethylbutyrat, als auch der, der übel riechenden Buttersäure wahrgenommen werden konnte. Da der Ananasgeruch jedoch eindeutig dominant war, gehe ich davon aus, dass sich die Gleichgewichtskonstante dieser Reaktion auf Seiten der Produkte befand. 9 3.1.2 Buttersäureesterherstellung mit Buttersäurechlorid 3.1.2.1 Versuchsaufbau Die Vorbereitungen zu diesem Versuch stellten keinen großen Aufwand dar. Unter dem Abzug stellte ich einen Gasbrenner mit Dreifuß und Astbestnetz auf, um die Flüssigkeit später in einem Becherglas zu erhitzen. Des Weiteren stellte ich lediglich die beiden Substanzen, Ethanol und Buttersäurechlorid, gemeinsam mit zwei 50-Milliliter-Bechergläsern und einem etwas größerem Becherglas bereit. 3.1.2.2 Durchführung Von beiden Flüssigkeiten gab ich eine geringe Menge, ungefähr zehn bis 18 Milliliter, in jeweils ein Becherglas. Dabei beschloss ich ein wenig mehr Ethanol als Chlorid zu benutzen. Da ich nicht genau wusste, wie die beiden Substanzen miteinander reagieren würden, gab ich die beiden Substanzen zusammen in ein Becherglas. Bevor ich das Gemisch jedoch erhitzen konnte, reagierten die beiden Stoffe bereits exotherm miteinander. Ein kurzes Sieden der Flüssigkeit wurde sichtbar und durch das Fühlen an dem Becherglas wurde eine eindeutige Erwärmung spürbar. Den gleichen Versuch führte ich mit ähnlichen Mengen und anstelle von Ethanol mit Methanol durch. Zwar verlief die Reaktion ähnlich, jedoch erwärmte sich das Gemisch, im Vergleich zum ersten Versuch, nicht so stark. Für eine Geruchsprobe gab ich wenige Tropfen beider Flüssigkeiten in je ein Becherglas mit Wasser. Beide Veresterungsreaktionen schienen demnach stattgefunden zu haben. Dennoch konnte nur der Geruch des Buttersäureethylesters nach Ananas, eindeutig bestimmt werden. Der Buttersäuremethylester, von dem eigentlich ein Apfelaroma hätte ausgehen sollen8), roch leider nur leicht fruchtig und mehr nach Lösungsmittel. Viele Behauptungen, Buttersäuremethylester sei der „Ananasester“13), konnten durch dieses Experiment widerlegt werden. 10 3.1.2.3 Erklärung Meine Entscheidung, mehr Ethanol als Buttersäurechlorid zur Versuchsdurchführung zu benutzen, basierte auf dem Gedanken sicherstellen zu können, dass alle entstehenden Buttersäuremoleküle mit dem Alkohol reagieren würden. Carbonsäurechloride bilden die reaktivste Gruppe der CarbonylVerbindungen. Das Kohlenstoffatom der Carbonylgruppe ist auf Grund des negativ induktiven Effekts des Chloratoms positiv polarisiert. Bei Zusammengabe des Buttersäurechlorids mit dem Ethanol spaltet sich das Chlorid-Ion ab und geht eine kovalente Bindung mit dem leicht positiv polarisierten Wasserstoffatom der Hydroxylgruppe des Ethanols ein. Das übrig bleibende Ethanolat bindet sich daraufhin sofort mit dem positiv polarisierten Kohlenstoffatom der Carbonylgruppe. Diese Reaktion verläuft im Gegensatz zu einer normalen Veresterung irreversibel. Die entstehende Salzsäure ist sehr flüchtig, wodurch der reine Ester zurückbleibt. Dieser kann ohne die Zugabe von Wasser nicht zurückreagieren. Abb.: Carbonsäurechlorid reagiert mit einem Alkohol zu einem Ester und Salzsäure 3.2 Buttersäureesterherstellung mit Buttersäure Die herkömmliche Herstellungsmethode der Buttersäureester ist die einfache Veresterung der Buttersäure mit einem Alkohol. Diese Reaktion wird häufig durch Schwefelsäure katalysiert. Abb.: Buttersäure und Ethanol reagieren zu Buttersäureethylester und Wasser9) 11 Die Durchführung der Reaktion minimiert sich auf das Zusammengeben von Buttersäure und, wie in diesem Fall, Ethanol im stöchiometrischen Verhältnis. Dazu werden lediglich einige Tropfen Schwefelsäure gegeben. Darauf folgt ein kurzes Erhitzen der Lösung in einem rund 70°C warmen Wasserbad, oder bei geringen Mengen in einem Reagenzglas, über einem Gasbrenner. Nach dem Erhitzen lässt man die Flüssigkeit in einem geschlossenen Behälter abkühlen, bevor eine Geruchsprobe durchgeführt werden kann.5) 3.3 Vergleiche der Herstellungsmethoden Die verschiedenen Buttersäureesterherstellungsmethoden haben Vor- und Nachteile. Ein großer Vorteil der Herstellung mit Natriumbutyrat war, dass sich bei dem Ansetzen des Versuchs keine Geruchsprobleme ergaben. Dies gilt nicht für die Herstellungsweise mit Buttersäurechlorid. Beschrieben wird die Substanz zwar als durchsichtige Flüssigkeit, von der ein stechender Geruch ausgeht, letztendlich stellte sich jedoch heraus, dass der Geruch des Derivates dem der reinen Buttersäure sehr ähnlich war. Dennoch halte ich den Versuch mit dem Chlorid für „klassenraumtauglich“, da es unmittelbar beim Zusammengeben mit dem Ethanol anfing zu reagieren und der üble Geruch verschwand. Bereits nach sehr kurzer Zeit verbreitete sich ein angenehm fruchtiger Geruch. Auf Grund zu starker Geruchsbelastung führte ich die Veresterung der reinen Buttersäure mit Ethanol nicht durch. In der Industrie ist der strenge Geruch der Säure jedoch kein Kriterium dafür, auf eine andere Herstellungsmethode umzusteigen. Am wenigsten Zeit nahm die Alkoholyse von Buttersäurechlorid in Anspruch. Da die beiden Stoffe sofort exotherm miteinander reagierten ergab sich keine Wartezeit. Des Weiteren war keinerlei Energie nötig, um die Reaktion in Gang zu setzen. Das herkömmliche Herstellungsverfahren scheint ebenfalls wenig zeitaufwendig zu sein. Auf Grund der katalytischen Schwefelsäure ist nur ein kurzes Erhitzen nötig, um die Stoffe vollständig umzusetzen. Der Versuch zur Herstellung von Buttersäureethylester mit dem Buttersäure Natriumsalz war hingegen eher aufwendig. Zum einen war eine Versuchsapparatur nötig, die im Vorfeld 12 vorbereitet werden musste, zum anderen war die Durchführung selbst relativ langwierig. Grund dafür war vor allem, dass das Erreichen der Siedetemperatur nicht bestimmt werden konnte und somit nicht klar wurde, wie lange der Versuch weiterlaufen musste. Trotz langen Wartens erbrachte der Versuch keine sofortigen Ergebnisse. Schlussendlich streckte er sich sogar über zwei Wochen, in denen allerdings keine aktiven Handlungen nötig waren. Das Gleichgewicht stellte sich ganz von alleine ein. Die Frage, die sich bei der Diskussion der drei verschiedenen Herstellungsverfahren stellt, ist, weshalb die Stoffe auf eine bestimmte Art und Weise miteinander reagieren. Leider kann ich an dieser Stelle nicht beantworten, ob es mit den Gleichgewichtskonstanten der verschiedenen Reaktionen oder mit der Kinetik zusammenhängt, dass die Reaktion zwischen dem Buttersäurechlorid und dem Ethanol bei weitem einfacher und schneller verlief, als die, zwischen reiner Buttersäure und Ethanol. Einen anderen Vergleichsfaktor bieten die zur Herstellung benötigten Substanzen. Zur einfachen Veresterung von Buttersäure und Ethanol mit Hilfe von Schwefelsäure werden ausschließlich herkömmliche Chemikalien gebraucht, die womöglich in jedem Chemielabor vorzufinden sind. Für die Herstellung des Esters durch Buttersäurechlorid und Ethanol sind allerdings nur zwei Stoffe nötig. Die Kosten könnten allerdings, auf Grund höherer Materialkosten, die der geläufigen Methode überschreiten. Das Herstellungsverfahren über den Umweg Buttersäure Natriumsalz ist, was die benötigten Substanzen und auch Gerätschaften betrifft, wohl das Aufwendigste. Die Anschaffung von Natriumbutyrat und Kationenaustauscher ist, verglichen mit den anderen, recht kostspielig. Zudem ist die Versuchsapparatur vergleichsweise aufwendig. Die Herstellung von Buttersäureestern durch die Reaktion von Buttersäurechlorid mit einem Alkohol scheint für den Schulbedarf die am besten geeignete Methode zu sein. Diese ist allerdings unbedingt unter dem Abzug durchzuführen, da das Freiwerden eines üblen Geruches nicht zu vermeiden ist. Für die Industrie ist womöglich die einfache Veresterung der Buttersäure die sinnvollste Herstellungsweise. Auf die Geruchsbelastung wird dabei keine Rücksicht genommen. Dies lässt darauf schließen, dass die 13 Esterproduktion in großen Mengen auf diese Art und Weise am günstigsten ist. Wenn man allerdings dem üblen Geruch der Buttersäure voll und ganz aus dem Weg gehen möchte und einem der aufzubringende Aufwand nichts ausmacht, sollte man sich für den Umweg entscheiden und Buttersäureester nach dem Prinzip von Professor Blume i herstellen. 4. Fazit Meine Facharbeit hat zwar gezeigt, dass es verschiedene Methoden zur Buttersäureesterherstellung gibt, dennoch führt kein Weg an der Buttersäure vorbei. Auch wenn ich in meinen Experimenten die Derivate Natriumbutyrat und Buttersäurechlorid benutzte, blieb der unangenehme Geruch, wenn auch in relativ geringen Maßen, nicht aus. Schließlich ist Buttersäure trotz allem in ihren Abkömmlingen enthalten und muss, wenn auch als Zwischenprodukt, vorliegen um mit einem Alkohol verestert zu werden. Enttäuscht war ich über die geringen Hilfestellungen verschiedener Esterhersteller. Im Rahmen meiner Facharbeit habe ich über 20 E-Mails verfasst und rund zehn Telefonate mir verschiedenen Firmen geführt. Zusätzlich nahm ich Kontakt zu mehreren Chemie Professoren auf, unter anderem zu Professor Blume. Auch wenn ich per E-Mail um einen Anruf gebeten wurde und meine Hoffnung auf Informationen groß war, wurde ich fast immer enttäuscht, da mein Thema zu weit in die Materie gehen würde. Zudem ergab sich das Problem, dass, als ich eine kooperative Firma gefunden hatte („Bell Flavors & Fragrences“), die Buttersäureesterherstellung sehr vielfältig und daher nicht für Dritte dokumentiert ist. Dies ist zwar nachvollziehbar, jedoch hätte mich die industrielle Herstellung für meine Arbeit sehr interessiert. Auch hatte ich mir erhofft, konkretere Angaben über die verschiedenen Verwendungszwecke der Ester zu erhalten. Meine Esternachweise beschränkten sich leider auf die einfache Tatsache, dass Ester vorliegen. Um tiefer in die Materie zu gehen, hätte ich gerne mit Hilfe eines Gaschromatographen bestimmte Ester nachgewiesen und benannt. Was ich im Rahmen meiner Arbeit, auf Grund i Siehe Buttersäureesterherstellung mit Natriumbutyrat 14 fehlender Werte, leider nicht berechnen konnte, sind die Gleichgewichtskonstanten der verschiedenen Reaktionen. Diese könnten Aufschluss auf die Reaktionsweisen geben und sollten auf jeden Fall einmal berechnet werden. Während meiner Facharbeit habe vor allem im praktischen Bereich viel dazugelernt. Den theoretischen Ablauf der Veresterung hatte jeder für sich bereits verstanden. Meine eigenen Experimente und die meiner Mitschüler zeigten jedoch verschiedenste Herstellungsverfahren und vor allem die Vielfalt der Ester. Rückblickend kann ich sagen, dass die letzten sechs Wochen zwar anstrengend, aber auch sehr interessant waren. Es hat mir sehr geholfen mich im Rahmen des Unterrichts mit meinen Mitschülern austauschen zu können. In Zukunft werde ich bei dem Wort „Buttersäureester“ meine Augen und Ohren offen halten, um möglicherweise mehr über diese vielfältigen Substanzen zu erfahren. 15