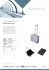Etude documentaire pression osmotique
Transcription
Etude documentaire pression osmotique
weEtude documentaire : osmose et pression osmotique Document 1. Mise en évidence historique du phénomène d’osmose (source : Wikipédia) René Joachim Henri Dutrochet, né au château de Néons (Indre) le 14 novembre 1776 et mort à Paris le 4 février 1847, est un médecin, botaniste et physiologiste français. Observant une plaie sur la queue d'un poisson, Dutrochet vit des filaments ayant à leur extrémité de petites capsules qu'il immergea dans un verre de montre et examina au microscope. Ces capsules, contenant un liquide visqueux, se remplissaient d'eau par l'extrémité proximale sans être déformées, tandis que le liquide visqueux était expulsé par le pôle distal, comme si l'eau jouait le rôle de piston. Dutrochet conclut que l'eau est attirée par le liquide endocavitaire à travers la paroi des capsules. Un pas décisif qui rattacha ce mouvement de liquides à leur différence de composition fut franchi avec l'expérience suivante. Un cæcum (partie supérieure de l’intestin) de poulet lié en bourse, rempli d'une solution de NaCl, immergé dans l'eau, gonfle et augmente de poids. Les solutions étant inversées, le mouvement de l'eau se fait dans le sens contraire, l'eau du sac cæcal passant dans le bain extérieur. La paroi n'a donc pas de polarité, et ne laisse passer que les molécules d’eau, pas les molécules de soluté. L'osmose, ou endosmose, phénomène rapide où la solution concentrée attire l'eau, rien que l'eau, fut un temps opposé à l'exosmose due à la diffusion transmembranaire de solutés entraînant un retour d'eau dans le compartiment d'origine lié aux modifications physico-chimiques des solutions initiales. Document 2. Osmotic pressure. (source : socratic.org) Osmotic pressure is the pressure that must be applied to a solution in order to prevent water from flowing into it through a semi-permeable membrane. As you know, osmosis is the movement of solvent molecules across a semi-permeable membrane from a region of lower solute concentration to a region of higher solute concentration. A solution's osmotic pressure will essentially tell you how much pressure must be applied in order to prevent the water molecules from moving across the semi-permeable membrane, i.e. to prevent osmosis. Mathematically, osmotic pressure is defined as Π = × , where Π is the osmotic pressure of the solution, R the universal gas constant ant T the absolute temperature. Now, it's important to remember that osmotic pressure is a colligative property, which means that it depends exclusively on the concentration of solute particles present in solution. In other words, the nature of the solute is not important, only the concentration of particles it produces in solution. Document 3. Variation du potentiel chimique avec la pression. Par identification entre l’identité thermodynamique pour la fonction G à composition constante : = − (1) Et l’expression mathématique de la différentielle de G à composition constante : = + (2) On obtient la relation : = (3) Or par définition, le potentiel chimique d’un corps pur s’exprime par : ∗( , )= ! , (4) En dérivant l’expression (3) par rapport à la quantité de matière n, et en utilisant le théorème de Schwarz qui permet d’inverser l’ordre de dérivation par rapports aux différentes variables d’une fonction de plusieurs variables si cette fonction est dérivable deux fois en tout point (ce qui est le cas avec les fonctions thermodynamiques car elles représentent une réalité physique, et dans ce cas les discontinuités et cas de non-dérivabilité sont rares), on a avec Vm* le volume molaire du corps pur : ⇔ ! # ,$ # ! ∗ ⇔ = % = , % = ∗ '( ! ∗ '( , , ) , )(5) Si l’on écrit cette fois la différentielle de µ* à température constante, on a la relation : ∗ ∗ = = ∗ ' (6) L’intégration de la relation (6) entre P = P°, où µ* (T,P°) = µ° (T) par définition, et P quelconque pour laquelle on a un potentiel chimie µ* (T,P) donne : + * ⇔ ∗( +° ∗ =* ∗ ' ° , ) = °( ) + * ° ∗ ' (7) Cette relation permet d’expliciter la dépendance du potentiel chimique du corps pur en fonction de la pression, à condition de connaître l’expression de Vm* pour le corps pur considéré. Questions. 1. Dans l’expérience avec le cæcum de poulet (document 1), comparer le potentiel chimique de l’eau à l’intérieur et à l’extérieur du cæcum dans les deux cas, puis proposer une explication au mouvement de l’eau. 2. Comment expliquer qualitativement l’existence d’une différence de pression de part et d’autre de la membrane semi-perméable dans le document 2 ? 3. Dans le schéma du document 2, le compartiment de droite comporte du glucose. Si on note n la quantité de matière de glucose introduite dans ce compartiment, on observe une pression osmotique ./ 0 . Avec la même quantité de matière n introduite, mais de NaCl cette fois, on observe une pression osmotique .123 = 2./ 0 . Et si on introduit cette fois n moles de FeCl3, on observe .4 3 5 = 4./ 0 . Proposer une explication. 4. L’expression de la pression osmotique en fonction de la concentration en soluté donnée dans le document 2 peut être obtenue en tenant compte de l’influence de la pression sur le potentiel chimique de l’eau dans les 2 compartiments à l’équilibre (schéma b du document 2). Nous allons essayer de la réobtenir ici. On note A le compartiment de gauche (où il n’y a initialement que de l’eau pure) et B le compartiment de droite, où se trouve le soluté. Les deux compartiments sont de même volume V et à la même température T, séparés par une membrane semi-perméable, c’est-à-dire perméable au solvant mais imperméable aux solutés. Le compartiment B contient une solution supposée idéale du soluté dans le solvant, celui de droite le solvant pur sous la pression ambiante P. 4.1. Exprimer le volume molaire du solvant pur Vm* en fonction de la masse volumique ρ du solvant et de sa masse molaire M. Vm* dépend-il de la pression pour le solvant ? 4.2. A l’aide de la relation (7) du document 3, en déduire l’expression de µ*(T,P) en fonction de µ°(T), Vm*, P et P°. 4.3. En déduire l’expression du potentiel chimique de l’eau dans les deux compartiments lorsque l’état d’équilibre est atteint (schéma b doc 2), et pour lequel la pression dans le compartiment A est toujours P, alors qu’une surpression Π existe dans le compartiment B (cf. doc 2). On prendra la convention du mélange idéal dans le compartiment B, qui fait intervenir la fraction molaire de l’eau pour son activité, et on considèrera que la solution étant très diluée, le volume molaire du solvant dans le compartiment B est identique à celui du solvant pur. 4.4. Ecrire la relation liant les potentiels chimiques de l’eau dans les deux compartiments lorsque l’équilibre est atteint. En déduire une expression de Π en fonction de Vm*, R, T et xsolvant (fraction molaire du solvant dans le compartiment B). 4.5. Introduire la fraction molaire de soluté dans l’expression précédente, puis la linéariser avec un développement limité au premier ordre de la fonction ln. On rappelle que la solution étant très diluée, xsoluté ≪ 1. 4.6. Avec une dernière approximation concernant la dilution de la solution (nsoluté ≪ nsolvant), et en remplaçant Vm* par son expression en fonction de nsolvant et du volume V de fluide, retrouver l’expression de Π donnée dans le document 2. 5. Application : montée de la sève dans les arbres. On prendra T = 290 K et ρsève = 103 kg.m-3. 5.1. La concentration du sucre (saccharose, C12H22O11) dans une sève normale, assimilée à une solution aqueuse, est environ 10 g.L-1. Calculer la pression osmotique de la sève par rapport à l’eau du sol autour des racines. 5.2. A quelle hauteur la sève peut-elle monter sous l’effet de cette surpression ? La pression osmotique peut-elle expliquer la montée de la sève dans les grands arbres (hauteur supérieure à 20 mètres) ? 6. L’île de Malte, en Méditerranée, n’a pas suffisamment de ressources naturelles d’eau potable pour subvenir aux besoins de ses habitants. La solution est l’obtention d’eau potable par désalinisation de l’eau de mer grâce au processus d’osmose inverse. Proposer une description succincte de ce procédé. 7. Les membranes cellulaires des cellules biologiques sont des membranes semi-perméables, qui laissent passer l’eau mais pas les solutés. Imaginer les conséquences de l’absorption d’une très grande quantité d’eau sur les cellules du corps humain, ou les conséquences d’une alimentation extrêmement salée.