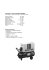504 Ko
Transcription
504 Ko
TP 2 – Equilibre LiquideVapeur Le TD 5 est une préparation indispensable à ce TP. __________________________________________________________ §§§§§ CONSIGNES DE SÉCURITÉ §§§§§ ✓ Ne pas toucher aux éléments du couvercle de l’autocuiseur. ✓ Ne jamais essayer de bloquer ou de dévisser la soupape de sécurité. ✓ Avant de placer l’autocuiseur sur la plaque chauffante, vérifier qu’il : ✓ ✓ ✓ ✓ - contient bien de l’eau (~ 1 litre), qui sera vidée seulement en fin de séance. - est correctement fermé, avec la soupape de sécurité à l’arrière. En cas de problème, débrancher la prise de la plaque chauffante. Utiliser les gants de protection avant de manipuler la soupape ou la cocotte. Veiller à ce que l’indicateur de pression reste constamment surélevé. Vérifier que les fils des capteurs ne touchent jamais les parois de la cocotte. I) INTRODUCTION 1) Quelques rappels de cours : a) Les 3 phases d’un corps pur : - Un corps pur, suivant ses conditions de température et de pression, peut se présenter sous 3 états (ou phases) : liquide, solide et gaz. Les domaines d’existence, ou coexistence, de ces états sont représentés par le diagramme de phase du corps, dont un exemple est donné Figure 1. - Dans chaque zone du diagramme, le corps pur est seul dans sa phase. Les différentes courbes (courbes de changements d’états) caractérisent la coexistence de 2 phases du corps pur. On reconnait les courbes de fusion (solide-liquide), vaporisation (liquide-gaz) et sublimation (solidegaz). - En particulier, dans le cas d’une vaporisation, pour une température T donnée, le liquide s’évapore à une pression bien déterminée. Cette pression d’équilibre liquide-vapeur est appelé pression de vapeur saturante Ps. La courbe de vaporisation est ainsi déterminée par le tracé Ps(T). Cette courbe est limitée, à droite, par le point critique (C), au delà duquel on ne peut plus faire la distinction entre les phases liquide et gaz. A gauche, le point triple (T) caractérise la coexistence des 3 phases du corps pur. Figure 1 : Diagramme de phase d’un corps pur. b) Chaleur latente et changement d’état : En général, un changement d’état se fait à pression constante. La quantité de chaleur L, nécessaire pour faire passer une unité de masse d’un corps d’un état à un autre, est appelée la “chaleur latente de changement d’état”. Lors d’une transformation quasi-statique où le corps passe de l’état 1 à l’état 2 à pression constante, cette chaleur latente est calculable à partir de la relation de Clapeyron : L12 = T(u2 u1 ) dP dT Dans cette formule, u1 est le volume massique du corps dans l’état 1, u2 le volume massique du corps dans l’état 2 et dP/dT la pente de la courbe de changement de phase considérée. 2) Dispositif utilisé : L’ensemble du dispositif expérimental utilisé dans ce TP est représenté Figure 2. Il comprend : - un autocuiseur (cocotte-minute 8 litres) dont le couvercle a été modifié pour adapter les capteurs nécessaires aux mesures. une sonde de pression 0 - 2.5 bars absolue. une sonde de température de précision ± 0.5°C. La sonde en température est fixée de telle sorte qu’elle mesure la température de la vapeur d’eau à l’intérieur de l’autocuiseur. une soupape tournante. une masselotte. une plaque chauffante à six positions, utilisée pour chauffer l’autocuiseur. Elle délivre une puissance maximale de 2kW. Figure 2 : Présentation du dispositif expérimental. II) ÉTUDE EXPÉRIMENTALE Dans la première partie de ce TP, on cherche à montrer, à travers l’exemple de la vaporisation de l’eau, qu’un changement d’état s’effectue à pression constante et que la température de changement d’état dépend de la pression sous laquelle s’effectue la transformation. La seconde partie permet de vérifier 2 lois usuelles de l’équilibre liquide-vapeur, l’une empirique (formule de Duperray), l’autre déduite de la relation de Clapeyron (formule de RankineCallendar). 1) Caractérisation d’un changement d’état : la vaporisation de l’eau a) Etude à pression atmosphérique, sans la soupape tournante. Mettre de l’eau dans l’autocuiseur (environ 5 cm). Placer l’autocuiseur sur la plaque chauffante en position 5, en s’assurant que la soupape de sécurité se trouve à l’arrière de la cocotte. • Lorsque la température de la vapeur d’eau atteint 80 °C, relever l’évolution de la pression et de la température en fonction du temps (on prendra des mesures toutes les minutes). • Au bout d’un certain temps, on remarque un palier de température, ainsi qu’un palier de pression, avec une légère surpression. A quoi correspondent ces paliers ? Jusqu’à quelles pression et température parvient-on ? Expliquer l’origine de la surpression. Une fois le palier atteint, continuer la prise de mesure pendant environ 3 min puis mettre en place, en utilisant les gants à disposition, la soupape tournante. b) Mise en place de la soupape tournante. Une fois la soupape tournante mise en place : • Continuer les relevés de la pression et de la température en fonction du temps. Comment évoluent ces grandeurs ? • Au bout d’un certain temps, la soupape se met à tourner. Que peut-on en déduire de la pression à l’intérieur de l’autocuiseur ? Quelle est sa valeur ? Comment évolue alors la température ? A quoi correspondent ces évolutions ? c) Mise en place de la masselote. Après quelques minutes, on place alors une masselotte sur la soupape, ce qui a pour effet de l’empêcher de tourner. • Continuer les relevés toutes les minutes. Jusqu’à quelle température et quelle pression parvient-on ? Que se passe-t’il alors ? • Le constructeur donne la pression à partir de laquelle la soupape de sécurité du couvercle se déclenche : Pm = 1.9 bar. Commenter cette valeur par rapport à vos résultats. Arrêter le chauffage 2 à 3 minutes après avoir atteint ce dernier palier, puis suivre les instructions du 2). d) Discussion. • Faire le tracé des résultats expérimentaux obtenus. On représentera la pression et la température, en fonction du temps sur un même graphique (on utilisera 2 systèmes de coordonnées différents pour les ordonnées température et pression). • Discuter en quelques lignes la notion de changement d’état dans le cas particulier de la vaporisation étudiée dans cette première partie. • A partir des résultats obtenus, tracer, dans le diagramme de phase (P,T), l’allure de la courbe de vaporisation de l’eau. 2) Modélisation de l’équilibre liquide-vapeur : a) La phase de refroidissement : Dans cette partie, on coupe le chauffage de la plaque et on continue la prise de mesures sans enlever la masselote, ni la soupape. On laisse alors refroidir l’ensemble du dispositif. • Continuer les relevés de température et de pression en fonction du temps (toutes les minutes) pendant 20-25 min environ. • La pression atmosphérique vaut environ 1.025 bar. Au bout de combien de temps l’intérieur de l’autocuiseur entre t’il en dépression ? Quelle est alors la température de la vapeur ? • Expliquer alors pourquoi il est parfois difficile (impossible ?) d’ouvrir une cocotte-minute après l’avoir laissée refroidir. Vous pouvez essayer, toujours avec les gants de protection, d’ouvrir le couvercle. • Donnez un ordre de grandeur de la force qu’il faudrait exercer pour pouvoir ouvrir la cocotte. Enlever la soupape et sa masselote, toujours en utilisant les gants de protection. • Expliquer pourquoi il est alors possible d’ouvrir le couvercle. Lors du refroidissement, la pression mesurée est la pression de vapeur saturante de l’eau. On peut alors vérifier un certain nombre de formules, qu’elles soient obtenues de manière empirique ou déduites de la relation de Clapeyron. b) Formule de Duperray : Une formule purement empirique, et valable uniquement dans le cas de l’eau, a été proposée par Duperray. Elle permet de calculer la pression de vapeur saturante de l’eau en fonction de la température et s’écrit : t 4 Ps = ( ) 100 où t est la température exprimée en degré Celsius et Ps, pression de vapeur saturante, est exprimée en bar. • Tracer la courbe Ps(t) obtenue lors du refroidissement. • Superposer la courbe théorique déduite de la formule de Duperray. • Conclure sur la validité de la formule de Duperray. c) Formule de Rankine-Callendar : On fait l’hypothèse que, dans la gamme de température explorée, la chaleur latente de vaporisation peut être considérée comme constante, égale à L0. • En supposant que le volume massique de gaz est très supérieur à celui de l’eau liquide (u g >> ul) et que la vapeur d’eau peut être considérée comme un gaz parfait, montrer que la relation entre la pression de vapeur saturante et la température peut se mettre sous la forme : ln Ps = a - b T où T est la température exprimée en Kelvin, et a et b sont des constantes. • Exprimer b en fonction des grandeurs du problème. • Tracer la courbe expérimentale lnPs(T) = f(1/T) lors de la phase de refroidissement, pour T<117°C. Déterminer alors les valeurs des 2 coefficients a et b. • En déduire une valeur de L0. Comparer à la valeur donnée dans le TD5. Temps P t T Temps P t T (min) 0 1 2 3 ... (bars) ... (°C) 80 (K) 353 (min) (bars) (°C) (K) Temps (min) P (bars) t (°C) T (K) Temps (min) P (bars) t (°C) T (K)