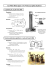LA PILE DANIELL Les deux couples mis en jeu
Transcription
LA PILE DANIELL Les deux couples mis en jeu
LA PILE DANIELL 2+ 2+ Les deux couples mis en jeu sont Cu /Cu et Zn /Zn et mis dans des compartiments différents : le zinc plongeant dans une solution de sulfate de zinc et le cuivre dans une solution de sulfate de cuivre. - Zn Zn2+ Cu2+ Cu + • Ces deux couples sont séparés par une paroi poreuse (fig 1) ou un pont salin (fig2). fig 1 fig2 A l’anode : oxydation du zinc Zn = Zn2+ + 2e • • • Les électrons formés vont sortir de l’anode et permettre la circulation de ceux-ci dans le circuit extérieur de l’anode vers la cathode. Le sens conventionnel du courant I sera de la cathode à l’anode. L’électrode (-) va perdre en masse puisqu’il y a disparition du zinc (∆mZn <0 ou ∆nZn<0) On mesure une intensité I dans l’ampèremètre placé en série avec un conducteur ohmique. A la cathode : réduction du cuivre Cu2+ + 2e - = Cu • • 2+ Les électrons arrivés à la cathode vont réduire les ions Cu pour former du cuivre Cu. L’électrode de cuivre va gagner en masse puisqu’il y a formation de Cu. (∆mCu>0 ou ∆nCu>0). Dans le pont salin : ici K+,Cl• • Les ions assurent la circulation du courant dans la pile. 2+ Dans la solution de sulfate de cuivre, il y a de moins en moins d’ions Cu . Pour garder + l’électroneutralité de la solution, les ions K vont donc se déplacer dans cette solution. 2+ • Dans la solution de sulfate de zinc, il y a de plus en plus d’ions Zn . Pour garder l’électroneutralité de la solution, les ions Cl vont donc se déplacer dans cette solution. Remarque : avec une paroi poreuse, tous les ions se déplacent en assurant l’électroneutralité des solutions et permettant la circulation du courant. La paroi évite aussi le mélange des deux solutions.
Documents pareils
Fiche sur la pile Daniell - Espace Sciences Physiques - E
 La tension indiquée par le multimètre correspond à la ddp de la pile.
A l’électrode de zinc : Zn
Zn 2+ + 2e- (oxydation) (diminution de
l’épaisseur de la lame de zinc)
A l’électrode de cuivre : C...
La tension indiquée par le multimètre correspond à la ddp de la pile.
A l’électrode de zinc : Zn
Zn 2+ + 2e- (oxydation) (diminution de
l’épaisseur de la lame de zinc)
A l’électrode de cuivre : C...
Chapitre 6 : Les piles électrochimiques I
 a) Le voltmètre indique une tension de 1,23 V.
Le métal cuivre constitue donc la borne + de la pile et le zinc la borne -.
b) L’ampermètre indique une intensité de 1,5 A.
Un courant circule donc du...
a) Le voltmètre indique une tension de 1,23 V.
Le métal cuivre constitue donc la borne + de la pile et le zinc la borne -.
b) L’ampermètre indique une intensité de 1,5 A.
Un courant circule donc du...