LES GAZ, PARTIE C :
Transcription
LES GAZ, PARTIE C :
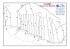
Chapitre V : Les gaz, Partie C page 1/9 LES GAZ, PARTIE C : Le modèle de Van der Waals Nous cherchons une nouvelle équation d’état des gaz car l’expérience montre que le comportement des gaz réels s’écarte de celui des gaz parfaits aux fortes pressions. Van der Waals1 a proposé une équation en 1873. Cela, avec d’autres travaux, lui a valu le prix Nobel 1910. Nous allons décrire comment obtenir l’équation d’état de Van der Waals à partir de considérations théoriques, en nous fondant sur les limitations du modèle du gaz parfait. En effet, d’une part, les molécules d’un gaz réel ne sont pas ponctuelles et, d’autre part, elles interagissent entre elles, contrairement aux hypothèses faites pour définir le gaz parfait. Ensuite nous visualiserons l’équation de Van der Waals à l’aide de diagrammes. A. Vers l’équation d’état de Van der Waals Nous allons d’abord modifier l’équation d’état des gaz parfait en tenant compte du caractère non ponctuel des molécules. 1. Caractère non ponctuel des molécules a) Volume propre des molécules Les molécules d’un gaz réel ne sont pas ponctuelles : elles occupent un certain volume, appelé volume propre des molécules. Par exemple, en première approximation, on peut assimiler la molécule d’hélium He à une sphère de rayon r = 1,33.10-10 m. Le volume propre d’une molécule est alors : v1 = (4/3) r3 ≈ (4/3) (1,33.10-10)3 m3 ≈ 0,985.10-29 m3. A l’échelle macroscopique, nous considérons le volume propre molaire : vm = NA v1 ≈ 6,02.1023 (4/3) (1,33.10-10)3 m3.mol-1 vm ≈ 5,93.10-6 m3.mol-1 ≈ 6 cm3.mol-1. Dans les conditions normales de température et de pression, le volume molaire des gaz vaut environ 22400 cm3.mol-1. Le volume propre molaire est alors petit devant le volume molaire du gaz. b) Le covolume Chaque molécule occupe donc un volume qui n’est plus disponible pour les autres. Celles-ci ne sont donc pas susceptibles de se déplacer dans le volume V du récipient mais dans un volume 1 Voir une courte biographie de Johannes Diderik Van der Waals dans le complément III.1 Chapitre V : Les gaz, Partie C page 2/9 inférieur que nous noterons V – B. La grandeur B, positive, est appelé covolume et a la dimension d’un volume (unité légale le m3). Le covolume est proportionnel au nombre de molécules donc à la quantité de matière n ce que nous écrivons B = n b. La grandeur b est le covolume molaire et a la dimension d’un volume molaire (unité légale, le m3.mol-1). Voici quelques mesures de covolumes molaires. Remarquons qu’ils sont tous du même ordre de grandeur, quelques dizaines de cm3.mol-1. Hélium 23,7 Dihydrogène 26,6 Dioxygène 31,8 Diazote 39,1 CO2 42,7 cm3.mol-1 Le covolume n’est en fait pas égal au volume propre des molécules. Mais il est du même ordre de grandeur. Des considérations théoriques quantitatives conduisent à la relation b = 4 vm. (Voir complément V.1.) Dans les conditions normales de température et de pression, le covolume est donc faible devant le volume V du gaz. Nous pouvons vérifier la relation b = 4 vm dans le cas de l’hélium : 4 vm ≈ 4. 5,93.10-6 m3.mol-1 ≈ 2,37.10-5 m3.mol-1 ≈ b c) Equation partiellement modifiée Nous transformons alors l’équation d’état des gaz parfaits en une équation d’état de gaz à molécules non ponctuelles (mais n’interagissant pas entre elles) en remplaçant V par V - B : p(V B) nRT Nous pouvons aussi écrire pour 1 mole de gaz, en divisant par n et en notant Vm est le volume molaire : V B p R T n n p(Vm b) RT Nous allons maintenant tenir compte des interactions entre molécules dans un gaz réel. 2. Existence des interactions entre molécules a) Pression interne Considérons une molécule au sein du gaz, loin de toute paroi du récipient. A cause des forces de Van der Waals, elle est attirée de toute part par les autres molécules du gaz. Mais la situation est symétrique, donc ces attractions se compensent entre elles. Voir figure 1. Considérons maintenant une molécule proche d’une paroi. Les attractions de Van der Waals qu’elle subit l’attirent vers l’intérieur du récipient. La pression exercée par le gaz réel sur la paroi est donc inférieure à celle qu’exercerait un gaz parfait. La différence entre ces deux pressions est appelée pression interne pi. Chapitre V : Les gaz, Partie C page 3/9 paroi Figure 1 : Forces de Van der Waals subies par une molécule loin de toutes parois et proche d’une paroi Des considérations théoriques quantitatives montrent que la pression interne est proportionnelle au carré de la quantité de matière n et inversement proportionnelle au carré du volume V. En notant a le coefficient de proportionnalité, appelé coefficient de pression interne, nous écrivons donc : pi a Hélium 3,44 n2 a 2 2 V Vm Dihydrogène 24,7 Dioxygène 138 Diazote 139 CO2 364 mJ.m3.mol-2 Ces valeurs appellent quelques commentaires. b) Commentaires i. Le coefficient de pression interne dépend nettement de la nature du gaz, il varie de quelques mJ.m3.mol-2 à quelques centaines. ii. Vérifions l’unité légale du coefficient de pression interne. Rappelons que pV a la dimension d’une énergie et s’exprime donc en joules (voir chapitre III § D.3.a). La dimension du volume molaire est le m3.mol-1. Celle du coefficient a est telle que le terme a/Vm2, qui représente une pression, s’exprime en pascals : u (a) Pa.m6 .mol-2 Pa.m3 .m3 .mol-2 u (a) J.m3 .mol-2 iii. Calculons la pression interne dans une mole d’hélium prise dans les conditions normales de température et de pression. Dans ces conditions, le volume molaire vaut 22,4.10-3 m-3.mol-1 et la pression interne : pi0(He) ≈ 3,44.10-3. (1/ 22,4.10-3)2 Pa ≈ 6,86 Pa. Dans le cas du diazote et du dioxyde de carbone, nous obtenons successivement : pi0(N2) ≈ 139.10-3. (1/ 22,4.10-3)2 Pa ≈ 277 Pa. Chapitre V : Les gaz, Partie C page 4/9 pi0(CO2) ≈ 364.10-3. (1/ 22,4.10-3)2 Pa ≈ 725 Pa. Il faut comparer ces résultats aux pressions usuelles des gaz, par exemple à la pression normale P0 = 1,013.105 Pa. La pression interne est donc usuellement faible devant la pression p du gaz. c) Equation partiellement modifiée Le terme (p+pi) représente la pression exercée par le gaz parfait, la pression p exercée par le gaz réel lui est effectivement inférieure. Nous transformons alors l’équation d’état des gaz parfaits en une équation d’état de gaz (à molécules ponctuelles) interagissant entre elles en remplaçant p par p+pi : n2 p a V n R T V2 Puis pour 1 mole de gaz, en divisant par n, n2 V pa 2 RT V n a p 2 Vm R T Vm 3. Equation d’état de Van der Waals a) Son expression En tenant compte à la fois du covolume et de la pression interne nous écrivons l’équation d’état de Van der Waals pour n moles de gaz : n2 p a (V nb) n R T V2 Ou pour 1 mole de gaz : a p 2 (Vm b) R T Vm b) Ses intérêts i. L’étude des gaz réels et de cette équation montre qu’un gaz de Van der Waals est plus proche d’un gaz réel qu’un gaz parfait. La façon dont nous avons obtenu l’équation d’état de Van der Waals montre qu’elle se substitue à celle des gaz parfaits quand celle-ci n’est plus valable, c’est à dire aux fortes pressions. En effet, lorsque la pression augmente, le volume diminue, et le covolume n’est plus négligeable devant le volume. De plus, la distance entre molécules diminue ce qui rend leurs interactions ainsi que la pression interne non négligeables. Chapitre V : Les gaz, Partie C page 5/9 (Au contraire, un gaz réel pourra être considéré comme parfait quand les dimensions des molécules seront très petites devant les dimensions du récipient car alors les molécules apparaîtront comme ponctuelles. Il faut aussi qu’il y ait peu de molécules par unité de volume car alors elles seront en moyenne à grande distance les unes des autres et ainsi leurs interactions seront négligeables.) ii. De plus lorsqu’on comprime et refroidit un gaz parfait, son équation d’état ne prévoit pas la liquéfaction du gaz. Au contraire, l’équation d’état de Van der Waals permet une description du passage de l’état gazeux à l’état liquide. Voir le chapitre sur les changements d’état. Mais cette équation ne décrit pas exactement un gaz réel. On dispose d’autres équations d’état. c) Autres équations d’état Lorsque les écarts entre gaz réel et gaz de Van der Waals sont trop importants pour la précision exigée, on peut utiliser d’autres équations d’état. (Voir Complément V.2 : Quelques autres équations d’état.) On dispose aussi du développement du viriel2. C’est un développement en série du produit pVm=pV/n en puissances de l’inverse du volume molaire 1/Vm=n/V : p V nB n 2C n3 D R T A 2 3 ... n V V V A, B, C, D… sont les coefficients du viriel, fonctions de la température et de la nature du gaz. Aux grands volumes le développement doit tendre vers l’équation d’état du gaz parfait donc A = 1. Les autres coefficients sont déterminés expérimentalement (Voir Complément V.2) ; en théorie ils peuvent aussi être calculés. Il n’est pas possible de travailler avec un nombre infini de termes. On utilise donc un développement limité, nouvelle équation d’état d’un gaz. Du nombre de termes choisis dépend la qualité de l’accord entre le nouveau modèle et le gaz réel. Ce développement en série se fait aussi en puissances de la pression p : p V R T ( A ' B ' p C ' p 2 D ' p 3 ...) n A’, B’, C’, D’… sont de nouveaux coefficients du viriel, fonctions de la température et de la nature du gaz. Aux faibles pressions le modèle doit tendre vers celui du gaz parfait donc A’ = 1. Ces nouveaux coefficients du viriel s’expriment en fonction des précédents. Par exemple : B' 2 B RT et C ' C B2 R 2T 2 Le mot « viriel » vient de du latin « vires » qui signifie les forces. Ce sont des considérations sur les forces entre molécules qui permettent de calculer les coefficients du viriel. Chapitre V : Les gaz, Partie C page 6/9 Nous allons maintenant chercher à comparer quantitativement les comportements d’un gaz parfait et d’un gaz de Van der Waals. Pour cela nous allons les visualiser grâce à des réseaux d’isothermes. Nous commençons par définir ces réseaux puis nous traiterons deux exemples souvent utilisés. B. Isothermes, réseaux d’isothermes 1. Définitions Une isotherme est la représentation graphique d’une variable d’état y en fonction d’une autre x lorsque la température T est choisie constante. L’ensemble des isothermes y = fT(x), tracées pour différentes valeurs de la température, forment un réseau d’isothermes. 2. Exemple 1 : Diagramme de Clapeyron Dans un diagramme de Clapeyron, on représente la pression p en fonction du volume V. a) Cas du gaz parfait Nous allons construire le réseau d’isothermes de Clapeyron pour un gaz parfait. La fonction p=fT(V) que représente l’isotherme s’écrit facilement : p nRT C (T ) V V Lorsque la température T est constante, cette expression est de la forme y=constante/x. Donc sa représentation graphique est une branche d’hyperbole. La constante dépend de la température donc à chaque température correspond une branche d’hyperbole. L’ensemble de ces branches d’hyperboles forme le réseau d’isothermes de Clapeyron pour le gaz parfait. Plus la température est élevée et plus la constante C(T) = nRT l’est. Et plus l’isotherme s’éloigne de l’axe des abscisses. Voir figure 2, § c. b) Cas du gaz de Van der Waals Pour un gaz de Van der Waals, la fonction p=fT(V) s’écrit presque aussi facilement : n2 a p V nb nRT V2 n2a nRT p 2 V V nb nRT n2a p 2 V nb V C (T ) n 2 a p V nb V 2 Chapitre V : Les gaz, Partie C page 7/9 La représentation graphique de cette fonction n’est plus une branche d’hyperbole, mais il est difficile de l’en distinguer visuellement si on ne présente pas les deux courbes simultanément. Voici les deux réseaux, tracés grâce à Maple®. c) Les deux réseaux de Clapeyron Pour réaliser ces graphiques, il faut choisir une certaine quantité de gaz. Les réseaux sont tracés pour n = 1 mol. Ce choix ne diminue pas la généralité des résultats : Il ne modifie pas la forme des isothermes ; Il fixe l’échelle sur l’axe des abscisses car le volume, dans des conditions fixées de température et de pression, est proportionnel à la quantité de matière. Le réseau d’isothermes d’un gaz de Van der Waals dépend de la nature du gaz à cause des paramètres a et b. J’ai choisi le dioxygène. Ses isothermes sont représentées en traits pleins. Par définition, le réseau d’isothermes du gaz parfait ne dépend pas de la nature du gaz. Ces isothermes sont représentées en traits pointillés. Les couleurs des isothermes respectent la « convention robinetterie » : elles vont du bleu au rouge lorsque la température augmente. Les températures s’échelonnent de 100 en 100 K entre 200 et 700 K. pression en 105 Pa volume en L Figure 2 : Isothermes de Clapeyron ; en pointillés, le gaz parfait ; en pleins, O2 de Van der Waals Nous constatons graphiquement que les écarts entre gaz de Van der Waals et gaz parfait sont toujours faibles aux basses pressions. En effet, le comportement des gaz réels tend vers celui du gaz parfait lorsque la pression tend vers zéro. Les écarts dépendent aussi de la température. (Et bien entendu de la nature du gaz puisque le covolume et la pression interne en dépendent. Voir complément V.3.) Chapitre V : Les gaz, Partie C page 8/9 3. Exemple n°2 : Diagramme d’Amagat Il peut être plus démonstratif de visualiser le comportement des gaz dans un diagramme d’Amagat, c'est-à-dire de représenter la variable y=pV en fonction de la pression p. a) Les deux réseaux d’Amagat Voici les deux réseaux, tracés grâce à Maple®. Nous allons ensuite décrire comment nous les avons obtenus. Les réseaux sont tracés pour n = 1 mol. Comme pour les réseaux de Clapeyron, ce choix ne diminue pas la généralité des résultats. Cette fois il fixe l’échelle des ordonnées. Le gaz choisi est encore le dioxygène. La convention des couleurs est la même et celle des traits pleins et pointillés aussi. pression x volume en 105 Pa.L pression en 105 Pa Figure 3 : Isothermes d’Amagat ; en pointillés, le gaz parfait ; en pleins, O2 de Van der Waals b) Cas du gaz parfait Dans ce diagramme, les isothermes du gaz parfait sont des droites parallèles à l’axe des abscisses. En effet : pV nRT y C (T ) Cela rend la comparaison entre le gaz parfait et un gaz de Van der Waals plus aisée ce qui justifie le choix du diagramme d’Amagat. Chapitre V : Les gaz, Partie C page 9/9 c) Cas du gaz de Van der Waals Dans ce diagramme, il faut établir l’expression des isothermes. Nous avons posé y=pV et nous remplaçons V par y/p dans l’équation de Van der Waals : n2 a p (V nb) nRT V2 n2 a p 2 y p nb C (T ) 2 y p Cette expression définit implicitement y=pV en fonction de p. En effet lorsqu’on se donne une valeur numérique de la pression, l’expression ci-dessus devient une équation algébrique dont l’inconnue est y=pV. C’est une équation du troisième degré qu’il est possible de résoudre. d) Comparaison entre gaz parfait et gaz de Van der Waals Le graphique ci-dessus illustre visuellement les mêmes résultats que le diagramme de Clapeyron mais les comparaisons sont plus aisées à cause de la forme très simple des isothermes du gaz parfait. Dans le domaine de température et de pression représenté ici, le plus grand écart positif est obtenu pour p = 200. 105 Pa et T = 700 K ; il vaut environ 2.105 Pa.L. Voir figure 3. Considérons une mole de dioxygène à la température de 700 K et faisons lui subir une compression isotherme de la pression de 105 Pa à celle de 200. 105 Pa. Le volume initial du gaz est pratiquement le même qu’on le considère comme un gaz parfait ou comme un gaz de Van der Waals. (Les produits pV sont pratiquement égaux sous la pression de 105 Pa. Voir figure 3.) Son volume final est plus grand dans le cas du gaz de Van der Waals que dans celui du gaz parfait. Le dioxygène de Van der Waals est donc moins compressible que le gaz parfait. Dans le même domaine, le plus grand écart négatif est obtenu pour p = 200. 105 Pa et T = 200 K et vaut environ -4.105 Pa.L. Dans ce cas le dioxygène de Van der Waals est plus compressible que le gaz parfait. Voir dans le complément V.3 : - l’allure du réseau pour des gammes plus grandes de température et de pression. - le calcul des écarts relatifs de volume à partir des écarts sur le produit pV. - les réseaux de l’hélium, du diazote et du dioxyde de carbone. L’équation d’état de Van der Waals, obtenue par des considérations théoriques, permet une meilleure description du comportement des gaz, en particulier aux fortes pressions et une approche nouvelle de leur liquéfaction. Dans le chapitre suivant, nous continuons l’étude des gaz en étudiant quelques-unes de leurs propriétés d’un point de vue microscopique (répartition des molécules, vitesse, énergie, notion de température et de pression).