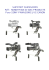Nouveautés diagnostiques pour les hémopathies malignes
Transcription
Nouveautés diagnostiques pour les hémopathies malignes
C ompte rendu doi:10.1684/hma.2014.0937 Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 07/02/2017. Nouveautés diagnostiques pour les hémopathies malignes : lymphocytes B matures Alexis Talbot Service anatomie et cytologie pathologiques, hôpital Necker-Enfants malades, Paris Caractérisation phénotypique et fonctionnelle des cellules myéloïdes suppressives (MDSC) dans le lymphome diffus à grandes cellules B (DLBCL) Imane Azzaoui, Fabrice Uhel, Delphine Rosille, Karin Tarte, Thierry Fest, Mikael Roussel (Rennes) es lymphomes B diffus à grandes cellules (DLBCL) ont pour caractéristique les distinguant des autres lymphomes une augmentation du nombre de cellules myéloïdes circulantes, notamment les monocytes et les histiocytes. Lenz et al. [1] ont montré en analyse d’expression génique que le microenvironnement, et notamment l’infiltration histiocytaire sont impliqués dans la survie après traitement ainsi que les gènes liés à l’angiogenèse. D’autres auteurs ont montré l’impact pronostique des monocytes circulants en utilisant le ratio des lymphocytes sur monocytes [2, 3]. Plusieurs études françaises sont venues confirmer ces résultats : la cohorte GAINED du Lysa et l’étude transcriptomique sur sang total réalisée sur la cohorte 075 du GOELAMS. Les cellules myéloïdes suppressives (MDSC) forment un groupe hétérogène de cellules progénitrices de type myéloïde ayant un rôle immuno- L <[email protected]> Hématologie Tirés à part : A. Talbot suppresseur. Plusieurs sous-types de MDSC ont été étudiés dans diverses pathologies [4, 5] mais peu d’études sur les MDSC dans les DLBCL. Les hypothèses quant au rôle de ces cellules dans la lymphomagenèse des DLBCL sont multiples [6] (figure 1) : suppression de la réponse lymphoïde T, effet pro-angiogénique, modulation de la production de cytokines par les macrophages, rôle dans l’apoptose des cellules T, suppression de l’activité NK. L’équipe de Mickael Roussel a entrepris d’étudier le compartiment myéloïde circulant sur le plan phénotypique et fonctionnel dans les DLBCL de novo chez les patients de 18 à 70 ans : 45 patients et 33 témoins ont été inclus : les auteurs ont retrouvé un taux de cellules phénotypiquement caractéristiques de MDSC (MDSC1, MDSC2, MDSC3, MDSC4 et mono CD14+16+) plus élevé dans le sang des patients par rapport Pour citer cet article : Talbot A. Nouveautés diagnostiques pour les hémopathies malignes : lymphocytes B matures. Hématologie 2014 ; 20 : 13-17. doi : 10.1684/hma.2014.0937 Hématologie vol. 20 n° supplement 4, mai 2014 13 MDSC : mécanismes d’action Recrutement MDSC S100A9 S100A8 Développement treg Inhibition différentiation DC A9 00 S1 RAGE MDSC STAT3 TGF-b STAT6 Blocage activité NK STAT1 NO C/EBPb HIF-a Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 07/02/2017. MYD88 ... Perte du TCR zéta Tim-3 Gal-9 Privation arginine et tryptophane par IDO et arginase I Apoptose cellule T IL-10 Nitrosylation (NO) CCL2 Arrêt prolifération T Inhibition recrutement T via CCR2 Ratio IL-10/IL-12 macrophage D’après gabrilovich et al, nat rev immunol, 2012 Activation effecteur T Figure 1. Mécanismes d’immunosuppression des MDSC [6] MDSC1 ∗∗ 20 000 MDSC2 ∗∗ 400 200 10 000 10 000 100 µl 100 µl 300 5 000 1 000 0 Tem DLBCL Tem DLBCL 50 000 40 000 10 000 30 000 100 µl 5 000 100 µl 50 40 30 20 10 0 MDSC4 MDSC3 ∗∗∗ 15 000 100 1 000 800 20 000 10 000 5 000 600 400 200 0 0 Tem DLBCL Tem DLBCL Figure 2. Taux de cellules MDSC circulantes par 100 µl de sang de patients DLBCL comparativement à des témoins sains (analyse en cytométrie en flux). 14 Hématologie vol. 20 n° supplement 4, mai 2014 Nouveautés diagnostiques pour les hémopathies malignes : lymphocytes B matures Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 07/02/2017. aux témoins (analyse par CMF, figure 2). En revanche les lymphocytes, les éosinophiles, les basophiles et les monocytes CD14 low CD16+ sont diminués. Ces résultats sont spécifiques aux DLBCL. L’étude de la prolifération des cellules T issues du sang des patients DLBCL montre que les MDSC circulantes ont une activité suppressive. Leurs mécanismes d’action sont étudiés par analyse transcriptomique sur PBMC ; les gènes impliqués dans l’homéostasie des cellules T sont sous-exprimés (ex. : CD4, CD3zeta…). En revanche, les gènes impliqués dans l’activité suppressives des MDSC sont surexprimés (ex. : S100A9, S100A12, ARG1). Enfin, le dosage plasmatique cytokinique des patients retrouve une élévation de l’IL-10, cytokine immunosuppressive mais également du CD163 soluble, du TNFα et IL-6. Il existe donc une augmentation des MDSC circulantes dans les DLBCL étudiés. Ces cellules ont une action immunosuppressive. L’impact de ces observations sur le pronostic reste encore à démontrer que ce soit au diagnostic ou lors du suivi. Par ailleurs, des travaux sont encore nécessaires pour démontrer que ces cellules sont bien infiltrantes au niveau des tumeurs ou des organes lymphoïdes dans ce contexte, et pour étudier les interactions entre les MDSC et les autres acteurs du microenvironnement. Mutations activatrices dans les lymphomes diffus à grandes cellules : description et implications cliniques Élodie Bohers, Sylvain Mareschal, Abdelilah Bouzelfen, Vinciane Marchand, Philippe Ruminy, Catherine Maingonnat, Anne-Lise Ménard, Pascaline Etancelin, Philippe Bertrand, Christian Bastard, Hervé Tilly, Fabrice Jardin (Rouen) Les lymphomes B diffus à grandes cellules représentent entre 30 et 40 % des lymphomes non hodgkiniens de l’adulte. Ils sont hétérogènes par leurs caractères histologiques, génétiques et pronostiques. Il est possible d’individualiser deux sous-types principaux, notamment par le profil d’expression génique : les DLBCL GCB (germinal center B-cell like) et les ABC (activated B-cell like). Cette distinction a un impact pronostique puisqu’il est démontré que les DLBCL GCB ont un meilleur pronostic que les ABC [7]. Dans les GCB, les gènes mutés interviennent fréquemment dans la régulation épigénétique (ex. : EZH2 mutation Y641 augmentant la triméthylation de l’histone H3), dans les ABC il s’agit préférentiellement des gènes impliqués dans la voie NF-kB. Dans une cohorte de 161 DLBCL (77 ABC, 62 GCB et 22 intermédiaires) le statut mutationnel de cinq gènes principaux a été analysé par méthode Sanger : - MYD88 est retrouvé muté dans 19 % des DLBCL : 31 % des ABC, 9,7 % des GCB (p = 0,003). La mutation L265P, située dans le domaine TIR et conférant un gain de fonction, est la plus fréquente [8] ; - CARD11 [9] est muté dans les trois sous-types de manière non préférentielle : 11 % des DLBCL, 3,5 % des ABC, 11 % des GCB et 23 % des intermédiaires ; - CD79A et CD79B : 6,5 % des DLBCL sont mutés pour CD79A uniquement dans les ABC, 5,6 % des DLBCL sont mutés pour CD79B : 9 % des ABC, 1,6 % des GCB et 4,5 % des intermédiaires. Pour CD79B il s’agit le plus souvent de la mutation Y196 aboutissant à un gain de fonction par réduction de régulation négative par la kinase Lyn [10] ; - EZH2 : 12 % des DLBCL sont mutés : 24 % des GCB, 3,9 % des ABC et 9 % des intermédiaires. Dans cette étude, 38 % des DLBCL ont au moins une mutation sur les cinq gènes testés (MYD88, CARD11, CD79A/B, EZH2) : 42 % des ABC, 35 % des GCB et 32 % des intermédiaires. Dans 12 % des cas il est retrouvé une double mutation sur deux gènes différents. Il n’a pas été observé de cas avec plus de deux mutations sur ces gènes. Il existe des associations préférentielles : MYD88 (L265P) avec CD79A/B dans les ABC et EZH2 avec CARD11 ou MYD88 (différent de L265P) dans les GCB. Les mutations des gènes de la voie NF-kB sont plus fréquentes dans les ABC mais non exclusives, ABC : 39 %, GCB : 23 %, p = 0,04. Vingt-sept échantillons ont pu être analysés à la rechute de la maladie. Toutes les mutations présentes au diagnostic l’étaient également à la rechute. Il n’a pas été retrouvé de nouvelle mutation à la rechute. Excepté pour l’âge (plus élevé chez les patients avec la mutation MYD88) il n’existe pas de corrélation entre la présentation clinique et biologique des patients au diagnostic (IPI, LDH, Stade Ann Arbor…) et le profil mutationnel [11]. Au niveau clinique, seuls les patients ayant reçu une combinaison rituximab et chimiothérapie ont été analysés. Comme décrit dans la littérature, le profil GCB est de meilleur pronostic que le profil ABC. De plus, la mutation des gènes impliqués dans la voie NF-kB confèrerait un pronostic encore plus défavorable parmi les ABC (figure 3). Hématologie vol. 20 n° supplement 4, mai 2014 15 100 Survie globale (%) 80 60 40 Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 07/02/2017. Mutation NFKB (ABC) 20 WT (24) MT (19) P = 0,0337 0 0 10 20 30 40 50 60 Temps (mois) Figure 3. Courbe de survie globale des DLBCL ABC selon le statut mutationnel des gènes de la voie NFκB. Avec des techniques plus sensibles, le taux de mutations dans les DLBCL devrait être plus élevé. L’objectif serait de personnaliser la prise en charge thérapeutique en fonction des profils mutationnels du lymphome. MicroARN et lymphome folliculaire : une signature originale des cellules tumorales en lien avec les variations d’expression du transcriptome Aurélie Decaux, Gersende Caron, Karin Tarte, Thierry Fest, Céline Pangault (Rennes) Les cellules du lymphome folliculaire (LF) dérivent du centre germinatif. Le réarrangement Bcl2 /IgH a un rôle précoce important auquel s’ajoute des altérations secondaires qui confèrent à la cellule tumorale un avantage de survie [12]. Les miARN sont des petits ARN non codants de 21 à 25 nucléotides agissant comme des régulateurs posttranscriptionnels en réprimant l’expression génique [13]. L’importance du rôle des miARN dans la différenciation lymphocytaire normale [14, 15] et tumorale [16] est aujourd’hui connue. Le travail de l’équipe de Rennes a pour objectif, d’une part, de caractériser le profil miARN dans la différenciation lymphocytaire B tardive et, d’autre part, de mieux comprendre les mécanismes fonctionnels de dérégulation dans le LF par la mise en évidence d’une signature miARN des cellules tumorales intégrée aux données transcriptomiques. 16 Des échantillons de LF (n = 6) et d’amygdales saines (n = 6) ont été triés par cytométrie de flux, l’ARN total extrait des différentes populations cellulaires a servi, d’une part, à établir leurs transcriptomes et, d’autre part, leurs miRNomes [17, 18]. Les centrocytes non tumoraux et les cellules tumorales du LF ont une signature identifiable propre et sensiblement différente dans les deux approches (miRNA et transcriptomique) L’analyse du miRNome (FDR p < 0,05) montre que 49 miARN sont significativement différents entre les centrocytes et les cellules du LF : 14 % sont surexprimés et 86 % sousexprimés dans le LF. Plus de 70 % des miARN significativement surexprimés dans le LF appartiennent aux familles des miARN 26 et 29 (résultats validés par qRT-PCR). Plus de 20 % des miARN significativement sous-exprimés dans les cellules du LF appartiennent au cluster 17-92. Hématologie vol. 20 n° supplement 4, mai 2014 Nouveautés diagnostiques pour les hémopathies malignes : lymphocytes B matures 8 PI3K miR-29 FL _L N 4 CC Signal affy_log2 ∗∗ Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 78.47.27.170 le 07/02/2017. C-MYC miR 17-92 PTEN AKT E2F1 EZH2 miR-26 HDAC3 CCND2 Juan L, Cancer Res, 2011 Gao, Oncol Letter, 20111 mTOR NFKB Antiapoptotique Survie cellulaire Figure 4. Implication des miR-26, miR-29 et cluster 17-92 dans la voie PI3K/AKT. 8. Ngo VN, Young RM, Schmitz R, et al. Oncogenically active MYD88 mutations in human lymphoma. Nature 2011 ; 470 : 115-9. Ces résultats sont d’autant plus intéressants qu’il a été montré dans d’autres cellules que ces deux miRNA 26 et 29 peuvent jouer un rôle dans la voie PI3K/AKT [19] (figure 4). Ainsi ces miRNA pourraient être impliqués dans la prolifération et la survie des cellules LF, ce qui fait l’objet de travaux en cours. 10. Davis RE, Ngo VN, Lenz G, et al. Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma. Nature 2010 ; 463 : 88-92. Conflits d’intérêts : Aucun. 11. Mareschal S, Lanic H, Ruminy P, Bastard C, Tilly H, Jardin F. The proportion of activated B-cell like subtype among de novo diffuse large B-cell lymphoma increases with age. Haematologica 2011 ; 96 : 1888-90. 9. Lenz G, Davis RE, Ngo VN, et al. Oncogenic CARD11 mutations in human diffuse large B cell lymphoma. Science 2008 ; 319 : 1676-9. 12. Roulland S, Faroudi M, Mamessier E, Sungalee S, Salles G, Nadel B. Early steps of follicular lymphoma pathogenesis. Adv Immunol 2011 ; 111 : 1-46. Références 1. Lenz G, Wright G, Dave SS, et al. Stromal gene signatures in large-B-cell lymphomas. N Engl J Med 2008 ; 359 : 2313-23. 2. Wilcox RA, Ristow K, Habermann TM, et al. The absolute monocyte and lymphocyte prognostic score predicts survival and identifies high-risk patients in diffuse large-B-cell lymphoma. Leukemia 2011 ; 25 : 1502-9. 3. Tadmor T, Bari A, Sacchi S, et al. Monocyte count at diagnosis is a prognostic parameter in diffuse large B-cell lymphoma: results from a large multicenter study involving 1191 patients in the pre- and post-rituximab era. Haematologica 2014 ; 99 : 125-30. 4. Gabrilovich DI, Ostrand-Rosenberg S, Bronte V. Coordinated regulation of myeloid cells by tumours. Nat Rev Immunol 2012 ; 12 : 253-68. 5. Greten TF, Manns MP, Korangy F. Myeloid derived suppressor cells in human diseases. Int Immunopharmacol 2011 ; 11 : 802-7. 6. Lin Y, Gustafson MP, Bulur PA, Gastineau DA, Witzig TE, Dietz AB. Immunosuppressive CD14+HLA-DR(low)/- monocytes in B-cell non-Hodgkin lymphoma. Blood 2011 ; 117 : 872-81. 7. Little MP, Heidenreich WF, Li G. Parameter identifiability and redundancy in a general class of stochastic carcinogenesis models. PLoS One 2009 ; 4 : e8520. 13. Esquela-Kerscher A, Slack FJ. Oncomirs - microRNAs with a role in cancer. Nat Rev Cancer 2006 ; 6 : 259-69. 14. Baumjohann D, Ansel KM. MicroRNA regulation of the germinal center response. Curr Opin Immunol 2014 ; 28C : 6-11. 15. Jima DD, Zhang J, Jacobs C, et al. Deep sequencing of the small RNA transcriptome of normal and malignant human B cells identifies hundreds of novel microRNAs. Blood 2010 ; 116 : e118-27. 16. Wang W, Corrigan-Cummins M, Hudson J, et al. MicroRNA profiling of follicular lymphoma identifies microRNAs related to cell proliferation and tumor response. Haematologica 2012 ; 97 : 586-94. 17. Hackenberg M, Sturm M, Langenberger D, Falcon-Perez JM, Aransay AM. miRanalyzer: a microRNA detection and analysis tool for next-generation sequencing experiments. Nucleic Acids Res 2009 ; 37 : W68-76. 18. Caron G, Le Gallou S, Lamy T, Tarte K, Fest T. CXCR4 expression functionally discriminates centroblasts versus centrocytes within human germinal center B cells. J Immunol 2009 ; 182 : 7595-602. 19. Shi-Chen Ou D, Lee SB, Chu CS, Chang LH, Chung BC, Juan LJ. Transcriptional activation of endoplasmic reticulum chaperone GRP78 by HCMV IE1-72 protein. Cell Res 2011 ; 21 : 642-53. Hématologie vol. 20 n° supplement 4, mai 2014 17