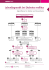P3-Volumenkontrolle - Fresenius Medical Care
Transcription
P3-Volumenkontrolle - Fresenius Medical Care
Peritonealdialyse P³ Volumenkontrolle Flüssigkeitsstatus bestimmen und korrigieren – einfach und praxisnah Information Gambrosol trio Gambrosol trio 10, Peritonealdialyselösung, Gambrosol trio 40, Peritonealdialyselösung. Gambrosol trio 10 / Gambrosol trio 40 ist ein Dreikammerbeutel. Die beiden kleineren Kammern A und B enthalten jeweils eine 50%-ige Glucoselösung. In der größeren Kammer C befindet sich die Elektrolytlösung. Durch Brechen des Dorns zwischen den Kammern A und C und sorgfältigem Mischen der beiden Flüssigkeiten erhält man eine Peritonealdialyselösung (PD-Lösung), die 1,5 % Glucose enthält. Werden auf die gleiche Weise die Inhalte der Kammern B und C gemischt, resultiert eine PD-Lösung, die 2,5 % Glucose enthält. Das Brechen beider Dorne und Mischen der Inhalte aller drei Kammern (A, B und C) führt zu einer PD-Lösung mit 3,9 % Glucose. Zusammensetzung: NACH DER MISCHUNG: 1000 ml der gebrauchsfertigen Lösung enthalten: Gambrosol trio 10: Gemischte Lösung (mmol/l) Kammern A+C Leicht (L) Kammern B+C Mittel (M) Kammern A+C Leicht (L) Kammern B+C Mittel (M) Kammern A+B+C Hoch (H) Natrium Na+ 133 mmol/l 132 mmol/l 131 mmol/l 133 mmol/l 132 mmol/l 131 mmol/l Calcium Ca2+ 1,79 mmol/l 1,75 mmol/l 1,70 mmol/l 1,38 mmol/l 1,35 mmol/l 1,31 mmol/l Magnesium Mg2+ 0,26 mmol/l 0,25 mmol/l 0,24 mmol/l 0,26 mmol/l 0,25 mmol/l 0,24 mmol/l Chlorid Cl– 96,2 mmol/l 96,0 mmol/l 96,0 mmol/l 95,4 mmol/l 95,2 mmol/l 95,2 mmol/l Lactat 41 mmol/l 40 mmol/l 39 mmol/l 41 mmol/l 40 mmol/l 39 mmol/l Glucose 85 mmol/l 139 mmol/l 215 mmol/l 85 mmol/l 139 mmol/l 215 mmol/l Berechnete Osmolarität mOsm / l pH P3 Gambrosol trio 40: Kammern A+B+C Hoch (H) 357 409 483 356 408 482 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 7Kim S, Oh J, Kim S, Chung W, Ahn C, Kim SG, Oh KH. Benefits of biocompatible PD fluid for preservation of residual renal function in incident CAPD patients: a 1-year study. Nephrol Dial Transplant 2009;24(9):2899-90. Konings CJ, Kooman JP, Schonck M, Dammers R, Cheriex E, Palmans 2 Meulemans AP, Hoeks AP, van Kreel B, Gladziwa U, van der Sande FM, Leunissen KM. Fluid status, blood pressure, and cardiovascular abnormalities in patients on peritoneal dialysis. Perit Dial Int 2002;22(4):477-87. 8Haag-Weber M, Krämer R, Haake R, Islam MS, Prischl F, Haug U, Nabut JL, Deppisch R. Low-GDP fluid (Gambrosol trio) attenuates decline of residual renal function in PD patients: a prospective randomized study. On behalf of the DIUREST Study Group. Nephrol Dial Transplant 2010;25(7):2288-96. 3Van Biesen W, Lameire N, Verbeke F, Vanholder R. Residual renal function and volume status in peritoneal dialysis patients: a conflict of interest? J Nephrol 2008;21(3):299-304. 9Williams JD, Topley N, Craig KJ, Mackenzie RK, Pischetsrieder M, Lage C,Passlick-Deetjen J; Euro Balance Trial Group. The Euro-Balance Trial: the effect of a new biocompatible peritoneal dialysis fluid (balance) on the peritoneal membrane. Kidney Int 2004;66(1):408-18. 4Van Biesen W, Williams JD, Covic AC, Fan S, Claes K, et al. (2011) Fluid Status in Peritoneal Dialysis Patients: The European Body Composition Monitoring (EuroBCM) Study Cohort. PLoS ONE 6(2): e17148. doi:10.1371/ journal.pone.0017148 5Luo Y, Lu X, Woods F, Wang T. Volume Control in Peritoneal Dialysis Patients Guided by Bioimpedance Spectroscopy Assessment. Blood Purif 2011;31:296-302. 6Fischbach M, Issad B, Dubois V, and Taamma R. The beneficial influence on the effectiveness of automated peritoneal dialysis of varying the dwell time (short/long) and fill volume (small/large): randomized controlled trial. Perit Dial Int 2011; 31(4):450-8. 10Weiss L, Stegmayr B, Malmsten G, Tejde M, Hadimeri H, Siegert CE, Ahlmén J, Larsson R, Ingman B, Simonsen O, van Hamersvelt HW, Johansson AC, Hylander B, Mayr M, Nilsson PH, Andersson PO, De los Rios T. Biocompatibility and tolerability of a purely bicarbonate-buffered peritoneal dialysis solution. Perit Dial Int 2009;29(6):630-633. 11Rippe B, Simonsen O, Heimbürger O, Christensson A, Haraldsson B, et al. Long-term clinical effects of a peritoneal dialysis fluid with less glucose degradation products. Kidney Int 2001;59(1):348-57. 12Schwenger V, Morath C, Salava A, Amann K, Seregin Y, Deppisch R, Ritz E, Bierhaus A, Nawroth PP, Zeier M. Damage to the peritoneal membrane by glucose degradation products is mediated by the receptor for advanced glycation end-products. J Am Soc Nephrol 2006;17(1):199-207. 13Müller-Krebs S, Kihm LP, Zeier B, Gross ML, Deppisch R, et al. Renal toxicity mediated by glucose degradation products in a rat model of advanced renal failure. Eur J Clin Invest 2008;38(5):296-305. Firmensitz : Fresenius Medical Care Deutschland GmbH · 61346 Bad Homburg v. d. H. · Deutschland Telefon : +49 (0) 6172-609-0 · Fax : +49 (0) 6172-609-2191 Deutschland : Fresenius Medical Care GmbH · Else-Kröner-Straße 1 · 61352 Bad Homburg v. d. H. Telefon : +49 (0) 6172-609-0 · Fax : +49 (0) 6172-609-8740 · E-mail : [email protected] Österreich : Fresenius Medical Care Austria GmbH · Lundenburgergasse 5 · 1210 Wien Telefon : +43 (0) 1-2923501 · Fax : +43 (0) 1-292350185 · E-mail : [email protected] www.fmc-deutschland.com F0000xxxx D (BG 04.12) 1Koc M, Toprak A, Tezcan H, Bihorac A, Akoglu E, Ozener IC. Uncontrolled hypertension due to volume overload contributes to higher left ventricular mass index in CAPD patients. Nephrol Dial Transplant 2002;17(9):1661-6. © Copyright 2011 Fresenius Medical Care Deutschland GmbH Sonstige Bestandteile: Glucosekammern A und B: konzentrierte Salzsäure (37 %), Wasser für Injektionszwecke; Elektrolytkammer C: Natriumhydroxid, Wasser für Injektionszwecke. Anwendungsgebiete: Behandlung von akutem und chronischem Nierenversagen. Behandlung exzessiver Flüssigkeitsretention, bestimmter Formen schwerer Störungen des Elektrolytgleichgewichts (z. B. Hyperkaliämie), die keiner anderen Therapie zugänglich sind. Behandlung von Vergiftungen mit dialysierbaren Substanzen. Gegenanzeigen: Gambrosol trio 10 & Gambrosol trio 40: Hohe Milchsäurekonzentration im Blut (Lactatazidose), niedrige Kaliumkonzentration im Blut (Hypokaliämie). Gambrosol trio 40: niedrige Calciumkonzentration im Blut (Hypocalcämie). Behandlung mit Peritonealdialyse im Allgemeinen: Frische Bauchverletzungen oder Bauchoperationen, Bauchoperationen mit Verwachsungen oder fibrinösen Verklebungen, schwere Bauchhautverbrennungen, abdominelle Perforation; ausgedehnte entzündliche Bauchhautveränderungen (Dermatitis); entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa, Diverticulitis), lokale Bauchfellentzündung (Peritonitis), Bauchdeckenfistel, Eingeweidebruch (Hernie), intra-abdominale Tumore, Darmverschluss (Ileus), Lungenerkrankung – insbesondere Lungenentzündung (Pneumonie), Blutvergiftung (Sepsis), extrem hohe Blutfettwerte (Hyperlipidämie), hohe Harnstoffkonzentration im Blut (Urämie), die mit Peritonealdialyse nicht behandelt werden kann, Mangelernährung (Kachexie) und starker Gewichtsverlust. Patienten, die körperlich und mental nicht in der Lage sind, die Peritoneal dialyse gemäß den Anweisungen des Arztes durchzuführen. Nebenwirkungen: Gambrosol trio 10: hohe Calciumkonzentration im Blut (Hypercalcämie), Gambrosol trio 40: niedrige Calciumkonzentration im Blut (Hypocalcämie), Verursachung oder Verschlechterung eines Hyperparathyreoidismus (Überaktivität der Nebenschilddrüsen), Gambrosol trio 10 & Gambrosol trio 40: Hohe Glucosekonzentration im Blut (Hyperglykämie), niedrige Kaliumkonzentration im Blut (Hypokaliämie), Senkung der Filtration von Blut über das Bauchfell (Senkung der Ultrafiltration), hoher Blutdruck (Hypertonie), Unterleibsschmerz, hohe Milchsäurekonzentration im Blut (Lactatazidose), hohes Flüssigkeitsvolumen im Körper (Hypervolämie), ausgeprägte Müdigkeit (Asthenie), Schüttelfrost, Kopfschmerz, lokale Entzündung des Bauchfells (Peritonitis), Ohnmacht. Warnhinweise: Nur zur intraperitonealen Anwendung. Die Lösung darf nicht intravenös infundiert werden. Auf Undichtigkeiten überprüfen. Nur klare Lösungen verwenden. Nur zum einmaligen Gebrauch bestimmt. Die Lösung sollte direkt nach dem Öffnen des Beutels verwendet werden. Jede nicht verwendete Lösung ist zu entsorgen. Nicht unter 4 °C lagern. Stand: Mai 2011. Fresenius Medical Care Deutschland GmbH, 61346 Bad Homburg v.d.H., Deutschland P3 – Das Gesamtprogramm für die Peritonealdialyse P3 ist das Gesamtprogramm für die Peritoneal dialyse und umfasst die drei Kategorien: Patienten schützen, Peritonealmembran schonen und PD-Therapie sichern. Das P3 Programm unterstützt Sie bei der Verschreibung individueller Therapieprogramme. Dieser Therapieleitfaden ist Teil des P3 Programms. Das P3 Programm ist auf die Verbesserung der Lebensqualität Ihrer Patienten ausgerichtet und begleitet Sie und Ihre Patienten durch alle Schritte im Verlauf der Therapie. Information balance Patienten schützen Peritonealmembran schonen P3 PD-Therapie sichern balance 1,5 % Glucose, 1,75 mmol/l Calcium, Peritonealdialyselösung, balance 2,3 % Glucose, 1,75 mmol/l Calcium, Peritonealdialyselösung, balance 4,25 % Glucose, 1,75 mmol/l Calcium, Peritonealdialyselösung, b alance 1,5 % Glucose, 1,25 mmol/l Calcium, Peritonealdialyselösung, balance 2,3 % Glucose, 1,25 mmol/l Calcium, Peritonealdialyselösung, balance 4,25 % Glucose, 1,25 mmol/l Calcium, Peritonealdialyselösung. Diese Lösungen werden in einem Doppelkammerbeutel abgegeben. Eine Kammer enthält die basische Lactat-Lösung, die andere die saure Glucose-Elektrolyt-Lösung. Durch Öffnen der Trennnaht zwischen den beiden Kammern mischen sich beide Lösungen und es entsteht die neutrale gebrauchsfertige Lösung. Zusammensetzung: 1 l der neutralen gebrauchsfertigen Lösung enthält: balance 1.5% Glucose, 1.75 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.2573 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 15 g. balance 2.3 % Glucose, 1.75 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.2573 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 22.73 g. balance 4.25 % Glucose, 1.75 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.2573 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 42.5 g. balance 1.5% Glucose, 1.25 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.1838 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 15 g. balance 2.3% Glucose, 1.25 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.1838 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 22.73 g. balance 4.25 % Glucose, 1.25 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.1838 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 42.5 g. Sonstige Bestandteile: Wasser für Injektionszwecke, Salzsäure, Natriumhydroxid, Natriumhydrogencarbonat. Anwendungsgebiete: Endstadium (Dekompensation) chronischer Niereninsuffizienz jeder Genese, die mit Peritonealdialyse behandelt wird. Gegenanzeigen: Lösungsbedingte Gegenanzeigen: Lösungen, die 1,5 % / 2,3 % / 4,25 % Glucose, 1,75 mmol/l Calcium enthalten: Hypokaliämie, Hypercalcämie. Lösungen, die 1,5 % / 2,3 % / 4,25 % Glucose, 1,25 mmol/l Calcium enthalten: Hypokaliämie, Hypocalcämie. Lösungen, die 4,25 % Glucose enthalten: zusätzlich Hypovolämie und arterielle Hypotonie. Behandlungsbedingte Gegenanzeigen: Kürzlich erfolgte Bauchoperationen oder Bauchverletzungen, Bauchhautverbrennungen, Bauchwandbrüche (Hernien), ausgedehnte entzündliche Bauchhautveränderungen (Dermatitis), entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa, Diverticulitis), Peritonitis, nicht heilende, nässende Wunden (Fisteln), Darmverschluss (Ileus), Lungenerkrankungen, insbesondere Lungenentzündung (Pneumonie), Stoffwechselstörungen (Lactatazidose), generalisierte Blutvergiftung (Sepsis), extremer Gewichtsverlust (Kachexie), insbesondere wenn eine ausreichende Ernährung nicht möglich ist, Fälle einer Harnvergiftung (Urämie), die mit Hilfe von Peritonealdialyse nicht behandelt werden kann, sehr hohe Fettspiegel im Blut (Hyperlipidämie). Nebenwirkungen: Infektionen: Peritonitis (sehr häufig); Entzündungen der Haut an der Katheteraustrittsstelle und Entzündungen entlang des Kathetertunnels (sehr häufig); Sepsis (sehr selten). Störungen des Hormonhaushalts bei Lösungen, die 1,25 mmol/l Calcium enthalten. Überfunktion der Nebenschilddrüse mit möglichen Störungen des Knochenstoffwechsels. Stoffwechsel- und Ernährungsstörungen: Erhöhte Blutzuckerspiegel; erhöhte Blutfettwerte; Gewichtszunahme aufgrund der regelmäßigen Aufnahme von Glucose aus der Peritonealdialyselösung. Funktionsstörungen des Herzens und der Gefäße: Schneller Puls; erniedrigter oder erhöhter Blutdruck. Funktionsstörungen der Atem organe: Atemnot, die durch Zwerchfellhochstand verursacht sein kann; Schulterschmerzen. Magen-Darm-Beschwerden: Durchfall; Verstopfung; Bauchwandbrüche (Hernien); Dehnungs- und Völlegefühl im Bauchraum. Funktionsstörungen der Niere: Störungen des Elektrolythaushaltes, z.B. verminderte Kaliumspiegel, erhöhte Calciumspiegel in Verbindung mit erhöhter Calciumaufnahme z.B. durch Anwendung von Calcium-haltigen Phosphatbindern oder verminderte Calciumspiegel bei Gabe von Lösungen, die 1,25 mmol/l Calcium enthalten. Allgemeine Störungen, sowie Reaktionen an der Applikations-/Katheteraustrittsstelle: Allgemeines Unwohlsein; Rötungen, Schwellungen, Nässen, Verkrustungen und Schmerzen an der Katheteraustrittsstelle; Schwindel; Ödeme; Störungen des Wasserhaushaltes, die sich entweder in schneller Abnahme (Volumenmangelzustände) oder Zunahme (Überwässerung) des Körpergewichts äußern. Schwere Volumenmangelzustände können bei der Anwendung von Lösungen höherer Glucosekonzentration auftreten. Störungen der Peritonealdialyse: Trübung der auslaufenden Dialyseflüssigkeit; Ein- und Auslaufstörungen der Dialyselösung. Warnhinweise: Nur verwenden, wenn die Lösungen klar und farblos sind und das Behältnis unbeschädigt ist. Nur zum einmaligen Gebrauch. Jeder nicht verwendete Rest der Lösung ist zu verwerfen. Die beiden Lösungen müssen vor der Anwendung gemischt werden. Die gebrauchsfertige Lösung ist innerhalb von 24 Stunden nach dem Mischen zu verwenden. Nicht unter 4 °C aufbewahren. Stand: Dezember 2010. Fresenius Medical Care Deutschland GmbH, 61346 Bad Homburg v.d.H. Information bicaVera ® Der therapeutische Ansatz für ein optimiertes Flüssigkeitsmanagement Das Konzept der P3 Volumenkontrolle bietet einen neuen Ansatz in der Kontrolle und Behandlung des Flüssigkeitsstatus. Kombinieren Sie ein Analysesystem der neuesten Technologie mit einem dementsprechenden therapeutischen Vorgehen. Dieser Leitfaden 2 skizziert mögliche Herangehensweisen bei der Volumenkontrolle von PD-Patienten. Er ersetzt jedoch nicht die ärztliche Evaluation des individuellen Patienten und die Anpassung der Diagnostik und Therapie an die spezifische Situation. bicaVera 1,5 % Glucose, Peritonealdialyselösung, bicaVera 2,3 % Glucose, Peritonealdialyselösung, bicaVera 4,25 % Glucose, Peritonealdialyselösung. bicaVera 1.5% / 2.3% / 4.25% Glucose wird in einem Doppelkammerbeutel abgegeben. Eine Kammer enthält die basische Hydrogencarbonat-Lösung, die andere die saure Glucose-Elektrolyt-Lösung. Durch Öffnen der Trennnaht zwischen den beiden Kammern mischen sich beide Lösungen und es entsteht die gebrauchsfertige Lösung. Zusammensetzung: 1 l der gebrauchsfertigen Lösung enthält: bicaVera 1,5% Glucose: 5,786 g Natriumchlorid, 2,940 g Natriumhydrogencarbonat, 0,2573 g Calciumchlorid-Dihydrat, 0,1017 g Magnesiumchlorid-Hexahydrat, 15,0 g D-Glucose (als Glucose-Monohydrat (Ph.Eur.)). bicaVera 1,5% Glucose: 5,786 g Natriumchlorid, 2,940 g Natriumhydrogencarbonat, 0,2573 g Calciumchlorid-Dihydrat, 0,1017 g Magnesiumchlorid-Hexahydrat, 22,73 g D-Glucose (als Glucose-Monohydrat (Ph.Eur.)). bicaVera 1,5% Glucose: 5,786 g Natriumchlorid, 2,940 g Natriumhydrogencarbonat, 0,2573 g Calciumchlorid-Dihydrat, 0,1017 g Magnesiumchlorid-Hexahydrat, 42,5 g D-Glucose (als Glucose-Monohydrat (Ph.Eur.)). Sonstige Bestandteile: Salzsäure, Natriumhydroxid, Kohlendioxid, Wasser für Injektionszwecke. Anwendungsgebiete: Endstadium (Dekompensation) chronischer Niereninsuffizienz jeder Genese, die mit Peritonealdialyse behandelt werden kann. Gegenanzeigen: Lösungsbedingte Gegenanzeigen: bicaVera 1,5% Glucose: ausgeprägte Hypokalämie, ausgeprägte Hypercalcämie. bicaVera 2,3% / 4,25% Glucose: ausgeprägte Hypokalämie, ausgeprägte Hypercalcämie, Hypovolämie, arterielle Hypotonie. Behandlungsbedingte Gegenanzeigen: Frische Bauchverletzungen oder Bauchoperationen, multiple Voroperationen mit Verwachsungen oder fibrinösen Verklebungen, schwere Bauchhautverbrennungen, abdominelle Perforation; ausgedehnte entzündliche Bauchhautveränderungen (Dermatitis); entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa, Diverticulitis); lokalisierte Bauchfellent zündungen (Peritonitis); krankhafte Fistelgänge im Bauchbereich (interne oder externe Fistelungen); Nabelbrüche, Leistenbrüche, Zwerchfellbruch (Hernien); Geschwülste im Bauchraum (intra-abdominelle Tumore); Darmverschluss (lleus); Lungenerkrankungen (besonders Lungenentzündung); generalisierte Blutvergiftung (Sepsis); extreme Erhöhung der Blutfettwerte (Hyperlipidämie); seltene Fälle einer Harnvergiftung (Urämie), die durch Peritonealdialyse nicht mehr behoben werden können; extreme Mangelernährung (Kachexie) und Gewichtsverlust, insbesondere, wenn eine ausreichende eiweißhaltige Ernährung nicht möglich ist; Patienten, deren physische oder psychische Voraussetzungen eine den Anweisungen des Arztes gemäße Durchführung der Therapie nicht gewährleisten. Nebenwirkungen: Lösungsbedingte Nebenwirkungen: Störungen des Elektrolythaushaltes, z.B. Kaliummangel (Hypokaliämie); Calciumüberschuss (Hypercalcämie) in Verbindung mit einer erhöhten Calciumaufnahme, z.B. durch Verabreichung von calciumhaltigen Phosphatbindern; Störungen des Wasserhaushaltes. Ein schneller Gewichtsverlust, Blutdruckabfall, und/oder Erhöhung der Herzfrequenz (Tachykardie) können einen Volumenmangelzustand anzeigen; Wassereinlagerungen in Gewebe und Lunge (Ödeme), Bluthochdruck und möglicherweise Atemnot können auf eine Überwässerung hinweisen; erhöhte Blutzuckerspiegel; Erhöhung der Blutfettwerte; Gewichtszunahme. Behandlungsbedingte Nebenwirkungen: Bauchfellentzündung (Peritonitis), erkennbar an einer Trübung der auslaufenden Dialyseflüssigkeit, später können Bauchschmerzen, Fieber und Unwohlsein bis hin zur – in sehr seltenen Fällen – generalisierten Infektion (Sepsis) auftreten; Entzündungen an der Katheteraustrittsstelle und Entzündungen entlang des Katheters (Tunnelentzündungen), erkennbar an Rötungen, Schwellungen, Schmerzen, Nässen oder Verkrustungen; Ein- und Auslaufstörungen der Dialyselösung; Durchfall und Verstopfung; Dyspnoe verursacht durch Zwerchfellhochstand; Bauchwandbruch (Hernien); Dehnungs- und Völlegefühl (abdominelle Schmerzen); Schulterschmerzen. Warnhinweise: Nur verwenden, wenn die Lösung klar und farblos und das Behältnis unbeschädigt ist. Nur zum einmaligen Gebrauch. Jeder nicht verwendete Rest der Lösung ist zu verwerfen. Nicht anwenden bevor die beiden Lösungen gemischt sind. Die gebrauchsfertige Lösung ist innerhalb von 24 Stunden nach dem Mischen zu verwenden. Nicht unter 4°C aufbewahren. Stand: Dezember 2010. Fresenius Medical Care Deutschland GmbH, 61346 Bad Homburg v.d.H., Deutschland. EuroBCM Studie – Erhalt der Euvolämie bei PD-Patienten Die Behandlung der Über- bzw. Unterwässerung von PD-Patienten ist essenziell im Hinblick auf die Entstehung kardiovaskulärer Erkrankungen.1, 2 Kardiovaskuläre Erkrankungen stellen die Haupt todesursache von Dialysepatienten dar. Sowohl Überwässerung als auch Unterwässerung können das Mortalitätsrisiko bei PD-Patienten erhöhen – bedingt durch das kardiovaskuläre Risiko und die nachlassende renale Restfunktion.3 Demzufolge ist das Erreichen eines euvolämischen Zustandes zentraler Bestandteil in der Behandlung von PD-Patienten. Wie die EuroBCM Studie zeigte, waren 40 % der 639 untersuchten PD-Patienten normovolämisch und 60 % entweder unter- oder überwässert.⁴ Um die Anzahl euvolämischer PD-Patienten zu erhöhen, bedarf es eines praktischen Ansatzes. Dieser umfasst die Bestimmung des Flüssig keitsstatus der Patienten und – basierend darauf – Einstellung und Erhalt der Euvolämie. Dabei gilt es, die richtige Balance zwischen Aufnahme und Abgabe von Flüssigkeit und Salz zu finden. Auch die Menge der Ultrafiltration und der Urinaus scheidung sollten dabei berücksichtigt werden. EuroBCM Studienergebnisse⁴ Von 639 PD-Patienten aus 28 Zentren in 6 Ländern waren • 40 % normovolämisch • 7 % unterwässert • 53 % überwässert Bei der Bewertung des Flüssigkeitsstatus sind folgende Kriterien von Bedeutung: • Die Berücksichtigung der Ultrafiltrationsmenge reicht allein nicht aus, um den Flüssigkeitsstatus der Patienten zu beurteilen. • Der Flüssigkeitsstatus resultiert hauptsächlich aus dem Gleichgewicht zwischen der Aufnahme und Abgabe von Flüssigkeit und Salz über die Zeit. Beide Seiten sollten daher überwacht werden, um diese Balance im Sinne einer euvolämischen Entwicklung zu fördern. • Die Höhe des Blutdrucks steht in keinem kausalen Zusammenhang mit dem Flüssig keitsstatus von PD-Patienten. Der Flüssigkeitsstatus resultiert hauptsächlich aus dem Gleichgewicht zwischen der Aufnahme und Abgabe von Flüssigkeit und Salz über die Zeit Aufnahme • Wasseraufnahme • Salzaufnahme Abgabe • Urin • Ultrafiltration 3 P³ Volumenkontrolle – Praxisnah den Flüssigkeitsstaus bestimmen und korrigieren Mit Hilfe des Konzeptes der P3 Volumenkontrolle können Sie en uf igk u n d ei t s Tr sta en d 2 na er wache e üb n 1 Fl ü s s hm indem Sie die Flüssigkeitsaufnahme, die renale Restausscheidung und die UF-Rate bestimmen. • Objektive Bestimmung des aktuellen Flüssigkeitsstatus und dessen zeitliche Entwicklung • Flüssigkeitsaufnahme des Patienten und Einhalten diätetischer Vorgaben • Maximierung der Urinabgabe und Erhalt der renalen Restfunktion • Optimierung der Ultrafiltrationsmenge A 3 Der therapeutische Erfolg der Volumenkontrolle hängt von folgenden Faktoren ab: A • zügig den Flüssigkeitsstatus bestimmen und Trends erkennen • frühzeitig therapeutische Maßnahmen einleiten • eine Reihe weiterer praktischer Instrumente zur Volumenkontrolle einsetzen, mm s ti be nen s en tu r k e bg ab e op tim iere n P3 Volumenkontrolle – in drei Schritten zu einer optimierten Volumenkontrolle Schritt 1 Flüssigkeitsstatus bestimmen und Trend erkennen Schritt 2 Aufnahme überwachen Schritt 3 Abgabe optimieren 4 Erkennen Sie Veränderungen im Flüssigkeitshaushalt Sensibilisieren Sie Ihre Patienten hinsichtlich Flüssigkeits- und Salzaufnahme Erhalten Sie nachhaltig die renale Restfunktion, berücksichtigen Sie die peritonealen Transportcharakteristiken Ihrer Patienten und erwägen Sie den Einsatz adaptierter PD-Verfahren Erkennen Sie Veränderungen im Flüssigkeitshaushalt Flüssigkeitsstatus bestimmen und Trend erkennen Routinemäßige Bestimmung des Hydratationszustands Der BCM-Body Composition Monitor ist das erste Analysesystem, mit dessen Hilfe einfach und objektiv der individuelle Flüssigkeitsstatus sowie die Anteile der verschiedenen Gewebetypen (Muskel- und Fettmasse) eines Patienten bestimmt werden können. Der BCM-Body Composition Monitor stellt eine validierte Entscheidungsgrundlage für das therapeutische Flüssigkeitsmanagement von PD-Patienten dar. Analysieren Sie den Trend im Flüssigkeitsstatus Bei jeder Visite können Sie den tatsächlichen Hydratationsstatus Ihrer Patienten bestimmen und überwachen und somit etwaige Probleme frühzeitig erkennen und entsprechende Maßnahmen einleiten.4 Body Composition Plot (Beispiel) 6 Überwässerung (L) 5 4 3 2 1 0 -1 -2 Apr. Mai Jun.Jul. Aug. Sep. Okt. Nov.Dez. MessungenNormbereich Der Body Composition Plot stellt die zeitliche Entwicklung der Überwässerung eines Patienten dar (fiktive Werte) 5 Sensibilisieren Sie Ihre Patienten Bei der Bewertung der Ursachen des Ungleichgewichtes im Flüssigkeitshaushalt der PD-Patienten ist es zwingend notwendig, die Auslöser hierfür zu erkennen. Sensibilisieren Sie Ihre Patienten im Hinblick auf Ursache und Wirkung. Das Konzept der P3 Volumenkontrolle bietet einfache Lösungsmöglichkeiten für das nephrologische Team und Ihre Patienten. Verbessern Sie die Therapietreue im Hinblick auf die Flüssigkeitsaufnahme Eine randomisierte kontrollierte Studie mit dem BCM-Body Composition Monitor lieferte über zeugende Ergebnisse. Patienten, die Kenntnis über ihren Flüssigkeitsstatus hatten, waren weniger überwässert als Patienten, denen man das Messergebnis mit dem BCM-Body Compo sition Monitor nicht mitgeteilt hatte. Somit kann man der Überwässerung allein durch entsprechende Sensibilisierung der Patienten entgegen wirken.5 BCM Gruppe 3,0 Überwässerung (L) Beurteilung der Flüssigkeitsaufnahme Verbesserung im Volumenstatus durch Sensibilisierung⁵ 2,3±1,95 p < 0,05 2,5 1,72±1,51 2,0 1,5 1,0 0 Baseline Nach 3 Monaten Gruppe 1: Patienten und Pflegepersonal waren über den Flüssigkeitsstatus informiert Kontrollgruppe 3,0 Überwässerung (L) Flüssigkeits- und Salz aufnahme überwachen 2,5 p < 0,05 2,52±1,83 2,2±1,66 2,0 1,5 1,0 0 Baseline Nach 3 Monaten Gruppe 2 : Patienten und Pflegepersonal kannten den Flüssigkeitsstatus nicht Abbildungen basierend auf Originalpublikation 6 Adaptierte PD – ein elegantes Konzept für mehr UF Abgabe optimieren Höhere UF⁶ 1000 Im Gegensatz zur konventionellen PD, die üblicherweise als Serie von fortlaufenden Wechseln mit jeweils gleichen Volumina und Verweilzeiten verschrieben wird, wird bei der adaptierten PD ein neuer Ansatz verfolgt: Kleinere Volumina werden für kurze Zeit eingesetzt, um die UF zu optimieren, gefolgt von größeren Volumina mit längeren Verweilzeiten, um die Elimination urämischer Toxine zu fördern. Dabei bleiben die Menge an zugeführter PD-Lösung und die Dauer der Behandlungszeit unverändert. 6 Prinzip der adaptierten PD Verbesserte UF-Rate Erhöhte Clearance 743 ± 275 800 * 656 ± 385 600 400 APD-C APD-A Erhöhte Natriumelimination⁶ Natriumelimination, mmol/Behandlung Adaptierte PD Ultrafiltration ml/Tag *p < 0.01 50 *p < 0.01 40 30 32±52 * 18±48 20 10 0 APD-C APD-A APD-C — Konventionelle APD APD-A — Adaptierte APD Abbildungen basierend auf Originalpublikation Kurze Verweilzeiten Lange Verweilzeiten Kleine Einlaufvolumina Große Einlaufvolumina Die Ergebnisse der Studie belegen, dass das Konzept der adaptieren PD die Effektivität der APD6 und im Prinzip auch der CAPD ver bessern kann. Vorteile der adaptierten APD vs. konventioneller APD⁶ • Erhöhtes UF-Volumen • Verbesserte Na-Elimination • Blutdrucksenkung 7 Setzen Sie Lösungen mit nur minimalem GDP-Gehalt ein Flüssigkeitsabgabe optimieren Maximierung der Flüssigkeitsabgabe durch Erhalt der Nierenrestfunktion (RRF) und der Ultrafiltrationskapazität Der Erhalt der Nierenrestfunktion durch Verwendung von Lösungen mit nur minimalem GDP-Gehalt unterstützt den Flüssigkeitsentzug. Der RRF kommt insgesamt eine bedeutende Rolle bei der Flüssigkeitsabgabe zu. Studien bestätigen, dass PD-Lösungen mit einem nur minimalen Gehalt an Glukoseabbauprodukten (GDP)* die RRF länger erhalten können als konventionelle Lösungen.7, 8 PD-Lösungen mit einem nur minimalen GDP- Gehalt* können darüber hinaus die Peritonealmembran schonen und ihre Funktion erhalten.9, 10, 11 Der Erhalt der renalen Restfunktion ist essenziell für die Urinabgabe und damit für die Regulation des Flüssigkeitshaushaltes. Insofern können Lösungen mit nur minimalem GDP-Gehalt eine wichtige thera peutische Option im Flüssigkeitsmanagement sein. balance kann die renale Restfunktion erhalten ⁷ balance 50 25 0 p = 0,004 GFR L / Wo. /1,73 m² 75 Konventionelle PD-Lösung 1 7 Zeit (Monate) 13 Positive Effekte von balance auf die RRF in Patienten mit einer glomerulären Filtrationsrate von ≥ 2 mL/Min./1,73 m² Abbildung basierend auf Originalpublikation *G lukoseabbauprodukte sind toxisch und können die Peritonealmembran und die RRF schädigen.12, 13 8 Führen Sie Ihre Patienten in Richtung Euvolämie mit dem Konzept der P³ Volumenkontrolle Die Überwachung des Flüssigkeitsstatus und die Behandlung der Hypervolämie sind essenziell in der Behandlung von PD-Patienten. Das Konzept der P3 Volumenkontrolle unterstützt das nephro logische Team bei der Einstellung eines euvolämischen Status ihrer PD-Patienten mit Blutdruck werten im Normbereich. Das Konzept der P3 Volumenkontrolle ist darauf ausgerichtet: • proaktiv und rechtzeitig bei Unausgewogenheit im Flüssigkeitsstatus zu intervenieren • Patienten zum Einhalten ihrer Diätvorgaben zu bewegen • die renale Restfunktion nachhaltig zu bewahren • die Euvolämie zu erreichen und zu erhalten • kardiovaskuläre Komplikationen zu vermeiden. Für eine verbesserte Volumenkontrolle in der Praxis: Bestimmen Sie die individuelle Überwässerung von PD-Patienten mit dem BCM-Composition Monitor und leiten Sie daraus verschiedene therapeutische Ansätze ab. Das Konzept der P3 Volumenkontrolle ist darauf ausgerichtet, die Lebensqualität und Dialyse effektivität Ihrer Patienten verbessern, indem Sie sie dabei unterstützen, ihr mögliches Zielgewicht im Sinne einer ausgeglichenen Flüssigkeitsbilanz zu erreichen. P 3 9 P³ Volumenkontrolle – in drei Schritten zu einem optimierten Flüssigkeitsmangement Schritt 1 Flüssigkeitsstatus bestimmen und Trend erkennen Unterwässerung Normohydratation Überwässerung* Hydratationsstatus < – 1,1 Liter Hydratationsstatus > – 1,1 Liter und < + 1,1 Liter** Hydratationsstatus > 1,1 Liter Schritt 2 Flüssigkeits- und Salzaufnahme überwachen • Überprüfen der Diätvorgaben • Patientenschulungen Schritt 3 Häufige Bestimmungen des Hydratationszustandes, bis Trockengewicht erreicht ist 10 • Wasser- und Salzaufnahme beim Patienten einschränken • Sensibilisieren Sie Ihre Patienten Flüssigkeitsabgabe optimieren • Erhalten Sie die RRF • evtl. Dosisverringerung oder Absetzen der Schleifendiuretika erwägen • Ultrafiltration: passen Sie die PD-Verschreibung an RRF: renale Restfunktion • Wasser- und Salzaufnahme beibehalten • Erhalten Sie die RRF • Gabe von Diuretika ggf. beibehalten • Ultrafiltration: aktuelle Verschreibung beibehalten Monatliche Bestimmungen des Hydratationszustandes, um Komplikationen zu vermeiden • Erhalten Sie die RRF • Evtl. Gabe von Schleifen diuretika bzw. Dosisanpassung erwägen • Ultrafiltration: Passen Sie die PD-Verschreibung den Transportcharakteristika der Membran an (PET Test) • Fassen Sie adaptierte PD ins Auge Häufige Bestimmungen des Hydratationszustandes, bis Trockengewicht erreicht ist * Schließen Sie mechanische Ursachen aus. Falls UF-Versagen vorliegt, kann Icodextrin oder Transfer zur HD in Erwägung gezogen werden. ** Normbereich gesunder Referenzpopulation4 P3 – Das Gesamtprogramm für die Peritonealdialyse P3 ist das Gesamtprogramm für die Peritoneal dialyse und umfasst die drei Kategorien: Patienten schützen, Peritonealmembran schonen und PD-Therapie sichern. Das P3 Programm unterstützt Sie bei der Verschreibung individueller Therapieprogramme. Dieser Therapieleitfaden ist Teil des P3 Programms. Das P3 Programm ist auf die Verbesserung der Lebensqualität Ihrer Patienten ausgerichtet und begleitet Sie und Ihre Patienten durch alle Schritte im Verlauf der Therapie. Information balance Patienten schützen Peritonealmembran schonen P3 PD-Therapie sichern balance 1,5 % Glucose, 1,75 mmol/l Calcium, Peritonealdialyselösung, balance 2,3 % Glucose, 1,75 mmol/l Calcium, Peritonealdialyselösung, balance 4,25 % Glucose, 1,75 mmol/l Calcium, Peritonealdialyselösung, b alance 1,5 % Glucose, 1,25 mmol/l Calcium, Peritonealdialyselösung, balance 2,3 % Glucose, 1,25 mmol/l Calcium, Peritonealdialyselösung, balance 4,25 % Glucose, 1,25 mmol/l Calcium, Peritonealdialyselösung. Diese Lösungen werden in einem Doppelkammerbeutel abgegeben. Eine Kammer enthält die basische Lactat-Lösung, die andere die saure Glucose-Elektrolyt-Lösung. Durch Öffnen der Trennnaht zwischen den beiden Kammern mischen sich beide Lösungen und es entsteht die neutrale gebrauchsfertige Lösung. Zusammensetzung: 1 l der neutralen gebrauchsfertigen Lösung enthält: balance 1.5% Glucose, 1.75 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.2573 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 15 g. balance 2.3 % Glucose, 1.75 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.2573 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 22.73 g. balance 4.25 % Glucose, 1.75 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.2573 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 42.5 g. balance 1.5% Glucose, 1.25 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.1838 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 15 g. balance 2.3% Glucose, 1.25 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.1838 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 22.73 g. balance 4.25 % Glucose, 1.25 mmol/l Calcium: Natriumchlorid 5.640 g, Natriumlactat (als Natriumlactat-Lösung) 3.925 g, Calciumchlorid-Dihydrat 0.1838 g, Magnesiumchlorid-Hexahydrat 0.1017 g, D-Glucose, (als Glucose-Monohydrat (Ph.Eur.)) 42.5 g. Sonstige Bestandteile: Wasser für Injektionszwecke, Salzsäure, Natriumhydroxid, Natriumhydrogencarbonat. Anwendungsgebiete: Endstadium (Dekompensation) chronischer Niereninsuffizienz jeder Genese, die mit Peritonealdialyse behandelt wird. Gegenanzeigen: Lösungsbedingte Gegenanzeigen: Lösungen, die 1,5 % / 2,3 % / 4,25 % Glucose, 1,75 mmol/l Calcium enthalten: Hypokaliämie, Hypercalcämie. Lösungen, die 1,5 % / 2,3 % / 4,25 % Glucose, 1,25 mmol/l Calcium enthalten: Hypokaliämie, Hypocalcämie. Lösungen, die 4,25 % Glucose enthalten: zusätzlich Hypovolämie und arterielle Hypotonie. Behandlungsbedingte Gegenanzeigen: Kürzlich erfolgte Bauchoperationen oder Bauchverletzungen, Bauchhautverbrennungen, Bauchwandbrüche (Hernien), ausgedehnte entzündliche Bauchhautveränderungen (Dermatitis), entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa, Diverticulitis), Peritonitis, nicht heilende, nässende Wunden (Fisteln), Darmverschluss (Ileus), Lungenerkrankungen, insbesondere Lungenentzündung (Pneumonie), Stoffwechselstörungen (Lactatazidose), generalisierte Blutvergiftung (Sepsis), extremer Gewichtsverlust (Kachexie), insbesondere wenn eine ausreichende Ernährung nicht möglich ist, Fälle einer Harnvergiftung (Urämie), die mit Hilfe von Peritonealdialyse nicht behandelt werden kann, sehr hohe Fettspiegel im Blut (Hyperlipidämie). Nebenwirkungen: Infektionen: Peritonitis (sehr häufig); Entzündungen der Haut an der Katheteraustrittsstelle und Entzündungen entlang des Kathetertunnels (sehr häufig); Sepsis (sehr selten). Störungen des Hormonhaushalts bei Lösungen, die 1,25 mmol/l Calcium enthalten. Überfunktion der Nebenschilddrüse mit möglichen Störungen des Knochenstoffwechsels. Stoffwechsel- und Ernährungsstörungen: Erhöhte Blutzuckerspiegel; erhöhte Blutfettwerte; Gewichtszunahme aufgrund der regelmäßigen Aufnahme von Glucose aus der Peritonealdialyselösung. Funktionsstörungen des Herzens und der Gefäße: Schneller Puls; erniedrigter oder erhöhter Blutdruck. Funktionsstörungen der Atem organe: Atemnot, die durch Zwerchfellhochstand verursacht sein kann; Schulterschmerzen. Magen-Darm-Beschwerden: Durchfall; Verstopfung; Bauchwandbrüche (Hernien); Dehnungs- und Völlegefühl im Bauchraum. Funktionsstörungen der Niere: Störungen des Elektrolythaushaltes, z.B. verminderte Kaliumspiegel, erhöhte Calciumspiegel in Verbindung mit erhöhter Calciumaufnahme z.B. durch Anwendung von Calcium-haltigen Phosphatbindern oder verminderte Calciumspiegel bei Gabe von Lösungen, die 1,25 mmol/l Calcium enthalten. Allgemeine Störungen, sowie Reaktionen an der Applikations-/Katheteraustrittsstelle: Allgemeines Unwohlsein; Rötungen, Schwellungen, Nässen, Verkrustungen und Schmerzen an der Katheteraustrittsstelle; Schwindel; Ödeme; Störungen des Wasserhaushaltes, die sich entweder in schneller Abnahme (Volumenmangelzustände) oder Zunahme (Überwässerung) des Körpergewichts äußern. Schwere Volumenmangelzustände können bei der Anwendung von Lösungen höherer Glucosekonzentration auftreten. Störungen der Peritonealdialyse: Trübung der auslaufenden Dialyseflüssigkeit; Ein- und Auslaufstörungen der Dialyselösung. Warnhinweise: Nur verwenden, wenn die Lösungen klar und farblos sind und das Behältnis unbeschädigt ist. Nur zum einmaligen Gebrauch. Jeder nicht verwendete Rest der Lösung ist zu verwerfen. Die beiden Lösungen müssen vor der Anwendung gemischt werden. Die gebrauchsfertige Lösung ist innerhalb von 24 Stunden nach dem Mischen zu verwenden. Nicht unter 4 °C aufbewahren. Stand: Dezember 2010. Fresenius Medical Care Deutschland GmbH, 61346 Bad Homburg v.d.H. Information bicaVera ® Der therapeutische Ansatz für ein optimiertes Flüssigkeitsmanagement Das Konzept der P3 Volumenkontrolle bietet einen neuen Ansatz in der Kontrolle und Behandlung des Flüssigkeitsstatus. Kombinieren Sie ein Analysesystem der neuesten Technologie mit einem dementsprechenden therapeutischen Vorgehen. Dieser Leitfaden 2 skizziert mögliche Herangehensweisen bei der Volumenkontrolle von PD-Patienten. Er ersetzt jedoch nicht die ärztliche Evaluation des individuellen Patienten und die Anpassung der Diagnostik und Therapie an die spezifische Situation. bicaVera 1,5 % Glucose, Peritonealdialyselösung, bicaVera 2,3 % Glucose, Peritonealdialyselösung, bicaVera 4,25 % Glucose, Peritonealdialyselösung. bicaVera 1.5% / 2.3% / 4.25% Glucose wird in einem Doppelkammerbeutel abgegeben. Eine Kammer enthält die basische Hydrogencarbonat-Lösung, die andere die saure Glucose-Elektrolyt-Lösung. Durch Öffnen der Trennnaht zwischen den beiden Kammern mischen sich beide Lösungen und es entsteht die gebrauchsfertige Lösung. Zusammensetzung: 1 l der gebrauchsfertigen Lösung enthält: bicaVera 1,5% Glucose: 5,786 g Natriumchlorid, 2,940 g Natriumhydrogencarbonat, 0,2573 g Calciumchlorid-Dihydrat, 0,1017 g Magnesiumchlorid-Hexahydrat, 15,0 g D-Glucose (als Glucose-Monohydrat (Ph.Eur.)). bicaVera 2,3% Glucose: 5,786 g Natriumchlorid, 2,940 g Natriumhydrogencarbonat, 0,2573 g Calciumchlorid-Dihydrat, 0,1017 g Magnesiumchlorid-Hexahydrat, 22,73 g D-Glucose (als Glucose-Monohydrat (Ph.Eur.)). bicaVera 4,25% Glucose: 5,786 g Natriumchlorid, 2,940 g Natriumhydrogencarbonat, 0,2573 g Calciumchlorid-Dihydrat, 0,1017 g Magnesiumchlorid-Hexahydrat, 42,5 g D-Glucose (als Glucose-Monohydrat (Ph.Eur.)). Sonstige Bestandteile: Salzsäure, Natriumhydroxid, Kohlendioxid, Wasser für Injektionszwecke. Anwendungsgebiete: Endstadium (Dekompensation) chronischer Niereninsuffizienz jeder Genese, die mit Peritonealdialyse behandelt werden kann. Gegenanzeigen: Lösungsbedingte Gegenanzeigen: bicaVera 1,5% Glucose: ausgeprägte Hypokalämie, ausgeprägte Hypercalcämie. bicaVera 2,3% / 4,25% Glucose: ausgeprägte Hypokalämie, ausgeprägte Hypercalcämie, Hypovolämie, arterielle Hypotonie. Behandlungsbedingte Gegenanzeigen: Frische Bauchverletzungen oder Bauchoperationen, multiple Voroperationen mit Verwachsungen oder fibrinösen Verklebungen, schwere Bauchhautverbrennungen, abdominelle Perforation; ausgedehnte entzündliche Bauchhautveränderungen (Dermatitis); entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa, Diverticulitis); lokalisierte Bauchfellent zündungen (Peritonitis); krankhafte Fistelgänge im Bauchbereich (interne oder externe Fistelungen); Nabelbrüche, Leistenbrüche, Zwerchfellbruch (Hernien); Geschwülste im Bauchraum (intra-abdominelle Tumore); Darmverschluss (lleus); Lungenerkrankungen (besonders Lungenentzündung); generalisierte Blutvergiftung (Sepsis); extreme Erhöhung der Blutfettwerte (Hyperlipidämie); seltene Fälle einer Harnvergiftung (Urämie), die durch Peritonealdialyse nicht mehr behoben werden können; extreme Mangelernährung (Kachexie) und Gewichtsverlust, insbesondere, wenn eine ausreichende eiweißhaltige Ernährung nicht möglich ist; Patienten, deren physische oder psychische Voraussetzungen eine den Anweisungen des Arztes gemäße Durchführung der Therapie nicht gewährleisten. Nebenwirkungen: Lösungsbedingte Nebenwirkungen: Störungen des Elektrolythaushaltes, z.B. Kaliummangel (Hypokaliämie); Calciumüberschuss (Hypercalcämie) in Verbindung mit einer erhöhten Calciumaufnahme, z.B. durch Verabreichung von calciumhaltigen Phosphatbindern; Störungen des Wasserhaushaltes. Ein schneller Gewichtsverlust, Blutdruckabfall, und/oder Erhöhung der Herzfrequenz (Tachykardie) können einen Volumenmangelzustand anzeigen; Wassereinlagerungen in Gewebe und Lunge (Ödeme), Bluthochdruck und möglicherweise Atemnot können auf eine Überwässerung hinweisen; erhöhte Blutzuckerspiegel; Erhöhung der Blutfettwerte; Gewichtszunahme. Behandlungsbedingte Nebenwirkungen: Bauchfellentzündung (Peritonitis), erkennbar an einer Trübung der auslaufenden Dialyseflüssigkeit, später können Bauchschmerzen, Fieber und Unwohlsein bis hin zur – in sehr seltenen Fällen – generalisierten Infektion (Sepsis) auftreten; Entzündungen an der Katheteraustrittsstelle und Entzündungen entlang des Katheters (Tunnelentzündungen), erkennbar an Rötungen, Schwellungen, Schmerzen, Nässen oder Verkrustungen; Ein- und Auslaufstörungen der Dialyselösung; Durchfall und Verstopfung; Dyspnoe verursacht durch Zwerchfellhochstand; Bauchwandbruch (Hernien); Dehnungs- und Völlegefühl (abdominelle Schmerzen); Schulterschmerzen. Warnhinweise: Nur verwenden, wenn die Lösung klar und farblos und das Behältnis unbeschädigt ist. Nur zum einmaligen Gebrauch. Jeder nicht verwendete Rest der Lösung ist zu verwerfen. Nicht anwenden bevor die beiden Lösungen gemischt sind. Die gebrauchsfertige Lösung ist innerhalb von 24 Stunden nach dem Mischen zu verwenden. Nicht unter 4 °C aufbewahren. Stand: Dezember 2010. Fresenius Medical Care Deutschland GmbH, 61346 Bad Homburg v.d.H., Deutschland. Peritonealdialyse P³ Volumenkontrolle Flüssigkeitsstatus bestimmen und korrigieren – einfach und praxisnah Information Gambrosol trio Gambrosol trio 10, Peritonealdialyselösung, Gambrosol trio 40, Peritonealdialyselösung. Gambrosol trio 10 / Gambrosol trio 40 ist ein Dreikammerbeutel. Die beiden kleineren Kammern A und B enthalten jeweils eine 50%-ige Glucoselösung. In der größeren Kammer C befindet sich die Elektrolytlösung. Durch Brechen des Dorns zwischen den Kammern A und C und sorgfältigem Mischen der beiden Flüssigkeiten erhält man eine Peritonealdialyselösung (PD-Lösung), die 1,5 % Glucose enthält. Werden auf die gleiche Weise die Inhalte der Kammern B und C gemischt, resultiert eine PD-Lösung, die 2,5 % Glucose enthält. Das Brechen beider Dorne und Mischen der Inhalte aller drei Kammern (A, B und C) führt zu einer PD-Lösung mit 3,9 % Glucose. Zusammensetzung: NACH DER MISCHUNG: 1000 ml der gebrauchsfertigen Lösung enthalten: Gambrosol trio 10: Gemischte Lösung (mmol/l) Kammern A+C Leicht (L) Kammern B+C Mittel (M) Kammern A+C Leicht (L) Kammern B+C Mittel (M) Kammern A+B+C Hoch (H) Natrium Na+ 133 mmol/l 132 mmol/l 131 mmol/l 133 mmol/l 132 mmol/l 131 mmol/l Calcium Ca2+ 1,79 mmol/l 1,75 mmol/l 1,70 mmol/l 1,38 mmol/l 1,35 mmol/l 1,31 mmol/l Magnesium Mg2+ 0,26 mmol/l 0,25 mmol/l 0,24 mmol/l 0,26 mmol/l 0,25 mmol/l 0,24 mmol/l Chlorid Cl– 96,2 mmol/l 96,0 mmol/l 96,0 mmol/l 95,4 mmol/l 95,2 mmol/l 95,2 mmol/l Lactat 41 mmol/l 40 mmol/l 39 mmol/l 41 mmol/l 40 mmol/l 39 mmol/l Glucose 85 mmol/l 139 mmol/l 215 mmol/l 85 mmol/l 139 mmol/l 215 mmol/l Berechnete Osmolarität mOsm / l pH P3 Gambrosol trio 40: Kammern A+B+C Hoch (H) 357 409 483 356 408 482 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 5,5 – 6,5 7Kim S, Oh J, Kim S, Chung W, Ahn C, Kim SG, Oh KH. Benefits of biocompatible PD fluid for preservation of residual renal function in incident CAPD patients: a 1-year study. Nephrol Dial Transplant 2009;24(9):2899-90. Konings CJ, Kooman JP, Schonck M, Dammers R, Cheriex E, Palmans 2 Meulemans AP, Hoeks AP, van Kreel B, Gladziwa U, van der Sande FM, Leunissen KM. Fluid status, blood pressure, and cardiovascular abnormalities in patients on peritoneal dialysis. Perit Dial Int 2002;22(4):477-87. 8Haag-Weber M, Krämer R, Haake R, Islam MS, Prischl F, Haug U, Nabut JL, Deppisch R. Low-GDP fluid (Gambrosol trio) attenuates decline of residual renal function in PD patients: a prospective randomized study. On behalf of the DIUREST Study Group. Nephrol Dial Transplant 2010;25(7):2288-96. 3Van Biesen W, Lameire N, Verbeke F, Vanholder R. Residual renal function and volume status in peritoneal dialysis patients: a conflict of interest? J Nephrol 2008;21(3):299-304. 9Williams JD, Topley N, Craig KJ, Mackenzie RK, Pischetsrieder M, Lage C,Passlick-Deetjen J; Euro Balance Trial Group. The Euro-Balance Trial: the effect of a new biocompatible peritoneal dialysis fluid (balance) on the peritoneal membrane. Kidney Int 2004;66(1):408-18. 4Van Biesen W, Williams JD, Covic AC, Fan S, Claes K, et al. (2011) Fluid Status in Peritoneal Dialysis Patients: The European Body Composition Monitoring (EuroBCM) Study Cohort. PLoS ONE 6(2): e17148. doi:10.1371/ journal.pone.0017148 5Luo Y, Lu X, Woods F, Wang T. Volume Control in Peritoneal Dialysis Patients Guided by Bioimpedance Spectroscopy Assessment. Blood Purif 2011;31:296-302. 6Fischbach M, Issad B, Dubois V, and Taamma R. The beneficial influence on the effectiveness of automated peritoneal dialysis of varying the dwell time (short/long) and fill volume (small/large): randomized controlled trial. Perit Dial Int 2011; 31(4):450-8. 10Weiss L, Stegmayr B, Malmsten G, Tejde M, Hadimeri H, Siegert CE, Ahlmén J, Larsson R, Ingman B, Simonsen O, van Hamersvelt HW, Johansson AC, Hylander B, Mayr M, Nilsson PH, Andersson PO, De los Rios T. Biocompatibility and tolerability of a purely bicarbonate-buffered peritoneal dialysis solution. Perit Dial Int 2009;29(6):630-633. 11Rippe B, Simonsen O, Heimbürger O, Christensson A, Haraldsson B, et al. Long-term clinical effects of a peritoneal dialysis fluid with less glucose degradation products. Kidney Int 2001;59(1):348-57. 12Schwenger V, Morath C, Salava A, Amann K, Seregin Y, Deppisch R, Ritz E, Bierhaus A, Nawroth PP, Zeier M. Damage to the peritoneal membrane by glucose degradation products is mediated by the receptor for advanced glycation end-products. J Am Soc Nephrol 2006;17(1):199-207. 13Müller-Krebs S, Kihm LP, Zeier B, Gross ML, Deppisch R, et al. Renal toxicity mediated by glucose degradation products in a rat model of advanced renal failure. Eur J Clin Invest 2008;38(5):296-305. Firmensitz : Fresenius Medical Care Deutschland GmbH · 61346 Bad Homburg v. d. H. · Deutschland Telefon : +49 (0) 6172-609-0 · Fax : +49 (0) 6172-609-2191 Deutschland : Fresenius Medical Care GmbH · Else-Kröner-Straße 1 · 61352 Bad Homburg v. d. H. Telefon : +49 (0) 6172-609-0 · Fax : +49 (0) 6172-609-8740 · E-mail : [email protected] Österreich : Fresenius Medical Care Austria GmbH · Lundenburgergasse 5 · 1210 Wien Telefon : +43 (0) 1-2923501 · Fax : +43 (0) 1-292350185 · E-mail : [email protected] www.fmc-deutschland.com F0000xxxx D (BG 04.12) 1Koc M, Toprak A, Tezcan H, Bihorac A, Akoglu E, Ozener IC. Uncontrolled hypertension due to volume overload contributes to higher left ventricular mass index in CAPD patients. Nephrol Dial Transplant 2002;17(9):1661-6. © Copyright 2011 Fresenius Medical Care Deutschland GmbH Sonstige Bestandteile: Glucosekammern A und B: konzentrierte Salzsäure (37 %), Wasser für Injektionszwecke; Elektrolytkammer C: Natriumhydroxid, Wasser für Injektionszwecke. Anwendungsgebiete: Behandlung von akutem und chronischem Nierenversagen. Behandlung exzessiver Flüssigkeitsretention, bestimmter Formen schwerer Störungen des Elektrolytgleichgewichts (z. B. Hyperkaliämie), die keiner anderen Therapie zugänglich sind. Behandlung von Vergiftungen mit dialysierbaren Substanzen. Gegenanzeigen: Gambrosol trio 10 & Gambrosol trio 40: Hohe Milchsäurekonzentration im Blut (Lactatazidose), niedrige Kaliumkonzentration im Blut (Hypokaliämie). Gambrosol trio 40: niedrige Calciumkonzentration im Blut (Hypocalcämie). Behandlung mit Peritonealdialyse im Allgemeinen: Frische Bauchverletzungen oder Bauchoperationen, Bauchoperationen mit Verwachsungen oder fibrinösen Verklebungen, schwere Bauchhautverbrennungen, abdominelle Perforation; ausgedehnte entzündliche Bauchhautveränderungen (Dermatitis); entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa, Diverticulitis), lokale Bauchfellentzündung (Peritonitis), Bauchdeckenfistel, Eingeweidebruch (Hernie), intra-abdominale Tumore, Darmverschluss (Ileus), Lungenerkrankung – insbesondere Lungenentzündung (Pneumonie), Blutvergiftung (Sepsis), extrem hohe Blutfettwerte (Hyperlipidämie), hohe Harnstoffkonzentration im Blut (Urämie), die mit Peritonealdialyse nicht behandelt werden kann, Mangelernährung (Kachexie) und starker Gewichtsverlust. Patienten, die körperlich und mental nicht in der Lage sind, die Peritoneal dialyse gemäß den Anweisungen des Arztes durchzuführen. Nebenwirkungen: Gambrosol trio 10: hohe Calciumkonzentration im Blut (Hypercalcämie), Gambrosol trio 40: niedrige Calciumkonzentration im Blut (Hypocalcämie), Verursachung oder Verschlechterung eines Hyperparathyreoidismus (Überaktivität der Nebenschilddrüsen), Gambrosol trio 10 & Gambrosol trio 40: Hohe Glucosekonzentration im Blut (Hyperglykämie), niedrige Kaliumkonzentration im Blut (Hypokaliämie), Senkung der Filtration von Blut über das Bauchfell (Senkung der Ultrafiltration), hoher Blutdruck (Hypertonie), Unterleibsschmerz, hohe Milchsäurekonzentration im Blut (Lactatazidose), hohes Flüssigkeitsvolumen im Körper (Hypervolämie), ausgeprägte Müdigkeit (Asthenie), Schüttelfrost, Kopfschmerz, lokale Entzündung des Bauchfells (Peritonitis), Ohnmacht. Warnhinweise: Nur zur intraperitonealen Anwendung. Die Lösung darf nicht intravenös infundiert werden. Auf Undichtigkeiten überprüfen. Nur klare Lösungen verwenden. Nur zum einmaligen Gebrauch bestimmt. Die Lösung sollte direkt nach dem Öffnen des Beutels verwendet werden. Jede nicht verwendete Lösung ist zu entsorgen. Nicht unter 4 °C lagern. Stand: Mai 2011. Fresenius Medical Care Deutschland GmbH, 61346 Bad Homburg v.d.H., Deutschland


![Hypokaliämie [E87.6] Hypokaliämie [E87.6]](http://s1.doczz.fr/store/data/001398794_1-f6b2899f753bb5bedd6e1bc1015659c2-70x70.png)