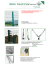merkblatt zum genetischen bibermonitoring
Transcription
merkblatt zum genetischen bibermonitoring
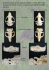
Merkblatt: Haarfallen für genetische Analysen am Biber Wozu benötigt man Biber-Haarfallen? Der Eurasische Biber (Castor fiber) wurde bis auf eine Reliktpopulation an der Elbe in Deutschland ausgerottet. Dank strenger Schutzmaßnahmen und erfolgreicher Wiedereinbürgerung steigt die Gesamtpopulation seit einigen Jahrzehnten wieder. Bei vielen der heutigen Bestände handelt es sich jedoch nicht um den ursprünglich bei uns ansässigen Elbebiber, sondern um Mischbestände aus unterschiedlichen Herkunftsgebieten. Eine Ausnahme bildet der Bestand in Hessen, der auf der Wiederansiedlung von Elbebibern in den Jahren 1987/88 beruht. Im Auftrag des Regierungspräsidium Darmstadt wurden im Senckenberg Labor für Wildtiergenetik molekulargenetische Methoden entwickelt, mit denen die genetische Struktur und Vielfalt der hessischen Biber genauer unter die Lupe genommen werden. Über sogenannte Sequenzuntersuchungen und genetische Fingerabdruckverfahren (Mikrosatellitenanalyse) ist es so möglich, Arten und Unterarten zu bestimmen und den Grad an Vermischung aufzuzeigen. Seit 2010 läuft im Senckenberg Labor für Wildtiergenetik ein Projekt, in dem die genetische Struktur und Diversität des Biberbestandes in Hessen und angrenzender Regionen untersucht wird, um Ausbreitungsmuster zu rekonstruieren, genetische Diversität zu erfassen und den Grad an Vermischung mit benachbarten Biberbeständen zu untersuchen. Die Grundlage für alle genetischen Untersuchungen ist das Vorhandensein von DNA-haltigen Probenmaterial. Neben dem Gewebe von Totfunden wird im Labor des Senckenberg Instituts auch nicht-invasiv gesammeltes Probenmaterial verwendet. Beim Biber eignen sich dafür besonders Haarproben, da sich in den Haarwurzeln DNA-Moleküle befinden. Besonders einfach in der Handhabung und schonend für die Tiere ist eine Stacheldrahtfalle, die über einen Biberwechsel gespannt wird. Im Rahmen eines Pilotprojektes im hessischen Spessart hat sich diese Falle bereits bestens bewährt. Abbildung 1 Links: Stacheldrahtfalle. Mitte: Sequenzausschnitt aus dem Bibergenom; Unterschiede zwischen Arten/ Unterarten sind farbig markiert, Eurasischer Biber (grüner Rahmen) und Kanadischer Biber (roter Rahmen). Rechts: genetisches Profil von vier Individuen an einem Mikrosatellitenlocus. Bau und Anwendung der Biber-Haarfalle Abbildung 2 Wichtige Utensilien für die für die Verwendung von Biberhaarfallen. A Die Biberhaarfalle mit Größenangaben bestehend aus zwei angespitzten Dachlatten und Stacheldraht. B Hammer, um die Dachlatten in die Erde zu schlagen. C Ereignisprotokoll und Stift. D Karte oder GPS-Gerät zur genauen Lokalisierung der Haarfalle. E Latexhandschuhe zum Absammeln des Drahtes. F Probenbeutel zur Aufbewahrung der Haare. G Bunsenbrenner zum Abflammen des Drahtes. H Lockmittel. H Bau: Die Haarfalle besteht aus zwei 60 cm langen, angespitzten Dachlatten, zwischen denen ein etwa 1m langer Stacheldraht gespannt wird. Um den Abstand zwischen den Dornen zu verringern, empfiehlt es sich, den Stacheldraht doppelt zu nehmen. Aufstellen der Fallen: Die vegetationsfreie Zeit eignet sich am besten, da dann die Ausstiege und Wechsel am besten sichtbar sind. Die Fotos (Abb. 3) zeigen typische Biberwechsel, an denen die Stacheldrahtfalle eingesetzt werden kann. Die Fallen sollten direkt an der Uferkante am Ausstieg bzw. Wechsel aufgestellt werden, um dem Biber das Umgehen der Falle zu erschweren. Um einen häufig genutzten Wechsel zu finden, können kleine Zweige in den Boden gesteckt werden, sind diese am nächsten Tag weg bzw. umgeknickt, wird der Weg genutzt und die Dachlatten können auf beiden Seiten des Weges in den Boden geschlagen werden. Als Abstand zwischen Stacheldraht und Boden haben sich 20 cm bewährt. Der Stacheldraht sollte locker gespannt sein, damit die Tiere den Draht nicht als Widerstand sehen und versuchen ihn zu umgehen. Fallen-Kontrolle: Es empfiehlt sich, die Fallen möglichst täglich zu kontrollieren. Für die spätere Auswertung ist ein sorgfältig geführtes Ereignisprotokoll mit Sammler, genauer Orts- bzw. Revierangabe, Datum und Lockmittel wichtig. Da es sich um Proben für genetische Analysen handelt ist ein gründliches Arbeiten mit Einweg-Handschuhen und speziellen Probenbeuteln zur trockenen Lagerung der Haare nötig (siehe Absatz „Haare“ in der beiliegenden Beschreibung zur Probenbenhandlung). Zurückgebliebene Haare am Draht stellen eine potentielle Kontaminationsquelle dar; es empfiehlt sich daher, den Draht nach jeder Kontrolle abzuflammen. Der Einsatz von Lockmitteln wie Äpfel, Weidenäste, Haselzweige oder Hainbuchenästen hilft, ist aber nicht zwingend notwendig. Mehrere Haarbüschel an einer Falle sollten getrennt aufbewahrt werden, da es sich um unterschiedliche Tiere handeln könnte. © J. Herr Abbildung 3 Bilder von Wechseln, die sich für die Anwendung der Haarfalle eignen. Aufgestellte Haarfalle direkt am Ausstieg mit aufgestellten Stöckchen und Haselzweigen. Stacheldraht mit Haaren von Bibern, zu erkennen sind die langen Deckhaare und die Unterwolle, beides mit Haarwurzeln. Behandlung und Versand von Probenmaterial für genetische Analysen A. Allgemeine Hinweise Es gibt zahlreiche Möglichkeiten, Gewebematerial für nachfolgende DNA-Analysen aufzubewahren. Zu beachten ist bei allen unten dargestellten Methoden, dass die Probennahme und -lagerung für eine erfolgreiche genetische Analyse von entscheidender Bedeutung ist. Sie sollte daher stets mit höchster Sorgfalt erfolgen. Ein verfälschtes Analyseergebnis durch Kontamination mit Fremd-DNA ist häufig nicht auf Fehler bei der Laboranalyse, sondern auf unzureichende Vorsichtsmaßnahmen bei der Probenentnahme zurückzuführen. Daher sollten folgende drei Grundregeln immer beachtet werden: 1. 2. 3. 6 Bei allen Probenahme-Schritten werden Einweghandschuhe getragen. Dies dient auch dem Schutz vor Krankheitserregern, die insbesondere durch Kotproben von Wildtieren übertragen werden können. Nach jeder Probenentnahme müssen alle verwendeten Materialien, die in Kontakt mit dem Material gekommen sein 9 8 könnten, ausgetauscht bzw. gründlich gereinigt werden. Die Verwendung von Einwegpinzetten , -skalpellen , etc. ist stets zu bevorzugen. Ist dies nicht möglich, müssen Pinzetten und andere Geräte gründlich mit Wasser UND Ethanol gereinigt und zusätzlich (z. B. mit einem Gasbrenner) abgeflammt werden. Proben sollten möglichst schnell in den unten beschriebenen Zustand überführt werden (getrocknet, tiefgefroren, in Ethanol konserviert). Niemals sollte Probenmaterial in unbehandeltem Zustand verschickt werden. Wir empfehlen, die angegebenen Empfehlungen zur Probenkonservierung genau zu beachten. Nach Rücksprache können wir Ihnen auch Probenpakete zusammenstellen und zusenden. Bitte kontaktieren Sie uns per email oder Telefon, bevor Sie uns eine Probe schicken. Wir senden Ihnen dann ein elektronisches Probeneingangsformular zu, welches Sie uns ausgefüllt zurückschicken. Wir können leider keine Proben ohne Vorhandensein eines ausgefüllten Eingangsformulars bearbeiten. Kontaktdaten: Versandadresse für Proben: Telefon Wildtiergenetik: 06051-61954-3138 email Wildtiergenetik: [email protected] Probenannahme Wildtiergenetik Senckenberg Außenstelle Gelnhausen Clamecystrasse 12, 63571 Gelnhausen Alternativ können Proben auch nach Görlitz geschickt werden. Dies ergibt insbesondere dann Sinn, wenn (nach Rücksprache) Proben morphologisch vorsortiert oder Nahrungsanalysen von Losungsproben vorgenommen werden sollen. Für nähere Informationen hierzu wenden Sie sich bitte an: Prof. Dr. Hermann Ansorge Senckenberg Museum für Naturkunde Görlitz Am Museum 1, 02826 Görlitz Telefon: 03581-47605400 email: [email protected] Abb. 1: Probengefäß1 mit Losungsprobe in 96% Ethanol10 Bestellinformation Verbrauchsmaterial für Probenentnahme 1 Medishop, Mehrzweck-Becher 70 ml gelb, SAR759922721, 100Stck 58,12 € Carl Roth, FTA®-Karten, CL93.1, 25Stck. 103 € 3 Carl Roth, Rotilabo®-Probenbeutel, P279.1, 500Stck, 16,95 € 4 Carl Roth, Trockenmittelbeutel Silica Gel Orange, N077.2, 75Stck 23,80 € 5 Carl Roth, FTA®-Karten mit Farbindikator, CL94.1, 25Stck. 130 € 6 Carl Roth, Rotiprotect-Latex puderfrei, L950.1, 100Stck. 9,95 € 7 Carl Roth, Rotilabo®-Rundfilter, AP80.1, 100Stck. 9,20 € 8 Carl Roth, Einmal-Skalpelle Cutfix®, X006.1, 10Stck. 4,90 € 9 Carl Roth, Rotilabo®-Einmal-Pinzetten steril, KL05.1, 100 Stck.26,00 € 10 Carl Roth, Ethanol 96 % (reinst), P075.3, 1L 55,25 € 11 Carl Roth, Wattestäbchen aus Holz, steril, EH12.1,100 Stck. 8,95 €. 2 www.medishop.de, www.carl-roth.de Abb. 2: Blutprobe auf einer FTA-Karte2 Abb. 3: Ziplock-Beutel3 zur Aufbewahrung von Haarproben mit Filterpapier7, Trocknungsmittel4 und Probenbeschriftung. B. Hinweise zur Behandlung unterschiedlicher Probenarten für genetische Analysen Gewebe wird in kleinen Stücken (etwa 2-5 g) in ein mit etwa 40 ml 96% Ethanol10 gefülltes Plastikgefäß1 gegeben und bei Raumtemperatur oder im Kühlschrank gelagert. Bei längeren Lagerzeiten (mehrere Monate- Jahre) empfiehlt sich die Lagerung in der Tiefkühltruhe. Achtung: größere Mengen an Probengefäßen dürfen nur in explosionsgeschützten Kühl-/Gefrierschränken gelagert werden, daher empfiehlt sich eine Lagerung bei Senckenberg. Sind keine geeigneten Probengefäße vorhanden, kann das Gewebe notfalls auch in anderen Alkohol-gefüllten (möglichst hochprozentig!) Gefäßen gelagert oder (besser) tiefgefroren 2 werden. Alternativ können auch Gewebeabstriche mittels FTA-Karten erfolgen, da sie einfach zu verschicken sind. Hierzu wird ein Stück Gewebe auf eine Filterkarte gequetscht und anschließend getrocknet. Die Proben können dann in einem Ziplock3 4 Beutel mit Trocknungsmittel mit einem einfachen Briefkuvert verschickt werden. Ist nichts zur Hand, empfiehlt sich die Trocknung kleiner Gewebestücke in der Sonne. Blut wird am einfachsten konserviert und verschickt, in dem man wenige Tropfen auf das Feld einer FTA-Karte träufelt und 3 4 trocknen lässt (Abb. 2). Das Papier wird dann in einen Ziplock-Beutel mit Trocknungsmittel gegeben und bei Raum-temperatur gelagert. Die Proben können dann einfach in einem Briefkuvert verschickt werden. Sind keine FTA-Karten zur Hand, können Blutproben im Freiland auch in handelsüblichen EDTA-Röhrchen (Gerinnungshemmer) gesammelt werden, wie es die bei Veterinären übliche Praxis ist. Die Proben müssen dann allerdings sofort und möglichst kühl verschickt werden. Noch besser ist es, die Proben gleich wegzufrieren und auch im gefrorenen Zustand zu versenden. Alternativ dazu kann Blut mit 3 10 Volumenanteilen reinem (mind. 96%) Ethanol versetzt und bei Raumtemperatur gelagert und verschickt werden. Ist nichts zur Hand, kann Blut mit einem Taschentuch o. Papierstück aufgenommen und getrocknet werden. Losungsproben werden in ein mit 40 ml 96% Ethanol gefülltes Plastikgefäß1 gegeben und bei Raumtemperatur oder im Kühlschrank gelagert (Abb. 1). Bei längeren Lagerzeiten (mehrere Monate bis Jahre) empfiehlt sich die Lagerung bei -20°C. Es muss darauf geachtet werden, dass eine Gesamtfüllmenge von 50ml nicht überschritten wird, so dass ein Endverhältnis von etwa 5 Teilen Ethanol zu 1 Teil Losung gegeben ist. Idealerweise benutzt man einen sterilen Gegenstand (Skalpell, Pinzette, gesäuberte, abgeflammte Klinge eines Taschenmessers; auch ein zurechtgeschnittenes Holzstäbchen ist geeignet; so verhindert man eine Kreuzkontamination über eine unsaubere Klinge, wenn keine geeigneten Reinigungsmöglichkeiten vorhanden sind). Bei größeren Kothaufen sollte ein Teil vom Rand der Losung („Anfang“ oder „Ende“) abgetrennt und in das Ethanol-gefüllte Probengefäß gegeben werden. Häufig ist an der Oberfläche der Losung eine glänzende Schleimschicht (Mucus) der Darmschleimhaut vorhanden. Diese Schicht ist besonders gut für DNA-Analysen geeignet und sollte unbedingt mit in das Probengefäß überführt werden. Beim Abkratzen von oberflächennahen Schichten sollte Material bevorzugt werden, welches keinen direkten Bodenkontakt hat. Haare werden am besten in ein gefaltetes Filterpapier7 (oder ein einfaches Stück Papier oder ein weißer Kaffeefilter) gegeben 3 4 und anschließend in einem Ziplock-Beutel mit Trocknungsmittel dunkel und bei Raumtemperatur gelagert (siehe Abb. 3). Notfalls können Haare auch im trockenen Zustand ohne Trocknungsmittel verschickt werden. Grundsätzlich ist bei Haaren zu beachten, dass die Anzahl an trocken gelagerten Haaren mit Haarwurzel für den Erfolg der genetischen Analyse entscheidend ist. Niemals dürfen Haare von einem Stück Fell mit einer Schere abgeschnitten werden, da dann die Wurzeln nicht mitgenommen werden. Bei tiefgefrorenen Kadavern brechen die Haare ab, wenn man sie ausreißt. Hier sollte möglichst ein kleines Stück Fell samt Hautstücken gesammelt und in Ethanol konserviert oder gefroren aufbewahrt werden. Ist dies nicht möglich, sollte der Kadaver einige Minuten bei Raumtemperatur verbleiben, bis die obersten Hautschichten aufgetaut sind. Bitte keine Haare auf Klebeflächen fixieren, da dies die späteren Analysen behindern kann. Das Fixieren der Haare auf Klebestreifen etc. ist nur in Ausnahmefällen nützlich (z.B. wenn man Flächen auf Haar- und Gewebereste absucht, etwa bei forensischen Untersuchungen). Risse Um Speichelproben an Rissen zu gewinnen, werden an geeigneten Stellen am Riss (Wunden, Kehlbiss, Hals nahe der 11 Bissstelle) Abstriche mit sterilen Wattestäbchen gemacht. Wattestäbchen werden hierfür vor dem Abstreichen mit sterilem Wasser oder TE-Puffer angefeuchtet (durch die hohe Kontaminationsgefahr empfehlen wir, Gefäße mit Puffer über uns zu 3 4 beziehen). Nach der Beprobung wird der Tupfer in einen Ziplock-Beutel mit Trocknungsmittel gegeben und bei Raumtemperatur gelagert. Die Abstriche sollten immer mehrfach mit verschiedenen Tupfern an unterschiedlichen Stellen erfolgen, um die Wahrscheinlichkeit einer erfolgreichen Bearbeitung zu erhöhen. Dabei wird der Tupfer mehrfach hin-undhergerieben, um möglichst viel Material aufzunehmen und dann umgehend getrocknet. Zur Beprobung eignen sich auch die von diversen Herstellern angebotenen Tupfer für forensische Analysen, die bereits steril in einem Gefäß zur Lagerung versandt werden (praktisch, aber teuer, und oft ohne Trocknungsmittel). Wichtig ist, dass eine Beprobung so schnell wie möglich nach erfolgtem Riss geschehen muss, möglichst innerhalb von 24 Stunden; nach > 48 Stunden ist eine erfolgreiche Analyse sehr unwahrscheinlich. Bitte die Probe sofort an uns versenden oder für die längere Lagerung wegfrieren (in diesem Fall muss die Probe allerdings auch im gefrorenen Zustand versandt werden. Sonstiges Knochen u. Zähne werden in einen Ziplock-Beutel3 mit Trocknungsmittel4 gegeben und bei 20° C gelagert. Speichel 2 11 wird mittels FTA-Karten oder Wattestäbchen gesammelt. Die behandelte Stelle des Filterpapiers sollte dabei mit einem Stift 5 umkreist werden. Besser eignen sich hierfür FTA-Karten mit Farbindikator . Urin ist nur in größeren Mengen als Probenmaterial 1 geeignet. Im Winter lassen sich oft größere Mengen an Urin im Schnee gewinnen. Urinproben werden in Plastikgefäßen (keine Gefrierbeutel o.ä.) gesammelt und rasch eingefroren. Am besten gefroren verschicken.